
第二章第六节 本节内容要点:光化学反应基础、污染大气中重要的光化学反应等。 污染物在大气中的化学转化,大多是由光化学反应引发所致。对环境化学较重要、研究较多的光化学 反应类型包括光解反应、激发态分子的反应及光催化反应:其中光解反应是造成近地大气层二次污染如光 化学烟雾和酸沉降、消除对流层中活泼化学物质,使之不能进入同温层或导致同温层中部臭氧层耗损的重 要反应,它往往是大气中链式反应的引发反应,是产生活性化学物种和自由基的重要源泉:光解反应对于 大气中许多污染物质的降解和清除起着举足轻重的作用。大气光化学是大气污染化学的重要组成部分,是 对流层和平流层化学过程研究的核心内容,也是大气化学基础研究的前沿领域。 1】光化学反应基础 ·光化学定律 格鲁塞撕(Grotthus)与德雷伯(Drapper)提出了光化学第一定律:只有被分子吸收的光,才能有效地 引起分子的化学变化。此定律是定性的,但它却是近代光化学的重要基储。 Beer-ambert定律给出了定量关系式 lg(Io/I)=E-C-I In(Io/I )=a-C-I 这里I·、I分别是入射光度和透射光强度,1为容器的长度,口I/I为该气体的吸收率, 1921年,爱因斯坦(Einstein)提出了光化学第二定律:在光化学反应的初级过程中,被活化的分子 数(或原子数)等于吸收光的量子数,或者说分子对光的吸收是单光子过程,即光化学反应的初级过程是由 分子吸收光子开始的。此定律又称爱因斯坦光化当量定律,它对激光化学不适用,但仍适用于对流层中的 光化学过程。 。光化学的初级过程和量子产额 一个原子、分子、自由基或离子吸收一个光子所引发的反应,称为光化学反应。光化学反应的起始反 应(初级过程)是: A+hvA*(2-1) 式中A*为A的激发态,激发态物种A*进一步发生下列各种过程。 光解(高)过程:A*B1+B2+(2-2) 直接反应: A*+BC1+C2+…(2-3) 辐射跃迁:A*A+hV(荧光、磷光)(2-4) 无辐射跃迁(撞失活):A*+MA+M(2-5) 其中(2-2)、(2-3)为光化学过程,(2-4、(2-5)为光物理过程。对于大气环境化学来说,光化学过 程最重要的是受激分子会在激发态通过反应面产生新的物种。 根据Einstein公式,E=hv=hC/入,如果一个分子吸收一个光量子,则一摩尔分子吸收的总能量为: E=hvNo=NohC/A 式中:A为光量子的波长:h为普朗克常数,6.626×103)s/光量千:C为光速,2.9979×1010cm5: No为阿伏加德罗常数,6.022×103/mol:代入上式得: E=119.62×106/八 A=300 nm,E=398.7 kJ/mol:A=700 nm,E=170.9 kJ/mol. 一般化学键的健能大于167.4kJ/mol,因此波长大于700m的光量子就不能引起光化学反应. 由于被化学物种吸收了的光量子不一定全部能引起反应,所以引入光量子产额的概念来表示光化学反
第二章 第六节 本节内容要点:光化学反应基础、污染大气中重要的光化学反应等。 污染物在大气中的化学转化,大多是由光化学反应引发所致。对环境化学较重要、研究较多的光化学 反应类型包括光解反应、激发态分子的反应及光催化反应;其中光解反应是造成近地大气层二次污染如光 化学烟雾和酸沉降、清除对流层中活泼化学物质,使之不能进入同温层或导致同温层中部臭氧层耗损的重 要反应,它往往是大气中链式反应的引发反应,是产生活性化学物种和自由基的重要源泉;光解反应对于 大气中许多污染物质的降解和清除起着举足轻重的作用。大气光化学是大气污染化学的重要组成部分,是 对流层和平流层化学过程研究的核心内容,也是大气化学基础研究的前沿领域。 1) 光化学反应基础 ● 光化学定律 格鲁塞斯(Grotthus)与德雷伯(Drapper)提出了光化学第一定律:只有被分子吸收的光,才能有效地 引起分子的化学变化。此定律是定性的,但它却是近代光化学的重要基础。 Beer-lambert 定律给出了定量关系式: lg(I0/ I)=ε·C·l 或 ln(I0/ I )=α·C·l 这里 I0、I 分别是入射光强度和透射光强度,l 为容器的长度,lgI0/I 为该气体的吸收率。 1921 年,爱因斯坦(Einstein)提出了光化学第二定律:在光化学反应的初级过程中,被活化的分子 数(或原子数)等于吸收光的量子数,或者说分子对光的吸收是单光子过程,即光化学反应的初级过程是由 分子吸收光子开始的。此定律又称爱因斯坦光化当量定律,它对激光化学不适用,但仍适用于对流层中的 光化学过程。 ● 光化学的初级过程和量子产额 一个原子、分子、自由基或离子吸收一个光子所引发的反应,称为光化学反应。光化学反应的起始反 应(初级过程)是: A + hν A* (2-1) 式中 A*为 A 的激发态,激发态物种 A*进一步发生下列各种过程。 光解(离)过程: A* B1 + B2 +… (2-2) 直接反应: A* + B C1+C2+… (2-3) 辐射跃迁: A* A + hν (荧光、磷光) (2-4) 无辐射跃迁(碰撞失活): A* + M A+M (2-5) 其中(2-2)、(2-3 )为光化学过程,(2-4)、(2-5)为光物理过程。对于大气环境化学来说, 光化学过 程最重要的是受激分子会在激发态通过反应而产生新的物种。 根据 Einstein 公式, E=hν=hC/λ,如果一个 分子吸收一个光量子,则一摩尔分子吸收的总能量为: E = hνN0 = N0hC/λ 式中:λ为光量子的波长;h 为普朗克常数,6.626×10-34J·s/光量 子;C为光速,2.9979×1010 cm/s; N0为阿伏加德罗常数,6.022×1023/mol;代入上式得: E = 119.62 ×106/λ 若 λ=300 nm , E=398.7 kJ/mol;λ=700 nm , E=170.9 kJ/mol。 一般化学键的键能大于 167.4 kJ/mol,因此波长大于 700 nm 的光量子就不能引起光化学反应。 由于被化学物种吸收了的光量子不一定全部能引起反应,所以引入光量子产额的概念来表 示光化学反

应的效率。光物理过程的相对效率也可用量子产额来表示。 当分子吸收光时,其第「个光化学或光物理过程的初级量子产额φ可由下式给出 削三过程所产生的激发态分子数目(单位体积,单位时间) 吸收的光子数目(单位体积单位时间) 对于光化学过程,一般有两种量子产额:初级量子产额(①)和总量子产额(Φ)。初级量子产额仅表小示初 级过程的相对效率,总量子产额则表示包括初级过程和次级过程在内的总的效率。 如果一个物质在光吸收过程中有部分进行光物理过程,又有部分产生光化学过程,那么,所有初级过 程量子产额之和必定等于1.脚Σp=1.0. 单个初级过程的初级量子产额不会超过1,只能小于1.当化学过程的④<<1时,则说明物理过程 可能是很重要的。但光化学反应的总量子产额可能大于1,甚至远大于1。这是由于光化学初级过程后, 往往件随热反应的次缓过程,特别是发生链式反应,其量子产额可大大增加。例如,H2和C2混合物光解 发生链式反应: Cb+hv→2c Cl.+H2 -HCI H H+C2→HC+CI 2C.→2 该链式反应总量子产额可达10 初级光化学过程包括光解离过程、分子内重排等。分子吸收光后可解离产生原子、自由基等,它们可 通过次级过程进行热反应:光解产生的自由基及原子往往是大气中,O州、O2:和RO,等的重要来源:对流 层和平流层大气中的主要化学反应都与这些自由基或原子的反应有关。 。光化学反应速事与日照强度的关系 对于一般米解打始反应 A+hv-A+C c=(d[C]/dt )/Ia =-(d[A]/dt)/Ia 今R为反应速率,则: R=-d[A]/dt=k[A]k为速率常数 =@e-Ia 由Beer-lambert定律可以导出 I.=I0EA[A] R=k[AJ=@cIoEXIA] k=DJoEλ 式中:I0为入射光(日照)强度,入为物质A对波长入光的吸收系敬, 由于当波长一定时,pc,入是常数,故物质A在单位浓度时的k,主要决定于日照强度10。日照强度(细 射强度)是随太阳光射到地而的角度不同而变化。太阳光线与地面垂线的夹角叫做天顶角(亿),见图2-8。 正午太阳光垂直地面时,Z=0:日出和日落时,Z=90°。图2-9是Z=0和Z=80°时,太阳光强度随波 长的分布示意图
应的效率。光物理过程的相对效率也可用量子产额来表示。 当分子吸收光时,其第 i 个光化学或光物理过程的初级量子产额 φi 可 由下式给出: 对于光化学过程,一般有两种量子产额;初级量子产额(φ)和总量子产额(Φ)。初级量子产额仅表示初 级过程的相对效率,总量子产额则表示包括初级过程和次级过程在内的总的效率。 如果一个物质在光吸收过程中有部分进行光物理过程,又有部分产生光化学过程,那么, 所有初级过 程量子产额之和必定等于 1。即 Σφi =1.0。 单个初级过程的初级量子产额不会超过 1,只能小于 1。当化学过程的 φ<<1 时,则说明物 理过程 可能是很重要的。但光化学反应的总量子产额可能大于 1,甚至远大于 1。这是由于光化学初级过程后, 往往伴随热反应的次级过程,特别是发生链式反应,其量子产额可大大增加。例如,H2和 Cl2混合物光解, 发生链式反应: Cl2 + hν →2Cl· Cl· + H2 →HCl + H· H· + Cl2 →HCl + Cl· 2Cl· →Cl2 该链式反应总量子产额可达 106。 初级光化学过程包括光解离过程、分子内重排等。分子吸收光后可解离产生原子、自由基等,它们可 通过次级过程进行热反应;光解产生的自由基及原子往往是大气中·OH、HO2·和 RO·等的重要来源;对流 层和平流层大气中的主要化学反应都与这 些自由基或原子的反应有关。 ● 光化学反应速率与日照强度的关系 对于一般光解初始反应 A + hν→ A* C φc=(d[C]/dt )/Ia = -(d[ A]/dt)/Ia 令 R 为反应速率,则: R= -d[A]/dt =k[A] k 为速率常数 =φc·Ia 由 Beer-lambert 定律可以导出: Ia=I0ελ[A] R=k[A]=φcI0ελ[A] k=φcI0ελ 式中:I0为入射光(日照)强度,ελ 为物质 A 对波长 λ 光的吸收系数。 由于当波长一定时,φc,ελ 是常数,故物质 A 在单位浓度时的 k,主要决定于日照强度 I0。日照强度(辐 射强度)是随太阳光射到地面的角度不同而变化。太阳光线与地面垂线的夹角 叫做天顶角(Z),见图 2-8。 正午太阳光垂直地面时,Z=0;日出和日落时,Z= 90°。图 2-9 是 Z=0 和 Z=80°时,太阳光强度随波 长的分布示意图
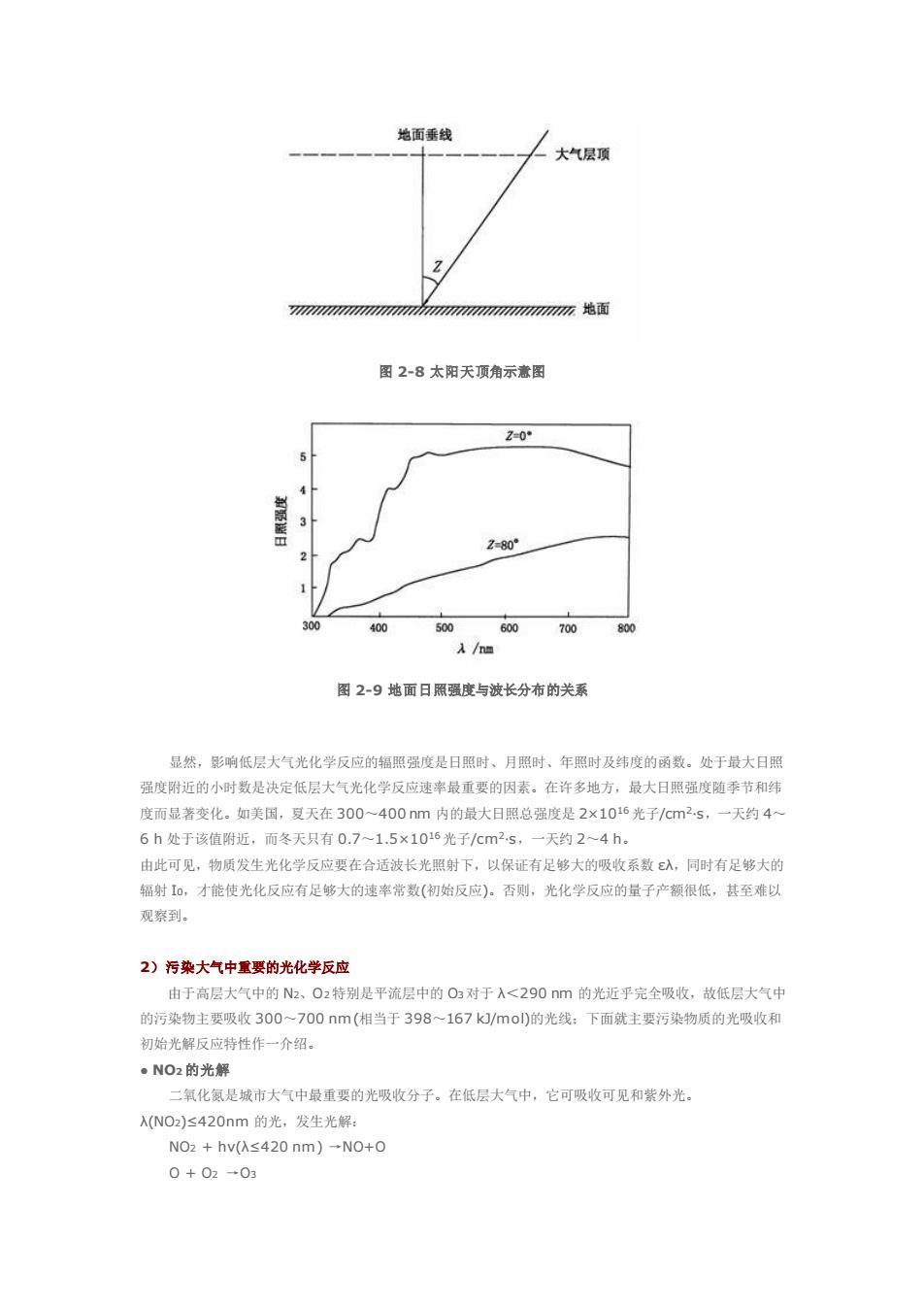
地面垂线 大气层顶 图2-8太阳天顶角示意图 20 2-80 40 500 700 图2-9地面日限强度与波长分布的关系 显然,影响低层大气光化学反应的辐照强度是日照时、月照时、年照时及纬度的函数。处于最大日照 强度附近的小时数是决定低层大气光化学反应速率最重要的因素。在许多地方,最大日照强度随季节和线 度而显著变化。如关国,夏天在300~400nm内的最大日照总强度是2×1016光子/cm2.s,一天约4~ 6h处于该值附近,而冬天只有0.7~1.5×106光于/cm2s 天约2~4h. 由此可见,物质发生光化学反应要在合适波长光照射下,以保证有足够大的吸收系数入,同时有足够大的 辐射1,才能使光化反应有足够大的速率常数(初始反应)。否则,光化学反应的量子产额很低,其至难以 观察到。 2)污染大气中重要的光化学反应 由于高层大气中的、02特别是平流层中的O对于入<290m的光近平完全吸收,故低层大气 的污染物主要吸收300一700nm(相当于398~167k/mol的光线:下面就主要污染物质的光吸收利 初始光解反应特性作一介绍。 。NO2的光解 二氧化氨是城市大气中最重要的光吸收分子。在低层大气中,它可吸收可见和紫外光 A(N0)S420nm的光,发生光解: NO2+hv(≤420nm)-N0+0 0+02-0
图 2-8 太阳天顶角示意图 图 2-9 地面日照强度与波长分布的关系 显然,影响低层大气光化学反应的辐照强度是日照时、月照时、年照时及纬度的函数。处于最大日照 强度附近的小时数是决定低层大气光化学反应速率最重要的因素。在许多地方,最大日照强度随季节和纬 度而显著变化。如美国,夏天在 300~400 nm 内的最大日照总强度是 2×1016光子/cm2·s,一天约 4~ 6 h 处于该值附近,而冬天只有 0.7~1.5×1016光子/cm2·s,一天约 2~4 h。 由此可见,物质发生光化学反应要在合适波长光照射下,以保证有足够大的吸收系数 ελ,同时有足够大的 辐射 I0,才能使光化反应有足够大的速率常数(初始反应)。否则,光化学反应的量子产额很低,甚至难以 观察到。 2)污染大气中重要的光化学反应 由于高层大气中的 N2、O2特别是平流层中的 O3对于 λ<290 nm 的光近乎完全吸收,故低层大气中 的污染物主要吸收 300~700 nm(相当于 398~167 kJ/mol)的光线;下面就主要污染物质的光吸收和 初始光解反应特性作一介绍。 ● NO2 的光解 二氧化氮是城市大气中最重要的光吸收分子。在低层大气中,它可吸收可见和紫外光。 λ(NO2)≤420nm 的光,发生光解: NO2 + hν(λ≤420 nm) →NO+O O + O2 →O3

波长300nm380nm时,p迅速下降:A=405nm时, 0=0.36:当λ>420nm时,Φ=0,即N0z不再发生光离解,其原因在于N-0的键能是305.4kJ/mol, 这相当于400m左右波长光子提供的能量:波长大于400nm的光子,其能量已不足以使键断裂, 。03的光解 O3光解后产生的原子氧和分子氧,是香都为激发态取决于激发能 03+hv(入≤320nm)→02(1△g)+0(1D) 02(1△g)和0(1D)都是激发态。 03+hv(入2320nm)+Oz(1△g或1Σg+)+O(3P) 反应成了自旋禁戒跃迁, 0+hva=440-850nm)-02(x3zg)+0(3P) 0z(x2zg)和0(3P)都是基态.0:光解在A=300nm时,φ=1:A300nm时,p逐渐下降。由O产生的O(1D)一般有两个去除途径,即与水蒸气反应生成:OH,或 被空气去活。 S02的光解 S0z分解成S0和0的离解能为565kJ/mol,这相当于波长为218nm光子的能量,所以在低层 大气中S02不光解:但S02在240~330nm区域有强吸收: S02+hv-S02(1A2.1B1) S02(1A2,1B1)是两种单重激发态。而在340~400nm处有一弱吸收 S02+hw→S023B1) S02(3B1)为三重态。因此。对流层中S02的转化去除不是靠光解反应。然而,所形成激发态分 的化学反应活性有所提高。 。硝酸和烷基硝酸酯的光解 HNO3 (HONO2)+hv -NO2 +OH RONO2 hv -NOz +RO. 上述反应对300nm以上的光吸收弱,所以它们在大气污染化学中并不重要。 。亚硝酸和烷基亚硝酸 HNO2 (HONO)+hv-NO +.OH RONO+hv一NO+RO. 吸收300~400nm光时,上述反应发生光解,它们是仅次于NO2光解的最重要的光解初始反应。 ·的光解 (1)HCH0是对流层大气中的重要光吸收物质,它能吸收290~370m汝长范围内的光,并进行光 解, HCHO hv>HCO+H.A<370 nm &→c0+地A<320nm 其中途径a尤其重要,生成的HC0和H·自由基很快与O2反应生成HO2,是大气HO2:的主菱来源 因而也是0H的来源,当290nm<A<320nm时,Φ为0.71~0.78 (2)乙醛可能的光解过程如下: CHaCHO hy -CH4 CO .CH3+HC-O →CH3C.O+H
波长 300 nm<λ≤380 nm 时,其量子产额 φ≈1;λ>380 nm 时,φ 迅速下降;λ=405 nm 时, φ=0.36;当 λ>420 nm 时,φ=0,即 NO2不再发生光离解。其原因在于 N-O 的键能是 305.4 kJ/mol, 这相当于 400 nm 左右波长光子提供的能量;波长大于 400 nm 的光子,其能量已不足以使键断裂。 ● O3 的光解 O3光解后产生的原子氧和分子氧,是否都为激发态取决于激发能。 O3 + hν(λ≤320 nm) →O2 (1△g) + O (1D) O2 (1△g)和 O(1D)都是激发态。 O3 + hν(λ≥320 nm) →O2 (1△g 或 1Σg+) + O(3P) 反应成了自旋禁戒跃迁。 O3 + hν(λ=440~850 nm) →O2(x3Σg-) + O (3P) O2 (x3Σg-)和 O(3P)都是基态。O3光解在 λ=300 nm 时,φ=1;λ<300 nm 时,φ 值略小于 1; λ >300 nm 时,φ 逐渐下降。由 O3产生的 O(1D)一般有两个去除途径,即与水蒸气反应生成·OH,或 被空气去活。 ● SO2 的光解 SO2分解成 SO 和 O 的离解能为 565 kJ/mol,这相当于波长为 218 nm 光子的能量,所以在低 层 大气中 SO2不光解;但 SO2在 240~330 nm 区域有强吸收: SO2 + hν →SO2 (1A2,1B1) SO2 (1A2,1B1)是两种单重激发态。而在 340~400 nm 处有一弱吸收: SO2 + hν →SO2 (3B1) SO2(3B1)为三重态。因此,对流层中 SO2的转化去除不是靠光解反应。然而 ,所形成激发态分子 的化学反应活性有所提高。 ● 硝酸和烷基硝酸酯的光解 HNO3 (HONO2) + hν →NO2 +·OH RONO2 + hν →NO2 +RO· 上述反应对 300 nm 以上的光吸收弱,所以它们在大气污染化学中并不重要。 ● 亚硝酸和烷基亚硝酸酯 HNO2 (HONO) + hν →NO +· OH RONO + hν →NO + RO· 吸收 300~400 nm 光时,上述反应发生光解,它们是仅次于 NO2光解的最重要的光解初始反应。 ● 醛的光解 (1)HCHO 是对流层大气中的重要光吸收物质,它能吸收 290~370 nm 波长范围内的光,并进行光 解: HCHO + hν HCO·+ H· λ<370 nm CO +H2 λ<320 nm 其中途径 a 尤其重要,生成的 HCO·和 H·自由基很快与 O2反应生成 HO2·,是大气 HO2·的主要来源, 因而也是·OH 的来源。当 290 n m<λ<320 nm 时,Φ 为 0.71~0.78。 (2)乙醛可能的光解过程如下: CH3CHO + hν →CH4 + CO →·CH3 + HC·O →CH3C·O + H·

·过氧化物的光解 过氧化物在300~700nm范围内有微弱吸收,发生如下光解: ROOR'+hv→RO-+R'O. 大气中光化学反应的产物主要是自由基。由于这些自由基的存在,使大气中化学反应活跃,诱发或参 与大量其他反应,使一次污染物转化为二次污染物
● 过氧化物的光解 过氧化物在 300~700 nm 范围内有微弱吸收,发生如下光解: ROOR′+ hν →RO·+ R′O· 大气中光化学反应的产物主要是自由基。由于这些自由基的存在,使大气中化学反应活跃,诱发或参 与大量其他反应,使一次污染物转化为二次污染物