
第三章第四节 本节内容要点:有机物污染指标、分配作用、化学降解、光解、生物降解、挥发、生物富集、耗氧有机物 分解和溶解氧平衡等。 有机污染物按其对环境质量的影响和污染危害,可概略地分为两大类,耗氧有机物和有毒有机物。相 氧有机物指动、植物残体和生活污水及某些工业废水中的碳水化合物、脂防、蛋白质等易分解的有机物, 它们在分解过程中要清耗水中的溶解氧,使水质恶化,其危害主要是通过耗氧过程来实现。有毒有机污染 物指酚、多环芳烃和各种人工合成的具有积累性生物毒性的有机化合物,如多氯联苯、农药及石油污染物, 有机污染物在水环境中的迁移转化主要取决于有机污染物本身的性质以及水体的环境条件,有机污染物 般通过吸附作用、挥发作用、水解作用、光解作用、生物富集和生物降解作用等过程进行迁移转化,研究 这些过程,将有助于明污染物的归趋和可能产生的危害。 1)有机污染程度的指标 水体中有机污染物的种类繁多、组成复杂,现代分析技术难以分别测定它们的含量。因此,只能利用 它们共同的特点,用一些指标间接反映水体中有机物的污染程度。常见的指标有:溶解氧、生化需氧量、 化学需氧量、总有机碳和总需氧量 。溶解氧(dissolved oxygen,简称DO) 溶解氧即在一定温度和压力下,水中溶解氧的含量,是水质的重要指标之一,水中溶解氧含量受到 两种作用的形响,一是耗氧作用。包括耗氧有机物降解的耗氧、生物呼吸耗氧等,使D0下降:另一种是 复氧作用,主要有空气中氧的溶解、水生植物的光合作用等,使DO增加。这两种作用的相互消长,使方 中溶解氧含量呈现时空变化。此外,D0随水温升高而降低,还随水深增加而减小。常温下,水体中D0 为8一14mg/:在水藻聚生的水中,D0可能处于饱和状态:如果水体中的有机污染量较多,耗氧作用 大于复氧作用,水中D0减少:有机物污染严重时,D0为零。在缺氧的水体中,水生动植物生长将受到 抑制,甚至死亡。例如,当D0<49L时,鱼炎将死亡,因此测定水体中的溶解氧含量,可评价水体 污染程度及自净状况。测定水中D0的方法有隙量法、叠氯化钠修正法、KMO4修正法和膜电极法,其中 最常用的是碘量法。 。生化需氧量(biochemicaloxygen demand,BOD) 水体中微生物分解有机物的过程中消耗水中的溶解氧量称为生化需氧量,通常用B0D表示,其单位 为mg(O2)/儿L.B0D反映水体中可被微生物分解的有机物总量.有机物的微生物氧化分解分两个阶段进行 第一阶段主要是有机物被转化为无机的CO2、HO和氨:第二阶段氨被转化为NOz、NO.第二阶段的 环境影响较小,所以生化需氧量一般是指第一阶段有机物经微生物氧化分解所需的氧量。微生物分解有机 物的速度和程度与温度、时间有关。如在20℃时,通常生活污水中的有机物需要20左右才能基本完成 第一阶段的生化氧化,但经过5d也可完成第一阶段转化的70%左右。为缩短测定时间,同时使BOD值 有可比性,因而采用在20℃条件下,培养5测定生化需氧量作为标准方法,称为五日生化需氧量,以 BOD5表示。BOD基本上能反映出有机物在自然状况下氧化分解所清耗的氧量,较确切说明需氧有机污染 物对环境的影响。但BOD的测定时间长,对毒性大的废水因微生物活动受到抑制,而难以准确测定。岩 要尽快知道水中有机物的污染状况,可测定化学需氧量。 ,化学需氧量(chemical oxygen demand,CoD) 水体中能被氧化的物质在规定条件下进行化学氧化过程中所消耗氧化剂的量,以每升水样消耗氧的莞 克数表示,通常称为C0D,其单位为mg(O)/L。水体的C0D值越高,表示有机物污染越严重,水中各 种有机物讲行化学氧化反应的难易程度是不同的,因此化学需氧量只表示在规定多件下,水中被氧化物 质的需氧量的总和。目前测定化学需氧量常用方法有KMO4法和K2CzO7法,前者氧化性相对较,适
第三章 第四节 本节内容要点:有机物污染指标、分配作用、化学降解、光解、生物降解、挥发、生物富集、耗氧有机物 分解和溶解氧平衡等。 有机污染物按其对环境质量的影响和污染危害,可概略地分为两大类,耗氧有机物和有毒有机物。耗 氧有机物指动、植物残体和生活污水及某些工业废水中的碳水化合物、脂肪、蛋白质等易分解的有机物, 它们在分解过程中要消耗水中的溶解氧,使水质恶化,其危害主要是通过耗氧过程来实现。有毒有机污染 物指酚、多环芳烃和各种人工合成的具有积累性生物毒性的有机化合物,如多氯联苯、农药及石油污染物。 有机污染物在水环境中的迁移转化主要取决于有机污染物本身的性质以及水体的环境条件。有机污染物一 般通过吸附作用、挥发作用、水解作用、光解作用、生物富集和生物降解作用等过程进行迁移转化,研究 这些过程,将有助于阐明污染物的归趋和可能产生的危害。 1)有机污染程度的指标 水体中有机污染物的种类繁多、组成复杂,现代分析技术难以分别测定它们的含量。因此,只能利用 它们共同的特点,用一些指标间接反映水体中有机物的污染程度。常见的指标有:溶解氧、生化需氧量、 化学需氧量、总有机碳和总需氧量。 ● 溶解氧(dissolved oxygen,简称 DO) 溶解氧即在一定温度和压力下,水中溶解氧的含量,是水质的重要指标之一。 水中溶解氧含量受到 两种作用的影响,一是耗氧作用,包括耗氧有机物降解的耗氧、生物呼吸耗氧等,使 DO 下降;另一种是 复氧作用,主要有空气中氧的溶解、水生植物的光合作用等,使 DO 增加。这两种作用的相互消长,使水 中溶解氧含量呈现时空变化。此外,DO 随水温升高而降低,还随水深增加而减小。常温下,水体中 DO 为 8~14 mg/L;在水藻繁生的水中,DO 可能处于饱和状态;如果水体中的有机污染量较多,耗氧作用 大于复氧作用,水中 DO 减少;有机物污染严重时,DO 为零。在缺氧的水体中,水生动植物生长将受到 抑制,甚至死亡。例如,当 DO<4 mg/L 时,鱼类将死亡。因此测定水体中的溶解氧含量,可评价水体 污染程度及自净状况。测定水中 DO 的方法有碘量法、叠氮化钠修正法、KMnO4修正法和膜电极法,其中 最常用的是碘量法。 ● 生化需氧量(biochemical oxygen demand,BOD) 水体中微生物分解有机物的过程中消耗水中的溶解氧量称为生化需氧量,通常用 BOD 表示,其单位 为 mg(O2)/L。BOD 反映水体中可被微生物分解的有机物总量。有机物的微生物氧化分解分两个阶段进行。 第一阶段主要是有机物被转化为无机的 CO2、H2O 和氨;第二阶段氨被转化为 NO2 -、NO3 -。第二阶段的 环境影响较小,所以生化需氧量一般是指第一阶段有机物经微生物氧化分解所需的氧量。微生物分解有机 物的速度和程度与温度、时间有关。如在 20℃时,通常生活污水中的有机物需要 20d 左右才能基本完成 第一阶段的生化氧化,但经过 5d 也可完成第一阶段转化的 70%左右。为缩短测定时间,同时使 BOD 值 有可比性,因而采用在 20℃条件下,培养 5 d 测定生化需氧量作为标准方法,称为五日生化需氧量,以 BOD5表示。BOD 基本上能反映出有机物在自然状况下氧化分解所消耗的氧量,较确切说明需氧有机污染 物对环境的影响。但 BOD 的测定时间长,对毒性大的废水因微生物活动受到抑制,而难以准确测定。若 要尽快知道水中有机物的污染状况,可测定化学需氧量。 ● 化学需氧量(chemical oxygen demand,COD) 水体中能被氧化的物质在规定条件下进行化学氧化过程中所消耗氧化剂的量,以每升水样消耗氧的毫 克数表示,通常称为 COD,其单位为 mg(O2)/L。水体的 COD 值越高,表示有机物污染越严重。水中各 种有机物进行化学氧化反应的难易程度是不同的,因此化学需氧量只表示在规定条件下,水中可被氧化物 质的需氧量的总和。目前测定化学需氧量常用方法有 KMnO4法和 K2Cr2O7法,前者氧化性相对较弱,适

用于测定较清洁的水样,后者则用于污染严重的水样和工业废水同一水样用上述两种方法测定的结果是 不同的。因此,在报告化学需氧量的测定结果时要注明测定方法, 同生化需氧量相比较,COD测定不受水质条件限制,测定时何短,但COD不能良好地表示出微生 物所能氧化的有机物量。化学氧化剂不能氧化某些需氧有机物,但能氧化无机还隙性物质(硫化物、亚铁 等),所以,作为需氧有机物污染的评价指标来说,化学需氧量不如生化需氧量合适。但在条件不具备或 受水质限制不能做BOD测定时,可用COD代替。此外,在水质相对稳定的条件下,化学需氧量同生化需 氧量之向有比较密切的相关性。一般,重铬酸钾法C0D>BODs>高锰酸钾法COD。 。总有机碳(TOC)和总需氧量(TOD) 总有机碳(化otal or口anic carbon,简称TOC)是水中几乎全部有机物的含碳量。总需氧最(化otal 一次测 定只需3m左右,可以连续自动测定。它们都可用化学燃烧法测定,前者测定结果以碳表示,后者则以 氧表示需氧有机物的今量。它们是评价水中需氧有机污染物的一种指标。但是,总有机碳和总需氧量的测 定决不是水中有机物的完全氧化,测定时的氧化条件与自然界的氧化条件相差很远,对总需氧量有影响 无机物质未必是自然界的耗氧物质,以及测定器的标准化问题还未完全解决,所以不能把它们当作评价水 体需氧有机污染物的万能指标。由于测定时耗氧过程不同,而且各种水体中有机物成分不同,生化过程为 别也较大,所以各种水质之同,TOC或TOD与BODs不存在圈定的相关性。在水质条件基本相同的条件 下,水体BOD5与TOC或TOD之间有一定的相关性,如日本多摩川河水BOD与TOC的相关系数为0.6 其回归方程为: B0Ds=1.72T0C-1.9(T0C对B0Ds回) B0D5=1.04T0C+4.2(B0D5对T0C回) 而T0D与B0D5之间的相关系数为0.86,其回归方程是, T0D=1.34B0D+4.7TOD对B0D回归1 T0D=1.15B0D+10.4(B0D对T0D回白) D0、C0D,B0D5通常可作为水质评价指标,地面水分级标准见表3-16。 表3-16地面水环境质量标准(mg/L) 1类水 Ⅱ类水 川类水 V类水 V类水 DO2 饱和率90% BOD.≤ 3以下 COD≤ 6 8 10 2)有机物的化学降解 各类有机污染物的共同特点是降解。所消降解就是较高分子量的有机物分解成较小分子量的物质,最 后变成简单化合物(如C02和H2O)的过程.。有机物的降解过程包括化学降解、生物降解和光化学降解,其 中生物降解最为重要。有机物的化学降解可通过氧化、水解、还原等反应完成。 ·氧化反应 有机物的氧化反应是指在有机物分子中的加氧或脱氢的反应。例如 2CH30H+02=2CH20+2H20(脱氢氧化) 2CH20+O2=2HC0OH(伽氧氧化) 各类有机物均能被氧化,化学氧化是有机物降解的重要方式之一。但各类有机物氧化的难易程度差
用于测定较清洁的水样,后者则用于污染严重的水样和工业废水。同一水样用上述两种方法测定的结果是 不同的。因此,在报告化学需氧量的测定结果时要注明测定方法。 同生化需氧量相比较,COD 测定不受水质条件限制,测定时间短,但 COD 不能良好地表示出微生 物所能氧化的有机物量。化学氧化剂不能氧化某些需氧有机物,但能氧化无机还原性物质(硫化物、亚铁 等)。所以,作为需氧有机物污染的评价指标来说,化学需氧量不如生化需氧量合适。但在条件不具备或 受水质限制不能做 BOD 测定时,可用 COD 代替。此外,在水质相对稳定的条件下,化学需氧量同生化需 氧量之间有比较密切的相关性。一般,重铬酸钾法 COD>BOD5>高锰酸钾法 COD。 ● 总有机碳(TOC)和总需氧量(TOD) 总有机碳(total organic carbon,简称 TOC)是水中几乎全部有机物的含碳量。总需氧量(total oxygen demand,简称 TOD)是水中几乎全部可被氧化的物质(基本上是有机物)变成稳定氧化物时所需的 氧量。由于 BOD 测定费时,为实现快速反映有机污染程度的目的,而采用 TOC 与 TOD 测定法,一次测 定只需 3 min 左右,可以连续自动测定。它们都可用化学燃烧法测定,前者测定结果以碳表示,后者则以 氧表示需氧有机物的含量。它们是评价水中需氧有机污染物的一种指标。但是,总有机碳和总需氧量的测 定决不是水中有机物的完全氧化,测定时的氧化条件与自然界的氧化条件相差很远,对总需氧量有影响的 无机物质未必是自然界的耗氧物质,以及测定器的标准化问题还未完全解决,所以不能把它们当作评价水 体需氧有机污染物的万能指标。由于测定时耗氧过程不同,而且各种水体中有机物成分不同,生化过程差 别也较大,所以各种水质之间,TOC 或 TOD 与 BOD5不存在固定的相关性。在水质条件基本相同的条件 下,水体 BOD5与 TOC 或 TOD 之间有一定的相关性。如日本多摩川河水 BOD 与 TOC 的相关系数为 0.6, 其回归方程为: BOD5=1.72TOC-1.9 (TOC 对 BOD5回归) BOD5=1.04TOC+4.2 (BOD5对 TOC 回归) 而 TOD 与 BOD5之间的相关系数为 0.86,其回归方程是: TOD=1.34BOD+4.7 (TOD 对 BOD 回归) TOD=1.15BOD+10.4 (BOD 对 TOD 回归) DO、COD、BOD5通常可作为水质评价指标,地面水分级标准见表 3-16。 表 3-16 地面水环境质量标准(mg/L) 2) 有机物的化学降解 各类有机污染物的共同特点是降解。所谓降解就是较高分子量的有机物分解成较小分子量的物质,最 后变成简单化合物(如 CO2和 H2O)的过程。有机物的降解过程包括化学降解、生物降解和光化学降解,其 中生物降解最为重要。有机物的化学降解可通过氧化、水解、还原等反应完成。 ● 氧化反应 有机物的氧化反应是指在有机物分子中的加氧或脱氢的反应。例如: 2CH3OH + O2 = 2CH2O + 2H2O (脱氢氧化) 2CH2O + O2 = 2HCOOH (加氧氧化) 各类有机物均能被氧化,化学氧化是有机物降解的重要方式之一。但各类有机物氧化的难易程度差
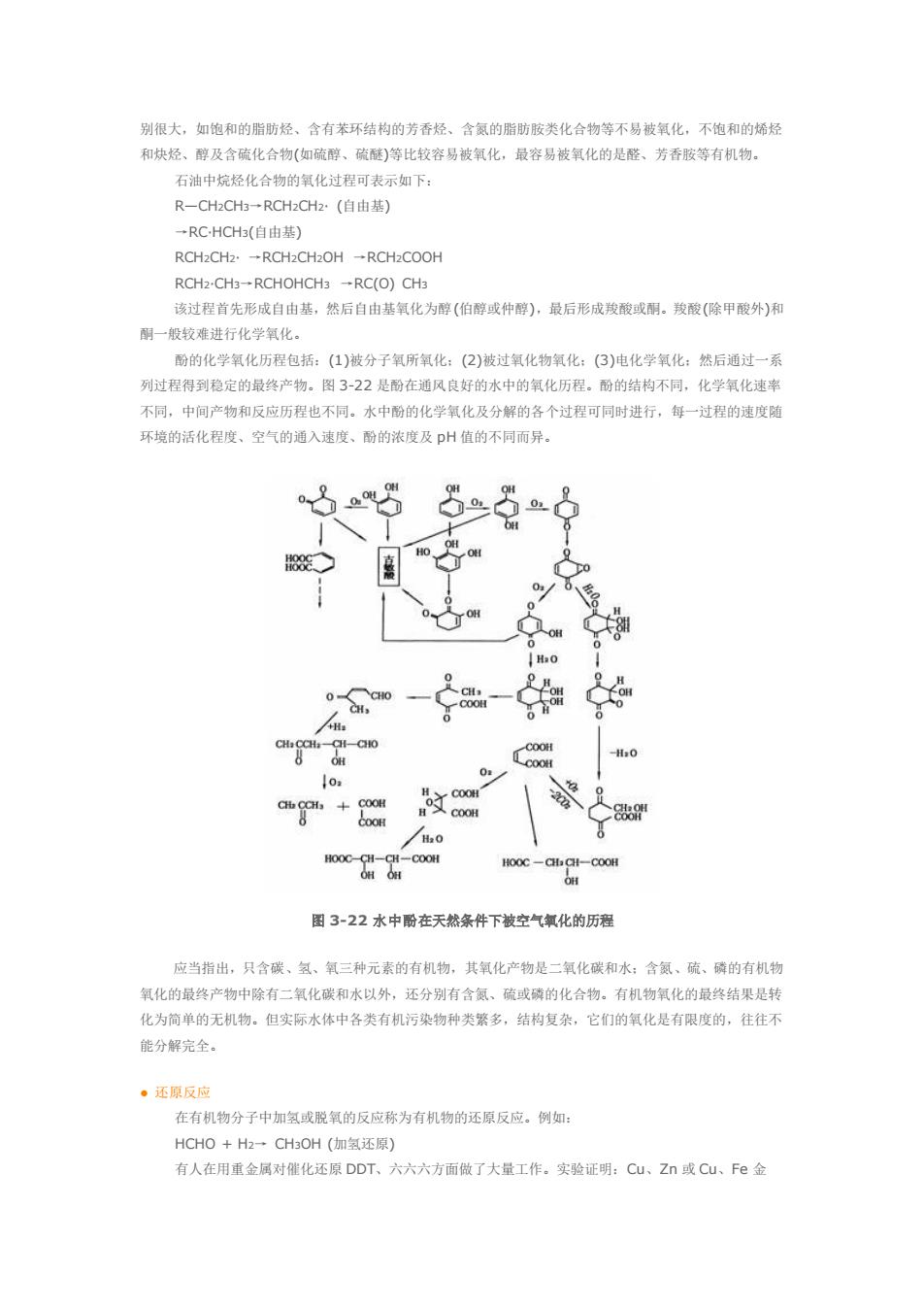
别很大,如饱和的脂防烃、含有苯环结构的芳香经、含氯的脂肪胺类化合物等不易被氧化,不饱和的烯 和块烃、醇及含硫化合物(如硫醇、碳醚)等比较容易被氧化,最容易被氧化的是醛、芳香胺等有机物 石油中烷经化合物的氧化过程可表示如下 R-CHCH一RCH2CH2:·(自由基) →RC.HCH3(自由基) ROH2CH2·→RCH2CH2OH→RCH2COOH RCH2-CH3-RCHOHCH3-RC(O)CHa 该过程首先形成自由基,然后自由基氧化为醇(伯醇或仲醇),最后形成羧酸或刷。羧酸(除甲酸外)利 酮一般较难进行化学氧化。 酚的化学氧化历程包括:(1)被分子氧所氧化:(2)被过氧化物氧化:(3)电化学氧化:然后通过一系 列过程得到稳定的最终产物。图3-22是酚在通风良好的水中的氧化历程。酚的结构不同,化学氧化速半 不同,中间产物和反应历程也不同。水中酚的化学氧化及分解的各个过程可同时进行,每一过程的速度随 环境的活化程度、空气的通入速度、酚的浓度及p值的不同而异。 0 H.O 0 h文c 图3-22水中酚在天然条件下被空气氧化的历程 应当指出,只含碳、氢、氧三种元素的有机物,其氧化产物是二氧化碳和水:含氢、硫、磷的有机物 氧化的最终产物中除有二氧化碳和水以外,还分别有含氯、硫或磷的化合物。有机物氧化的最终结果是转 化为简单的无机物。但实际水体中各类有机污染物种类繁多,结构复杂,它们的氧化是有限度的,往往不 能分解完全, 。原反应 在有机物分子中加氢或脱氧的反应称为有机物的还原反应。例如: HCHO+H2一CH3OH(如氧还原) 有人在用重金属对催化还原DDT、六六六方而微了大量工作。实验证明:Cu、Z或Cu、Fe金
别很大,如饱和的脂肪烃、含有苯环结构的芳香烃、含氮的脂肪胺类化合物等不易被氧化,不饱和的烯烃 和炔烃、醇及含硫化合物(如硫醇、硫醚)等比较容易被氧化,最容易被氧化的是醛、芳香胺等有机物。 石油中烷烃化合物的氧化过程可表示如下: R—CH2CH3→RCH2CH2· (自由基) →RC·HCH3(自由基) RCH2CH2· →RCH2CH2OH →RCH2COOH RCH2·CH3→RCHOHCH3 →RC(O) CH3 该过程首先形成自由基,然后自由基氧化为醇(伯醇或仲醇),最后形成羧酸或酮。羧酸(除甲酸外)和 酮一般较难进行化学氧化。 酚的化学氧化历程包括:(1)被分子氧所氧化;(2)被过氧化物氧化;(3)电化学氧化;然后通过一系 列过程得到稳定的最终产物。图 3-22 是酚在通风良好的水中的氧化历程。酚的结构不同,化学氧化速率 不同,中间产物和反应历程也不同。水中酚的化学氧化及分解的各个过程可同时进行,每一过程的速度随 环境的活化程度、空气的通入速度、酚的浓度及 pH 值的不同而异。 图 3-22 水中酚在天然条件下被空气氧化的历程 应当指出,只含碳、氢、氧三种元素的有机物,其氧化产物是二氧化碳和水;含氮、硫、磷的有机物 氧化的最终产物中除有二氧化碳和水以外,还分别有含氮、硫或磷的化合物。有机物氧化的最终结果是转 化为简单的无机物。但实际水体中各类有机污染物种类繁多,结构复杂,它们的氧化是有限度的,往往不 能分解完全。 ● 还原反应 在有机物分子中加氢或脱氧的反应称为有机物的还原反应。例如: HCHO + H2→ CH3OH (加氢还原) 有人在用重金属对催化还原 DDT、六六六方面做了大量工作。实验证明:Cu、Zn 或 Cu、Fe 金

属对可将DDT还原为DDD,将六六六还原为苯及氯离子 六六六催化还原的总反应式可表示如下: CHsC6屋对◆CsH6+6C 实验表明:在中性条件下,Zn或F©对六六六均无还原作用,只有与Cu组成金属对以后才能将六六 六还原。这说明金属对有很好的还原作用。金属对在水中犹如一个小电池,与水中极少量的氢离子发生电 子转移,产生下述一系列反应: Cu'Zn +2H+Cu Zn2++2H HCI-H++C- 氢离子反复参与了反应,古至六六六反应完毕。在反应中Z成Fe起了还原剂作用。C2+起催化作 用。实验还表明:在酸性条件下,由于氢离子浓度较高,故上述反应根快。但若在纯丙酮介质中,由于无 氢离子,所以六六六不被金属对还原,因此,有机物还原时存在着溶剂效应和温度效应。 。水解反应 有机物在酸或碱的催化下,与水反应生成分子量较小的物质,该反应为有机物的水解降解反应。一 酯类物质容易水解,饱和的卤代经也能在碱催化下水解。在通常情况下,不饱和卤代经及芳香经如氯乙烯、 氯苯、多氯联苯等极难水解】 有机污染物水解薇况 (a)羧酸酯类 发酸酯的水解反应可表示如下: RCOOR+H20 -RCOOH R'OH 水解产物是羧酸和醇。水解反应可被酸、碱的催化,其速度随温度升高而增加,并与酯的性质有关。 表3-17列出了25℃、pH7时溶液中若干羧酸酯水解半衰期的计算值。 表3-1725℃、pH7濬液中部分羧胶酯水解半衰期值 羧鲨酯 的能 由表可见,不同骏酸酯水解半衰期有较大差别。显然,对半衰期长的骏酸酯,若无其他途径转化,则 可在天然水中长期存在,其中对环境最有影响的是苯二甲酸酷系列,如邻苯二甲酸-双(2-乙基己基)脂等。 (b)氨基甲酸酯 氨基甲酸酯类物质如除草剂N何(氯苯)瓦基苯甲酸异丙酯,在碱催化下可发生以下两种水解反应」
属对可将 DDT 还原为 DDD,将六六六还原为苯及氯离子。 六六六催化还原的总反应式可表示如下: C6H6Cl6 金属对→ C6H6 + 6Cl- 实验表明:在中性条件下,Zn 或 Fe 对六六六均无还原作用,只有与 Cu 组成金属对以后才能将六六 六还原。这说明金属对有很好的还原作用。金属对在水中犹如一个小电池,与水中极少量的氢离子发生电 子转移,产生下述一系列反应: Cu-Zn + 2H+ = Cu + Zn2+ + 2H C6H6Cl6 + 6H = C6H6 + 6HCl HCl→ H+ + Cl- 氢离子反复参与了反应,直至六六六反应完毕。在反应中 Zn 或 Fe 起了还原剂作用,Cu2+起催化作 用。实验还表明:在酸性条件下,由于氢离子浓度较高,故上述反应很快。但若在纯丙酮介质中,由于无 氢离子,所以六六六不被金属对还原。因此,有机物还原时存在着溶剂效应和温度效应。 ● 水解反应 有机物在酸或碱的催化下,与水反应生成分子量较小的物质,该反应为有机物的水解降解反应。一般 酯类物质容易水解,饱和的卤代烃也能在碱催化下水解。在通常情况下,不饱和卤代烃及芳香烃如氯乙烯、 氯苯、多氯联苯等极难水解。 有机污染物水解概况 (a) 羧酸酯类 羧酸酯的水解反应可表示如下: RCOOR′ + H2O → RCOOH + R′OH 水解产物是羧酸和醇。水解反应可被酸、碱的催化,其速度随温度升高而增加,并与酯的性质有关。 表 3-17 列出了 25℃、pH 7 时溶液中若干羧酸酯水解半衰期的计算值。 表 3-17 25℃、pH 7 溶液中部分羧酸酯水解半衰期值 由表可见,不同羧酸酯水解半衰期有较大差别。显然,对半衰期长的羧酸酯,若无其他途径转化,则 可在天然水中长期存在,其中对环境最有影响的是苯二甲酸酯系列,如邻苯二甲酸-双(2-乙基己基)酯等。 (b)氨基甲酸酯 氨基甲酸酯类物质如除草剂 N-间(氯苯)氨基苯甲酸异丙酯,在碱催化下可发生以下两种水解反应:
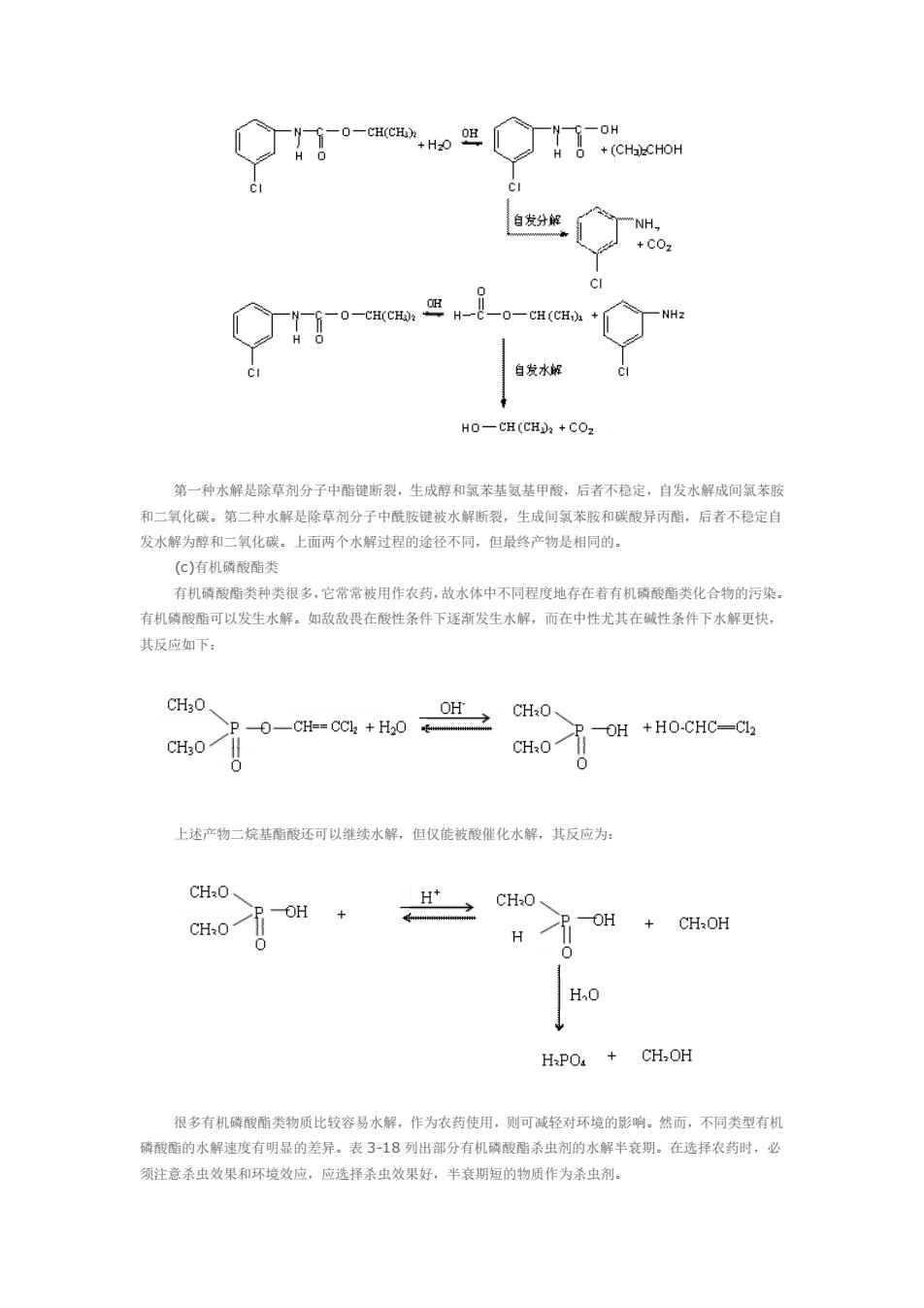
co. -o-CH(CH 自发水 40 CH(CH)+COz 第一种水解是除草剂分子中階键断裂,生成醇和氧苯基氨基甲酸,后者不稳定,自发水解成间氯苯胺 和二氧化碳。第二种水解是除草剂分子中酰键被水解断袋,生成间氯苯胺和碳酸异丙酯。后者不稳定 发水解为醇和二氧化碳,上面两个水解过程的途径不同,但最终产物是相同的。 (C)有机磷酸酯类 有机磷酸酯类种类很多,它常常被用作农药,故水体中不同程度地存在着有机磷酸酯类化合物的污染 有机磷酸酯可以发生水解。如敌敌畏在酸性条件下逐渐发生水解,而在中性尤其在碱性条件下水解更快, 其反应如下: P-OH +HO-CHC-CI 上述产物二基酯酸还可以继续水解,但仅能被酸催化水解,其反应为 CP-OH CH0、 H>OH+GHH HaPO.+CH,OH 很多有机磷酸酯类物质比较容易水解,作为农药使用,则可减轻对环境的影响。然面,不同类型有机 膜酸酯的水解速度有明显的差异。表3-18列出部分有机磷酸酯杀虫剂的水解半衰期。在选择农药时,必 须注意杀虫效果和环境效应,应选择杀虫效果好,半衰明短的物质作为杀虫剂
第一种水解是除草剂分子中酯键断裂,生成醇和氯苯基氨基甲酸,后者不稳定,自发水解成间氯苯胺 和二氧化碳。第二种水解是除草剂分子中酰胺键被水解断裂,生成间氯苯胺和碳酸异丙酯,后者不稳定自 发水解为醇和二氧化碳。上面两个水解过程的途径不同,但最终产物是相同的。 (c)有机磷酸酯类 有机磷酸酯类种类很多,它常常被用作农药,故水体中不同程度地存在着有机磷酸酯类化合物的污染。 有机磷酸酯可以发生水解。如敌敌畏在酸性条件下逐渐发生水解,而在中性尤其在碱性条件下水解更快, 其反应如下: 上述产物二烷基酯酸还可以继续水解,但仅能被酸催化水解,其反应为: 很多有机磷酸酯类物质比较容易水解,作为农药使用,则可减轻对环境的影响。然而,不同类型有机 磷酸酯的水解速度有明显的差异。表 3-18 列出部分有机磷酸酯杀虫剂的水解半衰期。在选择农药时,必 须注意杀虫效果和环境效应,应选择杀虫效果好,半衰期短的物质作为杀虫剂

表3-18部分有机病酸酯杀虫剂的水解半表期值(25℃,pH7.4) 名弥 19 14.0 10.5.h 130d (d)卤代物 不少饱和卤代烃可以水解,并能被碱催化,水解反应可用下式表示: R RC—X +H20 OH+H☒ 卤代烃的水解速度可以有很大的差别(见表3-19)。 水解的酸、碱能化 不少有机物的水解反应在酸或碱催化下可以加快。下面以骏酸酯为例作一简单讨论。 表3-19部分饱和卤代烃的水解半表期值(25℃,pH7) 名称 t.n 名称 t.n CH-F 30 (CH-)-CCI 23S CH-Cl 339d 704 CH-B 20d CH.I 10d CH.CHCICH 3d 7000 a(lppm) 28d 15 溶液中的水分子,H艹和OH均可参与羧酸酯的水解,故水解速率是下列平行水解反应速度的总和 H0中性水解 →R'COOH+ROH(速辛席数k R COOR H酸性水 →R'COOH+ROH(速率常数k) OH性水解 R'COO +ROH(速华席数) d[R'COOR]/dt =(Kn+Ka[H*]+Kb[OH]}[R'COOR] Kh[R'COOR]
表 3-18 部分有机磷酸酯杀虫剂的水解半衰期值(25℃,pH7.4) (d)卤代物 不少饱和卤代烃可以水解,并能被碱催化,水解反应可用下式表示: 卤代烃的水解速度可以有很大的差别(见表 3-19)。 水解的酸、碱催化 不少有机物的水解反应在酸或碱催化下可以加快。下面以羧酸酯为例作一简单讨论。 表 3-19 部分饱和卤代烃的水解半衰期值(25℃,pH7) 溶液中的水分子,H+和 OH-均可参与羧酸酯的水解,故水解速率是下列平行水解反应速度的总和: -d[R′COOR]/dt = {Kn + Ka[H+]+ Kb[OH-]}[R′COOR] = Kh[R′COOR]

其中K=K+Ka[H]+K[OH] K为骏酸酯水解反应速率常数。从上式看出,在一定温度下羧酸酯的水解速率取决于其类别(K Ka、K值不同)、浓度和介质的DH 如果其他条件一定,发酸酯的水解反应为一级反应 t1/2=0.693/Kh 表3-20列出了25℃,pH7时,酯酸乙酯和酷酸苯酯水解半衰期的计算值。表中可见,在近中性天 然水中酷酸苯酯水解比酯酸乙酯快得多。实际上,不同类型羧酯的水解速率是有差别的 表3-20附酸乙酯和嚼酸苯霜kh和t1/2的计算位(pH7) 名称 k0的 [o] 酷酸乙酯 1.1×10 1.5×1010 1.1×10-9 1.1×10 2.04 酷酸苯酯 7.8×10126.8×10-3 1.4×10-7 2.1X10-7 38d 介质DH改变可引起酯水解速率的变化,其变化值可通过计算k求得。俊酸酯水解常数与DH的关系, 见图3-23.从图中可知,当水体pH值大钓超过点1b所对应pH值时,羧酸酯的水解以碱催化为主:当 pH值大约低于点an所对应pH值时,羧酸酯的水解以酸催化为主:而当水体pH大约在Ian和b两点所 对应的pH值之间时,骏酸酯以中性水解为主,其速率最慢。 pH 图3-23骏酸酯Igkh与pH关系 水解的吸附嘘化 在水中悬浮物、底泥(或土壤)的吸附作用下,面使某些有机物水解速率加快的现象,称为水解的吸 附催化。关于吸附催化有机物水解的机理,目前还没有完全搞清楚。其中比较成热的是除草剂阿特拉津的 吸附催化水解模型。阿特拉津可以缓慢地水解,形成羟基阿特拉津
其中 Kh = Kn + Ka[H+]+ Kb[OH-] Kh为羧酸酯水解反应速率常数。从上式看出,在一定温度下羧酸酯的水解速率取决于其类别(Kn、 Ka、Kb 值不同)、浓度和介质的 pH。 如果其他条件一定,羧酸酯的水解反应为一级反应: t1/2 = 0.693/Kh 表 3-20 列出了 25℃,pH 7 时,醋酸乙酯和醋酸苯酯水解半衰期的计算值。表中可见,在近中性天 然水中醋酸苯酯水解比醋酸乙酯快得多。实际上,不同类型羧酯的水解速率是有差别的。 表 3-20 醋酸乙酯和醋酸苯酯 kh 和 t1/2 的计算值(pH7) 介质 pH 改变可引起酯水解速率的变化,其变化值可通过计算 kn求得。羧酸酯水解常数与 pH 的关系, 见图 3-23。从图中可知,当水体 pH 值大约超过点 Inb 所对应 pH 值时,羧酸酯的水解以碱催化为主;当 pH 值大约低于点 Ian所对应 pH 值时,羧酸酯的水解以酸催化为主;而当水体 pH 大约在 Ian和 Inb 两点所 对应的 pH 值之间时,羧酸酯以中性水解为主,其速率最慢。 图 3-23 羧酸酯 lgkh 与 pH 关系 水解的吸附催化 在水中悬浮物、底泥(或土壤)的吸附作用下,而使某些有机物水解速率加快的现象,称为水解的吸 附催化。关于吸附催化有机物水解的机理,目前还没有完全搞清楚。其中比较成熟的是除草剂阿特拉津的 吸附催化水解模型。阿特拉津可以缓慢地水解,形成羟基阿特拉津
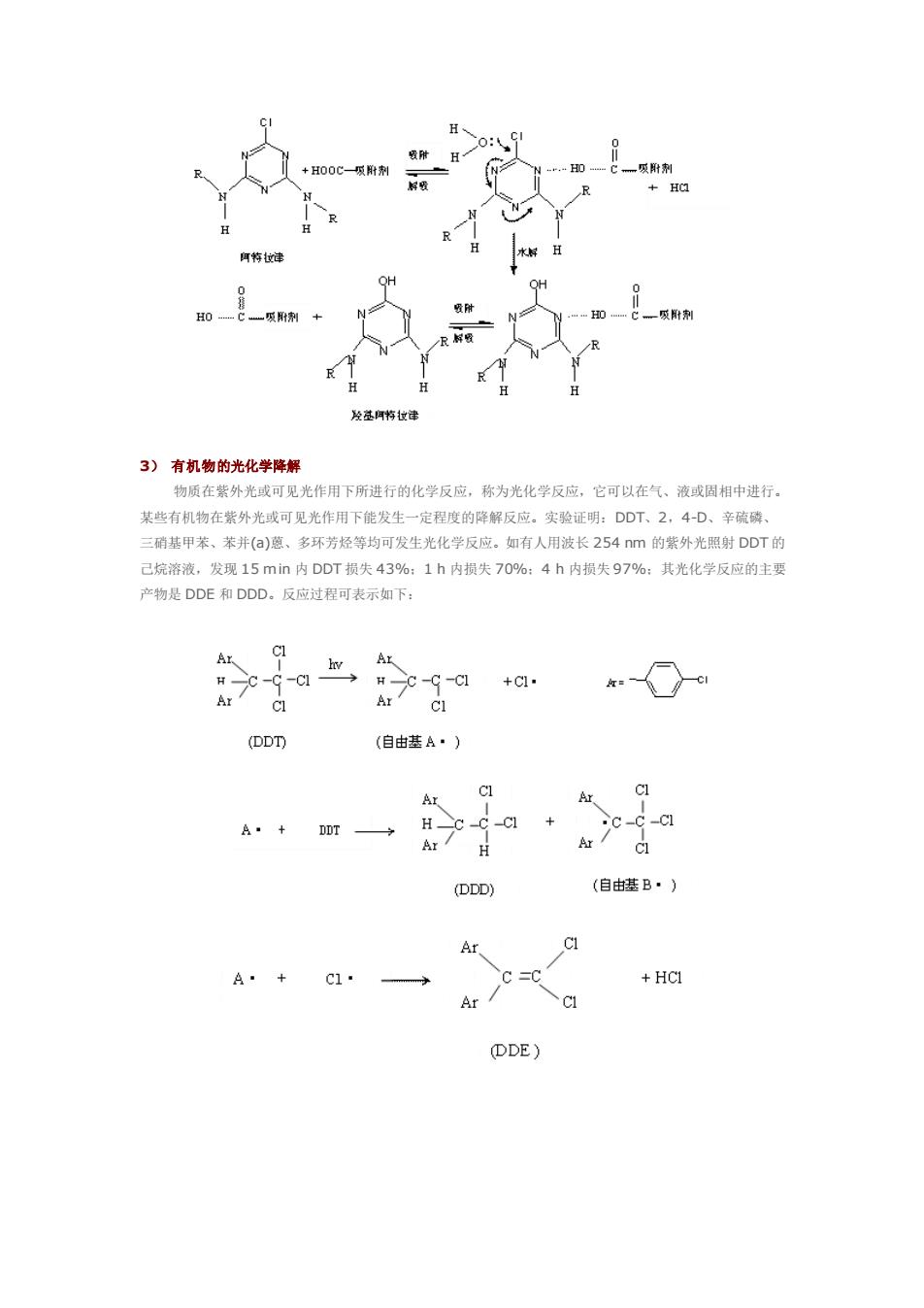
3)有机物的光化学降解 物质在紫外光或可见光作用下所进行的化学反应,称为光化学反应,它可以在气、液或固相中进行 某些有机物在紫外光或可见光作用下能发生一定程度的降解反应。实验证明:DDT、2,4-D、辛硫磷 三硝基甲苯、苯并()葱、多环芳烃等均可发生光化学反应。如有人用波长254nm的紫外光照射DDT的 己烷溶液,发现15mn内DDT损失43%:1h内损失70%:4h内损失97%:其光化学反应的生要 产物是DDE和DDD。反应过程可表示如下: - Ar (自由基A·) Ar Ar Cl+ C c-ci Ar A (DDD) (自由基B·) Ar A·+C1· C=0 +HCI Ar/ DDE)
3) 有机物的光化学降解 物质在紫外光或可见光作用下所进行的化学反应,称为光化学反应,它可以在气、液或固相中进行。 某些有机物在紫外光或可见光作用下能发生一定程度的降解反应。实验证明:DDT、2,4-D、辛硫磷、 三硝基甲苯、苯并(a)蒽、多环芳烃等均可发生光化学反应。如有人用波长 254 nm 的紫外光照射 DDT 的 己烷溶液,发现 15 min 内 DDT 损失 43%;1 h 内损失 70%;4 h 内损失 97%;其光化学反应的主要 产物是 DDE 和 DDD。反应过程可表示如下:

DDE+CI·→HC+B· A·+BL→DDT+DDE 即DDT分子吸收光能后,使分子直链上碳氯键断裂,产生活泼的自由基,自由基进一步同其他成分 作用得到产物DDD和DDE. 陈朝晖等研究了六六六在水溶液中的光化学降解,发现六六六(BC)在近紫外区难以直接吸收光能而 发生光化学降解.BC的光降解方式主要是通过与光解产生的活性中间体反应而发生的.在水落液中BHG 的光化学降解是通过与水中其他分子产生的水合电子(9)反应而进行的,即: +eaa-CeHeCls.+C+H2O 光解的主要产物是氯离子和还原脱氧后的化合物,因而其光化学降解过程主要是还原脱氯, 孔今仁研究了用不同光源照射模拟天然水中的苯并(a)蓝(BaA)和装并(a)花(BaP),表明其光解反园 均为一级反应。若用阳光照射时,BA和BP的光分解速率数分别为0.142/h,0.135h:如用紫外 线(6mw心m)照射,则光解速率常数分别为0.056h,和0.098/h。光强是影响光解的主要因素,水中 溶解氧能在阳光或紫外光的催化下氧化BaA,如除去溶解氧,光照未能使BaA发生变化,介质酸度(DH5 9)对光解没有影响。BaA的光解产物为苯并()-7,12熙: BaA 苯并(葱7,12醒 影响物质进行光化学反应的因素有物质的分子结构、吸收光波长及光照条件(光照强度和时间).物质 在水体表层容易发生光化反应,在高水面几米的深处,光化学反应可能很另横。此外,物质的光化反应还 受光敏剂的形响。在光化反应中有些反应物不能直接吸收光进行反应,但若有光敏剂存在,它可吸收该 长的光,并把光能传递给反应物而发生光化学反应。例如,叶绿素是植物光合作用的光敏剂,它能吸收阳 光中的可见光,并将光能传递给水和C02来合成糖和氧气。环境中存在着许多天然的光敏剂,对物质的光 化反应起着重要的作用。 4)有机物的生物化学降解 有机物在微生物的馆化作用下发生降解的反应称有机物的生化降解反应。水体中的生物,特别是微生 物能使许多物质进行生化反应,绝大多数有机物因此而降解成为更简单的化合物。如石油中烷烃,一般 过醇、醛、剧、脂肪酸等生化氧化阶段,最后降解为二氧化碳和水。其中甲烷降解的主要途径为: CH4→CH3OH→HCHO→HCOOH+CO2+HzO
即 DDT 分子吸收光能后,使分子直链上碳氯键断裂,产生活泼的自由基,自由基进一步同其他成分 作用得到产物 DDD 和 DDE。 陈朝晖等研究了六六六在水溶液中的光化学降解,发现六六六(BHC)在近紫外区难以直接吸收光能而 发生光化学降解。BHC 的光降解方式主要是通过与光解产生的活性中间体反应而发生的。在水溶液中 BHC 的光化学降解是通过与水中其他分子产生的水合电子(eaq-)反应而进行的,即: C6H6Cl6 + eaq- → C6H6Cl5· + Cl- + H2O 光解的主要产物是氯离子和还原脱氯后的化合物,因而其光化学降解过程主要是还原脱氯。 孔令仁研究了用不同光源照射模拟天然水中的苯并(a)蒽(BaA)和苯并(a)芘(BaP),表明其光解反应 均为一级反应。若用阳光照射时,BaA 和 BaP 的光分解速率常数分别为 0.142/h,0.135/h;如用紫外 线(6 mw/cm2)照射,则光解速率常数分别为 0.056/h,和 0.098/h。光强是影响光解的主要因素,水中 溶解氧能在阳光或紫外光的催化下氧化 BaA,如除去溶解氧,光照未能使 BaA 发生变化,介质酸度(pH 5~ 9)对光解没有影响。BaA 的光解产物为苯并(a)蒽-7,12 醌: 影响物质进行光化学反应的因素有物质的分子结构、吸收光波长及光照条件(光照强度和时间)。物质 在水体表层容易发生光化反应,在离水面几米的深处,光化学反应可能很缓慢。此外,物质的光化反应还 受光敏剂的影响。在光化反应中有些反应物不能直接吸收光进行反应,但若有光敏剂存在,它可吸收该波 长的光,并把光能传递给反应物而发生光化学反应。例如,叶绿素是植物光合作用的光敏剂,它能吸收阳 光中的可见光,并将光能传递给水和 CO2来合成糖和氧气。环境中存在着许多天然的光敏剂,对物质的光 化反应起着重要的作用。 4) 有机物的生物化学降解 有机物在微生物的催化作用下发生降解的反应称有机物的生化降解反应。水体中的生物,特别是微生 物能使许多物质进行生化反应,绝大多数有机物因此而降解成为更简单的化合物。如石油中烷烃,一般经 过醇、醛、酮、脂肪酸等生化氧化阶段,最后降解为二氧化碳和水。其中甲烷降解的主要途径为: CH4 → CH3OH → HCHO → HCOOH → CO2 + H2O

较高级烷烃降解的主要途径有三种,通过单端氧化,或双端氧化,或次未端氧化变成脂肪酸:脂肪酸 再经过其他有关生化反应,最后分解为二氧化碳和水。能引起烷烃降解的微生物有解油极毛杆菌 (pseudomonas oleovorans)、脉状菌状杆荫(mycobacterium phlei)、奇异南状杆菌(m ycobacterium hodochrous).解皂菌状杆菌(mycobacterium smegmatis).不透明诺卡氏蓝(nocardia opaca) 红色诺卡氏菌(ncadia rubra)等. 有机物生化降解的基本反应可分为两大类,即水解反应和氧化反应。对于有机农药等,在降解过程中 除了上述两种基本反应外,还可以发生脱氯、脱烷基等反应。 。生化水解反应 生化水解反应是指有机物在水解酶的作用下与水发生的反应。例如,多糖在水解酶的作用下逐渐水解 成二糖、单糖、丙酮酸。在有氧条件下,丙酮酸能被乙酰辅酶A进一步氧化为CO2和HO:在无氧条件 下,丙酮酸往往不能氧化到底,只氧化成各种酸、醇、丽等,这一过程称为发醇 水解扇 水解南 (CH,0 →CaH0n >CH0 多 二 单接 水解酶或辅酶 →0 C0,+H,0 丙酸 ROH、RCOR、RCOOH 烯烃的水解反应可表示如下: 烯水醉 RCH--CHR+HO ,RCH,CHR OH 蛋白质在水中的降解分两步进行:第一步蛋白质先在肽键上断裂、脱俊、脱氨并逐步氧化,有机氮转 化为无机氮:第二步是氮的亚硝化、硝化等使无机氨逐渐转化。可示意如下 蛋的质水的气多微今板数组线,阳,+商款版 今0g+C0,+H0 其中氨基酸的水解影氨反应如下: 肽水解 CHsCHCOOH+H2O NH2 OH
较高级烷烃降解的主要途径有三种,通过单端氧化,或双端氧化,或次末端氧化变成脂肪酸;脂肪酸 再经过其他有关生化反应,最后分解为二氧化碳和水。能引起烷烃降解的微生物有解油极毛杆菌 (pseudomonas oleovorans)、脉状菌状杆菌(mycobacterium phlei)、奇异菌状杆菌(mycobacterium rhodochrous)。 解皂菌状杆菌(mycobacterium smegmatis)、不透明诺卡氏菌(nocardia opaca)、 红色诺卡氏菌(ncadia rubra)等。 有机物生化降解的基本反应可分为两大类,即水解反应和氧化反应。对于有机农药等,在降解过程中 除了上述两种基本反应外,还可以发生脱氯、脱烷基等反应。 ● 生化水解反应 生化水解反应是指有机物在水解酶的作用下与水发生的反应。例如,多糖在水解酶的作用下逐渐水解 成二糖、单糖、丙酮酸。在有氧条件下,丙酮酸能被乙酰辅酶 A 进一步氧化为 CO2和 H2O;在无氧条件 下,丙酮酸往往不能氧化到底,只氧化成各种酸、醇、酮等,这一过程称为发酵。 烯烃的水解反应可表示如下: 蛋白质在水中的降解分两步进行;第一步蛋白质先在肽键上断裂、脱羧、脱氨并逐步氧化,有机氮转 化为无机氮;第二步是氮的亚硝化、硝化等使无机氮逐渐转化。可示意如下: 其中氨基酸的水解脱氨反应如下: