
第23卷第3期 大学化学 2008年6月 非苯系环状化合物芳香性的简单判定方法 施小宁 伏水师范学院生命科学与化学学院甘肃天水741001 摘要:在经典HOckel规则的基础上,阐述推广的Huckel规则及修正的HOckel规则和共妮回 路规则,为判断各种环系化合物的芳香性提供一种简单有效的方法 学习有机化学时经常会遇到芳香性概念。在现行的大部分大学教材中,关于芳香性的判 定方法一般只是简单地介绍了H©kel规则,而并未深入讨论。随着量子理论、合成方法和合 成新芳环的迅速发展,芳香性概念的应用范围日益扩大,已由苯系芳烃扩充到非苯系芳烃:由 中性分子扩充到芳香性离子;由碳环化合物扩充到含有各种杂原子的杂环化合物和金属整合 物,甚至扩充到不含碳原子的无机芳香环。为了适应现代教学的需要,使学生更好地理解 和掌握芳香性这一概念,我们在教学中,在重点讨论经典的H0ckel规则的基础上,相应地介绍 推广的HuckeI规则及修正的Hucke规则及共轭回路规则,为判别苯系化合物、非苯系单环 多环共轭化合物的芳香性提供一种简单有效的方法。 1H0cke4n+2)规则 1931年,E Huckel运用分子轨道法研究了单环共轭多烯的π电子能级,提出了判别化 合物芳香性的(4n+2)(n=0,1,2,3,)π电子规则,即H0ckel规则。其内容是:在p2杂化 碳原子组成的平面单环共轭体系中,含(4m+2)π电子的体系将具有与惰性气体相类似的闭 壳层结构,因而显示芳香性。此规则为判断单环共轭多烯化合物是否具有芳香性提供了一种 简单有效的定性判据。利用4+2规则判断单环共平面化合物芳香性的关键是正确求算环状 化合物的π电子数。 11碳原子组成的平面单环化合物π电子的计算 平面碳环化合物中,碳原子一般为单杂化,每个碳原子的3个p杂化轨道参与形成分 子平面的ō键,p轨道中占据1个电子,而形成环π键的正是由多个垂直环平面的p轨道侧面 重叠形成,即形成π键的电子数等于p轨道数,等于p杂化的碳原子数。如环丁二烯 (CH)有4个p杂化碳原子,所以电子数为4,苯(CH)有6个p杂化碳原子,电子 数为6。 若环状化合物带电荷时,则电子数等于环中甲杂化碳原子数减去环所带正电荷数或 加上环所带负电荷数。如环丙烯基正离子,”电子数=3(3个甲杂化碳原子)-1(带1个正 电荷)=2:环戊二烯负离子π电子数=5+1=6 68 1994-2009 China Academic Journal Electromc Publishing House.All righis reserved.hup:/www.cnki.net
第 23卷 第 3期 大 学 化 学 2008年 6月 非苯系环状化合物芳香性的简单判定方法 施小宁 (天水师范学院生命科学与化学学院 甘肃天水 741001) 摘要 在经典 Hückel规则的基础上 ,阐述推广的 Hückel规则及修正的 Hückel规则和共轭回 路规则 ,为判断各种环系化合物的芳香性提供一种简单有效的方法。 学习有机化学时经常会遇到芳香性概念。在现行的大部分大学教材中 ,关于芳香性的判 定方法一般只是简单地介绍了 Hückel规则 ,而并未深入讨论。随着量子理论、合成方法和合 成新芳环的迅速发展 ,芳香性概念的应用范围日益扩大 ,已由苯系芳烃扩充到非苯系芳烃 ;由 中性分子扩充到芳香性离子 ;由碳环化合物扩充到含有各种杂原子的杂环化合物和金属螯合 物 ,甚至扩充到不含碳原子的无机芳香环 [ 1 ]。为了适应现代教学的需要 ,使学生更好地理解 和掌握芳香性这一概念 ,我们在教学中 ,在重点讨论经典的 Hückel规则的基础上 ,相应地介绍 推广的 Hückel规则及修正的 Hückel规则及共轭回路规则 ,为判别苯系化合物、非苯系单环、 多环共轭化合物的芳香性提供一种简单有效的方法。 1 Hückel( 4n + 2)规则 1931年 , E. Hückel [ 2 ]运用分子轨道法研究了单环共轭多烯的 π电子能级 ,提出了判别化 合物芳香性的 (4n + 2) ( n = 0, 1, 2, 3, …)π电子规则 ,即 Hückel规则。其内容是 :在 sp 2 杂化 碳原子组成的平面单环共轭体系中 ,含 (4n + 2)π电子的体系将具有与惰性气体相类似的闭 壳层结构 ,因而显示芳香性。此规则为判断单环共轭多烯化合物是否具有芳香性提供了一种 简单有效的定性判据。利用 4n + 2规则判断单环共平面化合物芳香性的关键是正确求算环状 化合物的 π电子数。 1. 1 碳原子组成的平面单环化合物 π电子的计算 平面碳环化合物中 ,碳原子一般为 sp 2 杂化 ,每个碳原子的 3个 sp 2 杂化轨道参与形成分 子平面的σ键 , p轨道中占据 1个电子 ,而形成环π键的正是由多个垂直环平面的 p轨道侧面 重叠形成 ,即形成 π键的电子数等于 p 轨道数 ,等于 sp 2 杂化的碳原子数。如环丁二烯 (C4 H4 )有 4个 sp 2 杂化碳原子 ,所以 π电子数为 4;苯 (C6 H6 )有 6个 sp 2 杂化碳原子 ,π电子 数为 6。 若环状化合物带电荷时 ,则 π电子数等于环中 sp 2 杂化碳原子数减去环所带正电荷数或 加上环所带负电荷数。如环丙烯基正离子 ,π电子数 = 3 (3个 sp 2 杂化碳原子 ) - 1 (带 1个正 电荷 ) = 2;环戊二烯负离子 π电子数 = 5 + 1 = 6。 68 © 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net

12杂环化合物π电子的计算 常见的单杂环有呋喃、噻吩吡咯毗啶等。若要化合物中几个原子共平面,则每个原子均 须采用p杂化,其中每个杂化碳原子可提供1个p电子形成大Ⅱ键,呋喃、吡咯、吡啶中的 氧、氮原子p杂化轨道表示为: 2p , (a) 阳 b】 Nt c】 氧原子的2印轨道上有2个p电子,加上4个p杂化碳原子的4个π电子,一共6个π 电子,符合Hcke规则,有芳香性。噻盼与呋喃结构类似。吡咯分子中,氮原子的3个p杂 化轨道分别与2个碳原子和1个氢原子成单键,2印轨道有一对p电子,与4个碳原子的4个π 电子共计6个π电子,符合4n+2规则,有芳香性。而吡啶环中,氮原子只提供一个2印电子参 与形成大π键,环上的π电子数也是6,符合4n+2规则,有芳香性。吡啶的一个p杂化轨 道上有一孤电子对,未参与形成大π键,因而吡啶有弱碱性。 H©ke1的4m+2规则在一定范围内不但可以判断单环共轭多烯烃的芳香性,而且可以推 广到多环烃稠环烃和某些杂环化合物芳香性的判断,如萘、蒽,菲等。然而4n+2规则有其局 限性。首先,4n+2规则仅适用于m<5的平面单环共轭烯烃。研究表明,含有22个π电子 的单环烯烃芳香性极为微弱,含有26个以上π电子的单环烯烃则完全无芳香性。因为决定 芳香大π键能否形成,除了电子数目这个重要因素外,分子的立体构型,即环上碳原子是否 共平面也是重要的。Misw指出,超过18个r电子数的单环多烯烃,由于环内氢原子数的增 加致使环上碳原子不能全部处于同一平面,因而破坏了大π键的形成。第二,对于一些稠环 体系,4n+2规则有的适用,有的不适用。如偶苯(I)、芘(Ⅱ)、蔻()的π电子数分别为 12、16、24,不符合4n+2规则,但它们都有芳香性。而丁搭烯(V)、二环[620]癸五烯(V) 和辛搭烯(I)的π电子数分别为6、10、14,在不考虑分子的非平面时它们都符合Hucke1规 则,似乎应该有芳香性,但实际上(V)、(V)、(I)都不具有芳香性。由此,产生了对Huckel 规则的几种修正方法。 8 (I) (V) 2推广的Hcke规则 推广的Hcke规则是基于结构得出芳香性的判据:(1)多元环共轭体系以各组分环为 判别芳香性的基本单元,(4n+2)元环为芳环(p个),4n元环为反芳香环(g个)。对于奇元环 应尽可能按(4n+1)和(4n-1)成对划分出共轭双奇元环,这种共轭双奇元环是芳环单位。其 余不能按(4n+1)和(4n~1)成对划分的奇元环为非芳环(,个),两个非芳环作为一个反芳环 单位。(4m+1)元环的非芳环,其正离子为反芳环,负离子为芳环;(4n·1)元环的非芳环,其 正离子为芳环,负离子为反芳环。(2)整个分子的芳香性由芳环、反芳环及非芳环的相对数目 69 1994-2009 China Academic Journal Electronic Publishing House.All rights reserved http /Avww cnki net
1. 2 杂环化合物 π电子的计算 常见的单杂环有呋喃、噻吩、吡咯、吡啶等。若要化合物中几个原子共平面 ,则每个原子均 须采用 sp 2 杂化 ,其中每个杂化碳原子可提供 1个 p电子形成大 π键 ,呋喃、吡咯、吡啶中的 氧、氮原子 sp 2 杂化轨道表示为 : 氧原子的 2p轨道上有 2个 p电子 ,加上 4个 sp 2 杂化碳原子的 4个 π电子 ,一共 6个 π 电子 ,符合 Hückel规则 ,有芳香性。噻吩与呋喃结构类似。吡咯分子中 ,氮原子的 3个 sp 2 杂 化轨道分别与 2个碳原子和 1个氢原子成单键 , 2p轨道有一对 p电子 ,与 4个碳原子的 4个π 电子共计 6个π电子 ,符合 4n + 2规则 ,有芳香性。而吡啶环中 ,氮原子只提供一个 2p电子参 与形成大 π键 ,环上的 π电子数也是 6,符合 4n + 2规则 ,有芳香性。吡啶的一个 sp 2 杂化轨 道上有一孤电子对 ,未参与形成大 π键 ,因而吡啶有弱碱性。 Hückel的 4n + 2规则在一定范围内不但可以判断单环共轭多烯烃的芳香性 ,而且可以推 广到多环烃、稠环烃和某些杂环化合物芳香性的判断 ,如萘、蒽、菲等。然而 4n + 2规则有其局 限性 [ 3 ]。首先 , 4n + 2规则仅适用于 n < 5的平面单环共轭烯烃。研究表明 ,含有 22个 π电子 的单环烯烃芳香性极为微弱 ,含有 26个以上 π电子的单环烯烃则完全无芳香性。因为决定 芳香大 π键能否形成 ,除了 π电子数目这个重要因素外 ,分子的立体构型 ,即环上碳原子是否 共平面也是重要的。M islow指出 ,超过 18个 π电子数的单环多烯烃 ,由于环内氢原子数的增 加 ,致使环上碳原子不能全部处于同一平面 ,因而破坏了大 π键的形成。第二 ,对于一些稠环 体系 , 4n + 2规则有的适用 ,有的不适用。如偶苯 ( Ⅰ)、芘 ( Ⅱ)、蔻 ( Ⅲ)的 π电子数分别为 12、16、24,不符合 4n + 2规则 ,但它们都有芳香性。而丁搭烯 ( Ⅳ)、二环 [ 6. 2. 0 ]癸五烯 (Ⅴ) 和辛搭烯 (Ⅵ)的 π电子数分别为 6、10、14,在不考虑分子的非平面时它们都符合 Hückel规 则 ,似乎应该有芳香性 ,但实际上 (Ⅳ)、( Ⅴ)、( Ⅵ)都不具有芳香性。由此 ,产生了对 Hückel 规则的几种修正方法。 2 推广的 Hückel规则 推广的 Hückel规则 [ 4 ]是基于结构得出芳香性的判据 : (1)多元环共轭体系以各组分环为 判别芳香性的基本单元 , (4n + 2)元环为芳环 ( p个 ) , 4n元环为反芳香环 ( q个 )。对于奇元环 应尽可能按 (4n + 1)和 (4n - 1)成对划分出共轭双奇元环 ,这种共轭双奇元环是芳环单位。其 余不能按 (4n + 1)和 (4n - 1)成对划分的奇元环为非芳环 ( r个 ) ,两个非芳环作为一个反芳环 单位。 (4n + 1)元环的非芳环 ,其正离子为反芳环 ,负离子为芳环 ; (4n - 1)元环的非芳环 ,其 正离子为芳环 ,负离子为反芳环。 (2)整个分子的芳香性由芳环、反芳环及非芳环的相对数目 69 © 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net

来决定。即: 若p>q且p-q>r为芳香性。 若g>p且q-p>为反芳香性。 若1(p·q)|≤时,由分子的总π电子数按4n+2为芳香性,4n为反芳香性,奇环为非芳 香性来决定。例见表1。 表1芳香性判别例 物质结构 判别单元 电子数 芳香性判别 CO 8元环 8 反芳香性 6元环 苏香 分子 18 反芳香性 ◇江 6元环 芳香性 4元 反芳香 分子 芳香性 该法综合了微扰法、图论法和REPE指标的判别范围和优点,但却不用进行微扰计算,也 不必计算REPE指标,从而几乎可以完全克服REPE指标和MO法各自的缺点和不足。此方 法准确可靠,简单方便,易于掌握,适应性很强,对许多类型的多环共轭体系都能做出判别。尽 管如此,该法对于()、(Ⅷ)类多环化合物芳香性的判定仍是无能为力。 3Hcke规则的修正 1954年,Pht提出了周边修正法),认为可以忽略稠环中间的桥键而直接计算在外围可 以形成离域的π电子数,如果满足4m+2规则,那么就可以初步说明此化合物具有芳香性 用这种方法检验()可以发现,它不满足4n+2规则,无芳香性。又如(Ⅸ)(X)(XⅪⅫ)都满足 4n+2规则 (I) X) 如果用这个方法判断如(Ⅷ)的化合物,其方法会有一定的偏差,因为它们周边的电子 数不符合4m+2规则似乎无芳香性,但事实证明()有芳香性。因此,使用此规则时,一些 稠环烃也可将之看成轮烯,画经典结构式时,应使尽量多的双键处在轮烯上,处在轮烯内外的 双键写成其共振的正负电荷形式,将出现在轮烯内外的单键忽略后,再用Huckel-Platt规则判 (1)双键与轮烯直接相连,计算电子数时,将双键写成其共振的电荷结构,负电荷按2个 电子计,正电荷按0计,内部不计。如下列物质均有芳香性 70 1994-2009 China Academie Journal Electronic Publishing House.All rights reserved hp:/ww.cnkne
来决定。即 : 若 p > q且 p - q > r,为芳香性。 若 q > p且 q - p > r,为反芳香性。 若 | ( p - q) | ≤r时 ,由分子的总 π电子数按 4n + 2为芳香性 , 4n为反芳香性 ,奇环为非芳 香性来决定。例见表 1。 表 1 芳香性判别例 物质结构 判别单元 π电子数 芳香性判别 8元环 6元环 分子 8 6 18 反芳香性 芳香性 反芳香性 6元环 4元环 分子 6 4 12 芳香性 反芳香性 芳香性 该法综合了微扰法、图论法和 REPE指标的判别范围和优点 ,但却不用进行微扰计算 ,也 不必计算 REPE指标 ,从而几乎可以完全克服 REPE指标和 PMO法各自的缺点和不足。此方 法准确可靠 ,简单方便 ,易于掌握 ,适应性很强 ,对许多类型的多环共轭体系都能做出判别。尽 管如此 ,该法对于 (Ⅶ)、(Ⅷ)类多环化合物芳香性的判定仍是无能为力。 3 Hückel规则的修正 1954年 , Platt提出了周边修正法 [ 5 ] ,认为可以忽略稠环中间的桥键而直接计算在外围可 以形成离域的 π电子数 ,如果满足 4n + 2规则 ,那么就可以初步说明此化合物具有芳香性。 用这种方法检验 (Ⅶ)可以发现 ,它不满足 4n + 2规则 ,无芳香性。又如 (Ⅸ) (Ⅹ) (Ⅺ)都满足 4n + 2规则。 如果用这个方法判断如 (Ⅷ)的化合物 ,其方法会有一定的偏差 ,因为它们周边的 π电子 数不符合 4n + 2规则 ,似乎无芳香性 ,但事实证明 ( Ⅷ)有芳香性。因此 ,使用此规则时 ,一些 稠环烃也可将之看成轮烯 ,画经典结构式时 ,应使尽量多的双键处在轮烯上 ,处在轮烯内外的 双键写成其共振的正负电荷形式 ,将出现在轮烯内外的单键忽略后 ,再用 Hückel2Platt规则判 断。 (1)双键与轮烯直接相连 ,计算电子数时 ,将双键写成其共振的电荷结构 ,负电荷按 2个 电子计 ,正电荷按 0计 ,内部不计。如下列物质均有芳香性 : 70 © 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net
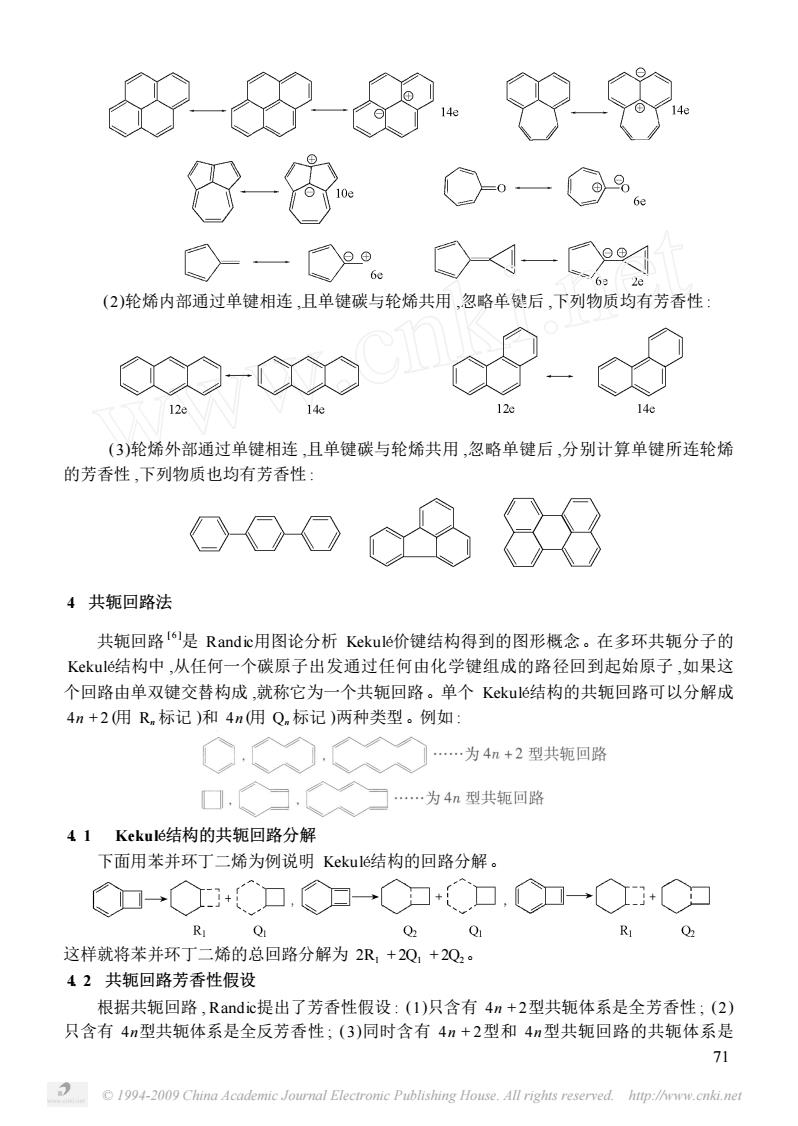
心-的-0.8 8-出 -一№ <4一 (2)轮烯内部通过单键相连,且单键碳与轮烯共用,忽略羊键后,下列物质均有芳香性 ◇-C (3)轮烯外部通过单键相连,且单键碳与轮烯共用,忽略单键后,分别计算单键所连轮烯 的芳香性,下列物质也均有芳香性 CXOD c988 4共轭回路法 共轭回路o是Randic用图论分析Kekulef价键结构得到的图形概念。在多环共轭分子的 Kkulé结构中,从任何一个碳原子出发通过任何由化学键组成的路径回到起始原子,如果这 个回路由单双键交替构成,就称它为一个共轭回路。单个Kekule结构的共轭回路可以分解成 4n+2佣R标记)和4m佣Q.标记)两种类型。例如: …为4n+2型共轭回路 …为4n型共轭回路 41 Kekuké结构的共轭回路分解 下面用苯并环丁二烯为例说明Kekulé结构的回路分解。 ◇加-Q+●口,◇归一◆力口,C加→Q◇▣ R 001 R 这样就将苯并环丁二烯的总回路分解为2R+2Q,+20。 42共轭回路芳香性假设 根据共轭回路,Randic提出了芳香性假设:(1)只含有4n+2型共轭体系是全芳香性;(2) 只含有4n型共轭体系是全反芳香性:(3)同时含有4n+2型和4n型共轭回路的共轭体系是 71 1994-2009 China Academic Journal Electrome Publishing House.All rights reserved.hup:/w.cnkin
(2)轮烯内部通过单键相连 ,且单键碳与轮烯共用 ,忽略单键后 ,下列物质均有芳香性 : (3)轮烯外部通过单键相连 ,且单键碳与轮烯共用 ,忽略单键后 ,分别计算单键所连轮烯 的芳香性 ,下列物质也均有芳香性 : 4 共轭回路法 共轭回路 [ 6 ]是 Randic用图论分析 Kekulé价键结构得到的图形概念。在多环共轭分子的 Kekulé结构中 ,从任何一个碳原子出发通过任何由化学键组成的路径回到起始原子 ,如果这 个回路由单双键交替构成 ,就称它为一个共轭回路。单个 Kekulé结构的共轭回路可以分解成 4n + 2 (用 Rn 标记 )和 4n (用 Qn 标记 )两种类型。例如 : 4. 1 Kekulé结构的共轭回路分解 下面用苯并环丁二烯为例说明 Kekulé结构的回路分解。 这样就将苯并环丁二烯的总回路分解为 2R1 + 2Q1 + 2Q2。 4. 2 共轭回路芳香性假设 根据共轭回路 , Randic提出了芳香性假设 : (1)只含有 4n + 2型共轭体系是全芳香性 ; (2) 只含有 4n型共轭体系是全反芳香性 ; (3)同时含有 4n + 2型和 4n型共轭回路的共轭体系是 71 © 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net

中间类分子,所表现的芳香性是两种类型共轭回路相反贡献抵消的最后结果。如果4n+2型 共轭回路贡献大于4型共轭回路则为部分芳香性:反之,则为部分反芳香性。故上例苯并环 丁二烯为部分反芳香性。利用上述分类思想可以很好解决多环共轭分子芳香性问题。例如 (XⅫ)和(X☐)是等电子异构体,似乎属于一类,但它们的共轭回路分解分别为:(Ⅻ)(6R2+2R +2Q2+2Q):(Ⅻ)(4R1+4R2+4R),所以(XⅫ)属于中间芳香类,而(Ⅻ)属于全芳香类。 (M) (《) (X 共轭回路描述的广义Hke1规则对单环和多环分子都适用,与用π电子数做标准的推广的 HOckel规则有本质的区别,对有些分子的预言甚至是相反的,例如,(W)按(4n+2)r电子规则 时是芳香性的,但其共轭回路分解为(2R+2R+4Q2+4Q),是部分反芳香性的。实验已证明 该分子是非平面的,与共轭回路方法预言一致。这表明共轭回路是讨论芳香性的根本结构要素, 而π电子数只包含了部分结构特征,不能作为判别多环共轭分子芳香性的根本要素。 5小结 以上介绍的4种芳香性判据从不同角度、不同程度上判别了非苯系环状化合物的芳香性 它们往往又互相补充联立使用。H©kel的4n+2规则是普遍采用的一种简单有效的方法 对于常见的一些简单单环共轭烃是首选方法:推广的HOcke1规则及其修正规则是4m+2规则 的有效补充,它们几乎可以判断所有常见多环烯烃及稠环烯烃的芳香性;而以4n+2型共轭回 路标准作为广义的Huckel规则对芳香性认识的深刻性和简单性不仅对单环和多环共轭分子 普通适用,而且为系统研究多环共轭体系尤其是超过现代量子化学计算水平的宏大体系芳香 性提供了新手段。参量化的共轭回路方法对许多体系(苯型烃、非苯型烃、杂环体系、共轭多 聚体、碳笼等)的共振能的对比和芳香性的预言都是相当成功的,可作为以上3种判定方法 的补充。这样,各种判据层层递进,形成一个完整的判断体系。当然,有关芳香性的判据很多 如能量判据、磁学判据、反应判据等,己有文献从不同角度对这些判据作了介绍)但是对于 初学芳香性问题的大学本科生或研究生来说,本文提供的方法不仅简单,而且易掌握,使用方 便。 参考文献 1封继康.分子科学学报,2005,21(4):1 2曾昭琼.有机化学.第3版.北京:高等教育出版社,1993 3魏荣宝.陈苏战,刘秀明.等.化学教有,2006.93 4李西安,李继忠.延安大学学报,1995,14(2):7刀 5袁履冰,郁明.大学化学,2004.19(4):50 6班福强,戴柏青.化学通报,1998,1:51 7班福强,戴柏青.化学通报,1996,2:20 8李兆楼.济宁师范专科学校学报,2005,26(6):10 9曾凡芝.柳州师专学报.2003.18(4:92 72 1994-2009 China Academie Journal Electronic Publishing House.All righis reserved hup://www.cnkine
中间类分子 ,所表现的芳香性是两种类型共轭回路相反贡献抵消的最后结果。如果 4n + 2型 共轭回路贡献大于 4n型共轭回路则为部分芳香性 ;反之 ,则为部分反芳香性。故上例苯并环 丁二烯为部分反芳香性。利用上述分类思想可以很好解决多环共轭分子芳香性问题。例如 , (Ⅻ)和 (ⅩⅢ )是等电子异构体 ,似乎属于一类 ,但它们的共轭回路分解分别为 : (Ⅻ) (6R2 + 2R3 + 2Q2 + 2Q3 ) ; (ⅩⅢ ) (4R1 + 4R2 + 4R3 ) ,所以 (Ⅻ)属于中间芳香类 ,而 (ⅩⅢ )属于全芳香类。 共轭回路描述的广义 Hückel规则对单环和多环分子都适用 ,与用π电子数做标准的推广的 Hückel规则有本质的区别 ,对有些分子的预言甚至是相反的 ,例如 , (ⅩⅣ )按 (4n + 2)π电子规则 时是芳香性的 ,但其共轭回路分解为 (2R1 + 2R2 + 4Q2 + 4Q1 ) ,是部分反芳香性的。实验已证明 该分子是非平面的 ,与共轭回路方法预言一致。这表明共轭回路是讨论芳香性的根本结构要素 , 而π电子数只包含了部分结构特征 ,不能作为判别多环共轭分子芳香性的根本要素。 5 小结 以上介绍的 4种芳香性判据从不同角度、不同程度上判别了非苯系环状化合物的芳香性 , 它们往往又互相补充、联立使用。Hückel的 4n + 2规则是普遍采用的一种简单有效的方法 , 对于常见的一些简单单环共轭烃是首选方法 ;推广的 Hückel规则及其修正规则是 4n + 2规则 的有效补充 ,它们几乎可以判断所有常见多环烯烃及稠环烯烃的芳香性 ;而以 4n + 2型共轭回 路标准作为广义的 Hückel规则对芳香性认识的深刻性和简单性不仅对单环和多环共轭分子 普通适用 ,而且为系统研究多环共轭体系尤其是超过现代量子化学计算水平的宏大体系芳香 性提供了新手段。参量化的共轭回路方法对许多体系 (苯型烃、非苯型烃、杂环体系、共轭多 聚体、碳笼等 )的共振能的对比和芳香性的预言都是相当成功的 [ 7 ] ,可作为以上 3种判定方法 的补充。这样 ,各种判据层层递进 ,形成一个完整的判断体系。当然 ,有关芳香性的判据很多 , 如能量判据、磁学判据、反应判据等 ,已有文献从不同角度对这些判据作了介绍 [ 8, 9 ] ,但是对于 初学芳香性问题的大学本科生或研究生来说 ,本文提供的方法不仅简单 ,而且易掌握 ,使用方 便。 参 考 文 献 1 封继康. 分子科学学报 , 2005, 21 (4) : 1 2 曾昭琼. 有机化学. 第 3版. 北京 : 高等教育出版社 , 1993 3 魏荣宝 , 陈苏战 , 刘秀明 , 等. 化学教育 , 2006, 9: 3 4 李西安 , 李继忠. 延安大学学报 , 1995, 14 (2) : 71 5 袁履冰 , 郝明. 大学化学 , 2004, 19 (4) : 50 6 班福强 , 戴柏青. 化学通报 , 1998, 1: 51 7 班福强 , 戴柏青. 化学通报 , 1996, 2: 20 8 李兆楼. 济宁师范专科学校学报 , 2005, 26 (6) : 10 9 曾凡芝. 柳州师专学报 , 2003, 18 (4) : 92 72 © 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net