
第九章 可逆电池的电动势 及其应用 冷个 §9.1可逆电池和可逆电极 §9.2电动势的测定 §9.3可逆电池的书写方法及电动势的取号 §9.4可逆电池的热力学 §9.5电动势产生的机理 §9.6电极电势和电池的电动势 §9.7电动势测定的应用 §9.8内电位、外电位和电化学势
第九章 可逆电池的电动势 及其应用 §9.1 可逆电池和可逆电极 §9.2 电动势的测定 §9.3 可逆电池的书写方法及电动势的取号 §9.4 可逆电池的热力学 §9.5 电动势产生的机理 §9.6 电极电势和电池的电动势 §9.7 电动势测定的应用 §9.8 内电位、外电位和电化学势

引 言 锌置换铜的反应 Zn(s)+Cu2=Zn2++Cu(s) 烧杯中进行 电池中进行 丰 化学平衡 电化学平衡
烧杯中进行 化学平衡 电池中进行 电化学平衡 ≠ 引 言 2+ 2 Zn(s)+Cu Zn +Cu(s) 揪 + ? 锌置换铜的反应

§9.1可逆电池和可逆电极 一、 组成可逆电池的必要条件 原电池 电解池 0.810V ZnSo4 CuSo4 ZnSO4 CuSO (1)化学反应可逆 (2)能量变化可逆 (3)无其他可逆过程存在(如扩散)
(1)化学反应可逆 原电池 电解池 一、组成可逆电池的必要条件 (2)能量变化可逆 §9.1 可逆电池和可逆电极 (3)无其他可逆过程存在(如扩散)

例 Zn(s)ZnSOHCIAgCI(s)|Ag(s) 作原电池 (-)Zn(s)→Zn2++2e (+)2AgC1(s)+2e→2Ag(s)+2C1 净反应 Zn(s)+2AgCl(s)-2Ag(s)+2CI-+Zn2 作电解池 阴极: Zn2++2e→Zn(s) 阳极 2Ag(s)+2C1-2AgCI(s)+2e 净反应: 2Ag(s)+ZnCl,-Zn(s)+2AgCl(s)
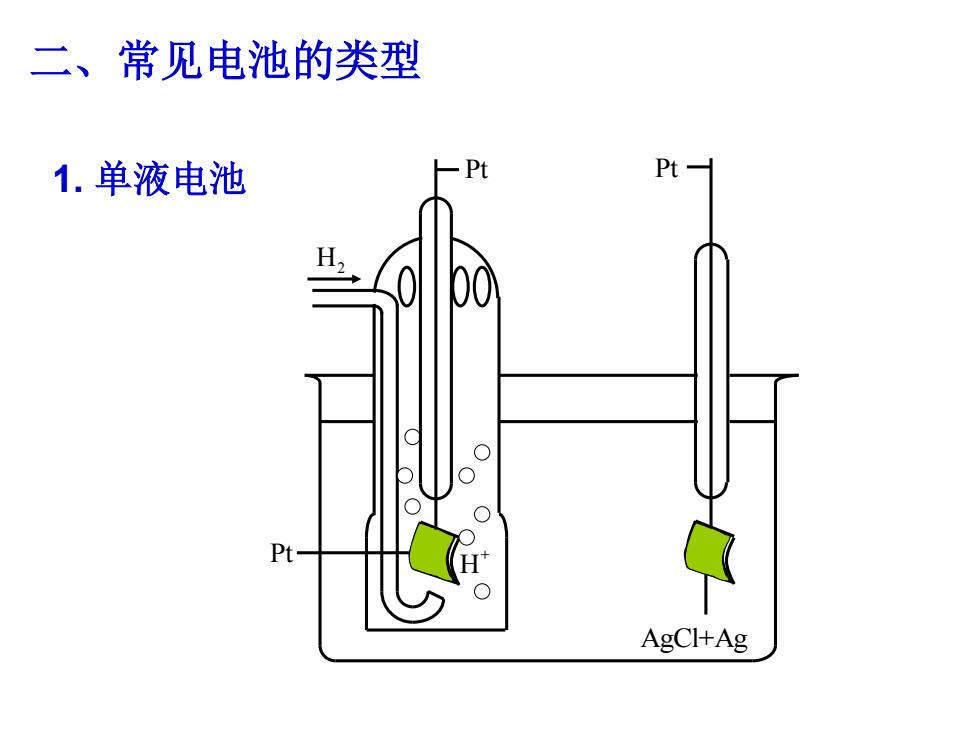
二、常见电池的类型 1.单液电池 Pt- H, Pt- AgCl+Ag
二、常见电池的类型 1. 单液电池 H2 Pt+ H Pt Pt AgCl+Ag
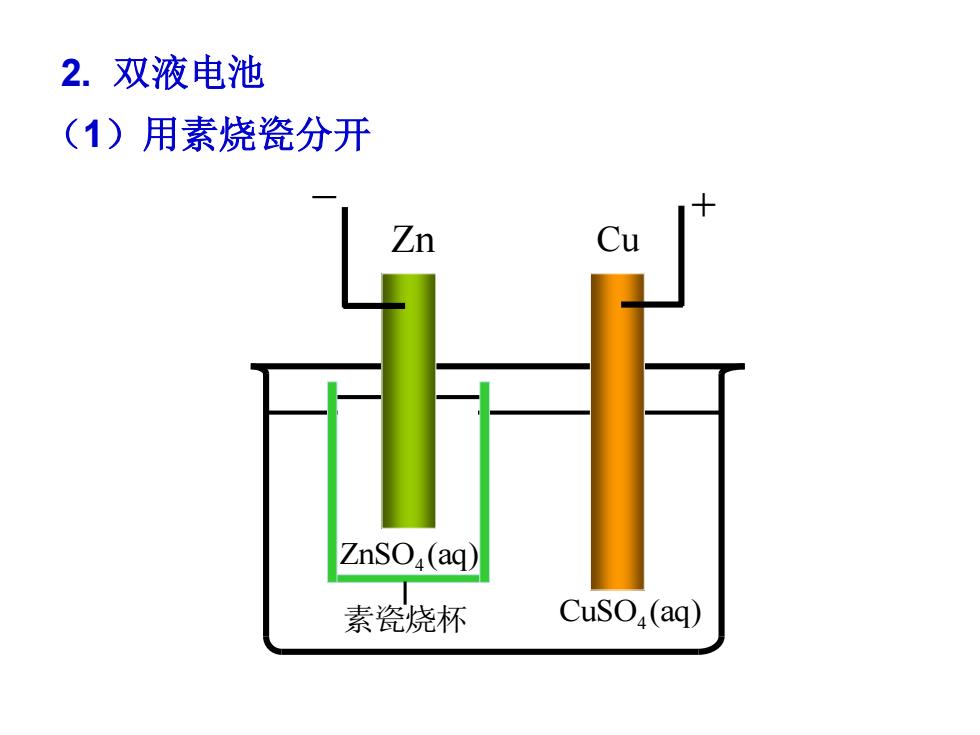
2.双液电池 (1)用素烧瓷分开 Zn ZnSO(aq) 素瓷烧杯 CuSO(aq)
2. 双液电池 (1)用素烧瓷分开 Zn Cu + CuSO (aq) 4 ZnSO (aq) 4 素瓷烧杯

2.双液电池 (2)用盐桥分开 Zn 盐桥 ZnSO,(aq) CusO(aq)
2. 双液电池 (2)用盐桥分开 ZnSO (aq) 4 CuSO (aq) 4 Zn Cu + 盐桥

三、可逆电极及其分类 1.第一类电极 (1)金属与其阳离子组成的电极 条件:要求金属与含该金属离子的溶液在未构成 电池回路时不发生化学反应,即单独地将金属浸 入离子溶液不发生化学反应。 (2)气体电极:氢电极、氧电极、氯气电极
(1)金属与其阳离子组成的电极 1.第一类电极 三、可逆电极及其分类 •条件:要求金属与含该金属离子的溶液在未构成 电池回路时不发生化学反应,即单独地将金属浸 入离子溶液不发生化学反应。 (2) 气体电极:氢电极、氧电极、氯气电极

气体电极条件: ·由于气体无定型且非导体,需借助于金属 材料(通常用Pt)或其他导电材料(如C 棒),使气流冲击金属片; 而金属片则浸入含该气体所对应的离子溶 液中。如图:
• 由于气体无定型且非导体,需借助于金属 材料(通常用Pt)或其他导电材料(如 C 棒),使气流冲击金属片; • 而金属片则浸入含该气体所对应的离子溶 液中。如图: 气体电极条件:

对金属材料的要求: P C12 1)电化学上惰性(本身不 C12 参与反应); 2)对气体/离子反应有化学 催化活性。 ■所以通常以Pt作金属惰性电极材料,并将小颗 粒的Pt涂于Pt表面上构成“Pt黑”电极,增加 电极的表面积即活性
对金属材料的要求: 1)电化学上惰性(本身不 参与反应); 2)对气体/离子反应有化学 催化活性。 所以通常以 Pt 作金属惰性电极材料,并将小颗 粒的 Pt涂于 Pt 表面上构成 “Pt黑” 电极,增加 电极的表面积即活性