
西北大学化工原理 第二节 双组分溶液的汽液相平衡 理想物系的汽液相平衡 蒸馏过程都涉及两相共存的平衡物系 蒸馏过程是物系在汽一液相间由一相转入另一 相的质量传递过程,任何传质过程都是由不平 衡趋向于平衡的过程
西北大学化工原理 第二节 双组分溶液的汽液相平衡 一 理想物系的汽液相平衡 蒸馏过程都涉及两相共存的平衡物系。 蒸馏过程是物系在汽—液相间由一相转入另一 相的质量传递过程,任何传质过程都是由不平 衡趋向于平衡的过程

西北大学化工原理 1.相律(自由度) 对双组分蒸馏: C=2,少=2,所以F=2. 平衡物系涉及到参数t,P,y,x·(利用归一条件) 对双组分物系,一相中某一组分的摩尔分率确定后,另一组分 的摩尔分率也随之而定。则P,t和组成三个参数中若规定两 个,其余的则不能任意给定。 蒸馏操作在操作之前先要确定操作压力P,(一般为常 压)此时F=1,若t一定,组成便随着之确定。即P一定 时,*t一x;米x一y(一一对应的关系)
西北大学化工原理 蒸馏操作在操作之前先要确定操作压力P,(一般为常 压)此时F=1,若 t 一定,组成便随着之确定。即P一定 时,t x;x y(一一对应的关系). c = φ = 所以 = 2.F,2,2 1. 相律(自由度) 对双组分蒸馏: 平衡物系涉及到参数 t , P , y , x . (利用归一条件) 对双组分物系,一相中某一组分的摩尔分率确定后,另一组分 的摩尔分率也随之而定。则P , t 和组成三个参数中若规定两 个,其余的则不能任意给定

西北大学化工原理 2.拉乌尔定律 描述的是:理想溶液某一组分在汽相中 的分压和该组分在液相中的浓度的关系。 yAYB 平衡时:P4=P心x4P=P8xB XAXB P,P8--在溶液温度(①)下纯组分A,B的饱和蒸汽压 P=f(A)(t) P=f(B)(t)
西北大学化工原理 平衡时: BBBAAA xPPxPP 0 0 = ; = ))(( ))(( , (t) BA, 0 0 00 tBfP tAfP PP B A BA = = −− 在溶液温度 下纯组分 的饱和蒸汽压 A y By A x B x 描述的是:理想溶液某一组分在汽相中 的分压和该组分在液相中的浓度的关系。 2. 拉乌尔定律

西北大学化工原理 3.道尔顿分压定律: 混合液沸腾的条件是:各组分的蒸汽压之和 等于总外压,即 P=P+PB Px4+P8(I-xA)=P→xA= P-P8 p-P (泡点方程)》 PA=P9x4=PyB→yA= P P-P 露点方程)》 把P=fA()及Pg=f.(①)代入以上两式得 XA三 P-fe(t) )P-f(C) f(t)-fg(t) Pf()-f()
西北大学化工原理 )(. )1( ( ) 00 0 0 0 0 00 0 0 0 露点方程 泡点方程 BA A B A A AAA B A BA B BAA A A BA PP PP P P x P P yPyxPP PP PP xPxPxP PPP − − ==⇒== − − =⇒=−+ = + (t)fP(t)fP : B 0 A B 0 把 A = 及 = 代入以上两式得 )()( )( tftf tfP X A B B A − − = )()( )( . )( tftf tfP P tf y A B A B A − − = 混合液沸腾的条件是:各组分的蒸汽压之和 等于总外压,即 3. 道尔顿分压定律:

西北大学化工原理 即:可根据泡点或露点(t)一 计丝→X4,y4,但一般需 试差。因为∫()和fs(t)为非线性的。 纯组分的饱和蒸汽压与温度的关系可用安托因公式表示 B log P=A- t+C A,B,C为某组分的安托因常数,可查得
西北大学化工原理 为非线性的。 AA ⎯ ⎯ → ⎯ , yx 计算 纯组分的饱和蒸汽压与温度的关系可用安托因公式表示 0 P Ct B AP + −= 0 log A,B,C为某组分的安托因常数,可查得。 即: 可根据泡点或露点(t) ,但一般需 试差。因为 tftf )()( A 和 B Ct B AP + −= 0 log

西北大学化工原理 4.相平衡图(t-y)和(x--y 在总压P一定的条件下,汽液相组成与温度的关系 (9--6)或(9-11)可以表示成下图: t 过热蒸汽区 露点线 汽液共存区 泡点线 纯A的沸点 液相区 XA XA VA
西北大学化工原理 纯A的沸点 xA yA t 液相区 露点线 ' A y ' A x 泡点线 汽液共存区 过热蒸汽区 4. 相平衡图(t--y)和(x--y) 在总压P 一定的条件下,汽液相组成与温度的关系 (9--6)或(9--11)可以表示成下图: 组分B的沸点
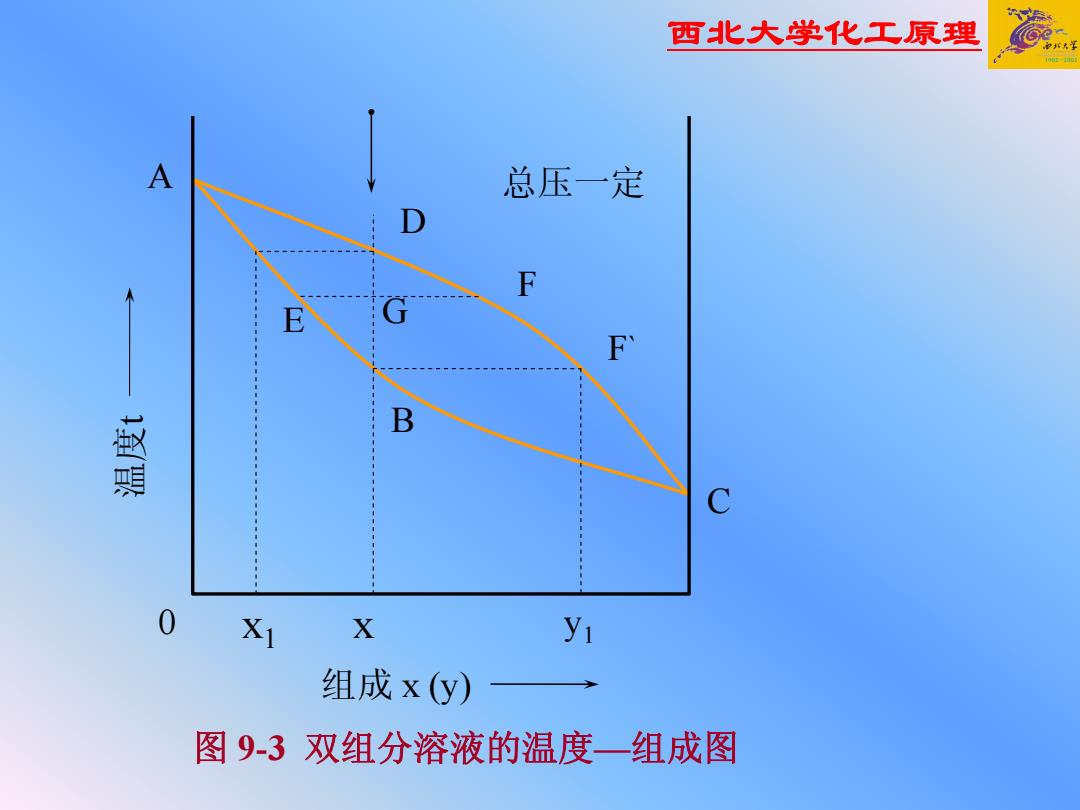
西北大学化工原理 A 总压一定 D F F B 0 XI X y 组成x(y) 图9-3双组分溶液的温度一组成图
西北大学化工原理 A B D E F G F` x 1 x y1 总压一定 C 0 温度t 组成 x (y) 图 9-3 双组分溶液的温度 —组成图

西北大学化工原理 10 y 总压一定 X X 1.0 图9-4 相平衡曲线 在恒定总压,不同温度下互成平衡的两组分y=f(x)的关 系如上图。因对理想物系y>x,则平衡曲线必在对角线上。 注意:在yx曲线上各点所对应的温度是不同的
西北大学化工原理 总压一定 0 1.0 1.0 x y 图 9-4 相平衡曲线 在恒定总压 ,不同温度下互成平衡的两组分y=f(x)的关 系如上图。因对理想物系y>x,则平衡曲线必在对角线上。 注意:在y~x曲线上各点所对应的温度是不同的。 x

西北大学化工原理 5.相对挥发度 对纯组分,它的饱和蒸汽压就反映了它的挥发性 的大小;对4=P混合溶液,某一组分的挥发性因为 其它组分的存在而发生改变。此时 PA.v PB 4 B 三 混合液中的两组分的挥法度之比叫相对挥发度( q P B B X B A X A (1- y) (1-
西北大学化工原理 5. 相对挥发度 对纯组分,它的饱和蒸汽压就反映了它的挥发性 的大小;对 混合溶液,某一组分的挥发性因为 其它组分的存在而发生改变。此时 混合液中的两组分的挥法度之比叫 相对挥发度 0 υ = PAA B B B A A A x P x P υ = , υ = α )1( )1( A A A A B B A A B B A A B A x y x y x y P x y P x P x P − − = = == υ υ α

西北大学化工原理 a x A >相平衡方程(表示汽液两相的组成关系) 1+(a-1)x 又由a= → UB P 当α=1时,溶液不能分离 故o≠1时,即0>1或<1时,可用精馏的方法来分离 对于理想溶液PA=PeXA P。=P8xB 0二
西北大学化工原理 A A x x y −+ )1(1 = α α 相平衡方程(表示汽液两相的组成关系) 0 0 0 A B B 0 A B xPP xPP ,11 ,1 ; ,1 ; B A B B A A B P P x P x P == = = ≠ <> = α α αα α 对于理想溶液 时或即时故 可用精馏的方法来分离 时当 溶液不能分离 B A B A B B A A B B A A B A x x y y x y x y x P x P α υ υ 又由 α === ⇒ =