
西北大学化工原理电子教案 8.气体吸收 8.1概述 令吸收在化学工业上的应用:吸收是分离均相的气体混合物的一种单元操作(或化工过 程)。气体吸收的目的: (1)分离混合气体以获得一定的组分。 (2)除去有害组分以净化或精制气体。 (3)制备某种气体的溶液。 (4)工业废气的治理。 令气体混合物分离的依据和方法 进行气体混合物的分离时,通常根据混合物中各组分间某种物理和化学性质的差异而开 发出不同的分离方法,典型的分离方法如下: ①冷冻分离一是利用物质的沸点差分离气体混合物的一种方法,比如空气分离过程, 分离O2和N2,就是利用沸点差来分离,又比如液化气,一般烧C3和C4,而C5、C6一 般在常温下不汽化。(西德的林得公司是世界上提供冷冻设备的著名公司) ②吸附分离一利用吸收剂对各组分吸附性能的差异,如二甲苯有邻、间、对位,三者 的沸点质相差0.4℃,难以用冷冻分离的方法,若选用适宜的吸附剂,对二甲苯的分 离就比较有效。 ③分子筛分离一利用分子直径的大小差异来分离的一种方法。 ④吸收分离一根据混合物中各组分在某种溶剂中溶解度的不同来分离气体混合物的一 种方法,本章介绍的方法是物理吸收。 混合物中能被溶解的部分进入液相形成溶液,不被溶解的部分则留在气相,从而使气体 混合物得到分离。 把吸收操作中所用的液体称溶剂或吸收剂(C)。 混合气体中能被溶解的组分称溶质(A)。 混合气体不能溶解的组分称为惰性组分或载体(B)。 工业吸收过程在炼焦及制取城市煤气的生产过程中,焦炉煤气内含有少量的苯,甲苯类低 碳氢化合物的蒸汽要进行分离
西北大学化工原理电子教案 8. 气体吸收 8.1 概述 吸收在化学工业上的应用:吸收是分离均相的气体混合物的一种单元操作(或化工过 程)。气体吸收的目的: (1)分离混合气体以获得一定的组分。 (2)除去有害组分以净化或精制气体。 (3)制备某种气体的溶液。 (4)工业废气的治理。 气体混合物分离的依据和方法 进行气体混合物的分离时,通常根据混合物中各组分间某种物理和化学性质的差异而开 发出不同的分离方法,典型的分离方法如下: ① 冷冻分离-是利用物质的沸点差分离气体混合物的一种方法,比如空气分离过程, 分离O2和N2,就是利用沸点差来分离,又比如液化气,一般烧C3和C4,而C5、C6一 般在常温下不汽化。(西德的林得公司是世界上提供冷冻设备的著名公司) ② 吸附分离—利用吸收剂对各组分吸附性能的差异,如二甲苯有邻、间、对位,三者 的沸点质相差 0.4o C,难以用冷冻分离的方法,若选用适宜的吸附剂,对二甲苯的分 离就比较有效。 ③ 分子筛分离—利用分子直径的大小差异来分离的一种方法。 ④ 吸收分离—根据混合物中各组分在某种溶剂中溶解度的不同来分离气体混合物的一 种方法,本章介绍的方法是物理吸收。 混合物中能被溶解的部分进入液相形成溶液,不被溶解的部分则留在气相,从而使气体 混合物得到分离。 把吸收操作中所用的液体称溶剂或吸收剂(C)。 混合气体中能被溶解的组分称溶质(A)。 混合气体不能溶解的组分称为惰性组分或载体(B)。 工业吸收过程 在炼焦及制取城市煤气的生产过程中,焦炉煤气内含有少量的苯,甲苯类低 碳氢化合物的蒸汽要进行分离。 1��
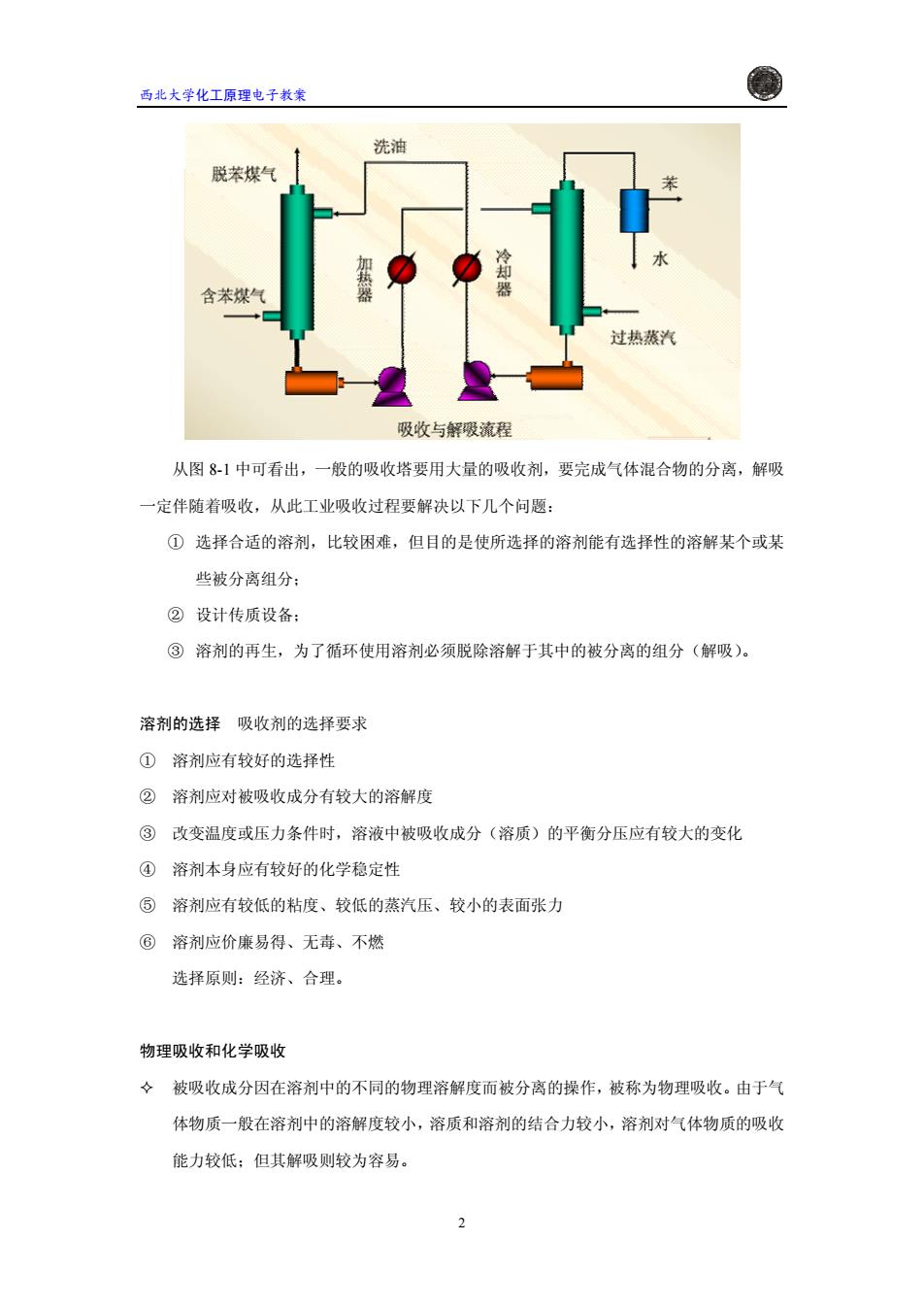
西北大学化工原理电子教案 洗油 脱苯煤气 含苯煤气 过热蒸汽 吸收与解暖流程 从图8-1中可看出,一般的吸收塔要用大量的吸收剂,要完成气体混合物的分离,解吸 一定伴随着吸收,从此工业吸收过程要解决以下几个问题: ①选择合适的溶剂,比较困难,但目的是使所选择的溶剂能有选择性的溶解某个或某 些被分离组分: ②设计传质设备: ③溶剂的再生,为了循环使用溶剂必须脱除溶解于其中的被分离的组分(解吸)。 溶剂的选择吸收剂的选择要求 ①溶剂应有较好的选择性 ②溶剂应对被吸收成分有较大的溶解度 ③改变温度或压力条件时,溶液中被吸收成分(溶质)的平衡分压应有较大的变化 ④溶剂本身应有较好的化学稳定性 ⑤溶剂应有较低的粘度、较低的蒸汽压、较小的表面张力 ⑥溶剂应价廉易得、无毒、不燃 选择原则:经济、合理。 物理吸收和化学吸收 ◇被吸收成分因在溶剂中的不同的物理溶解度而被分离的操作,被称为物理吸收。由于气 体物质一般在溶剂中的溶解度较小,溶质和溶剂的结合力较小,溶剂对气体物质的吸收 能力较低;但其解吸则较为容易。 2
西北大学化工原理电子教案 从图 8-1 中可看出,一般的吸收塔要用大量的吸收剂,要完成气体混合物的分离,解吸 一定伴随着吸收,从此工业吸收过程要解决以下几个问题: ① 选择合适的溶剂,比较困难,但目的是使所选择的溶剂能有选择性的溶解某个或某 些被分离组分; ② 设计传质设备; ③ 溶剂的再生,为了循环使用溶剂必须脱除溶解于其中的被分离的组分(解吸)。 溶剂的选择 吸收剂的选择要求 ① 溶剂应有较好的选择性 ② 溶剂应对被吸收成分有较大的溶解度 ③ 改变温度或压力条件时,溶液中被吸收成分(溶质)的平衡分压应有较大的变化 ④ 溶剂本身应有较好的化学稳定性 ⑤ 溶剂应有较低的粘度、较低的蒸汽压、较小的表面张力 ⑥ 溶剂应价廉易得、无毒、不燃 选择原则:经济、合理。 物理吸收和化学吸收 被吸收成分因在溶剂中的不同的物理溶解度而被分离的操作,被称为物理吸收。由于气 体物质一般在溶剂中的溶解度较小,溶质和溶剂的结合力较小,溶剂对气体物质的吸收 能力较低;但其解吸则较为容易。 2�

西北大学化工原理电子教案 令利用化学反应而实现吸收的操作,被称为化学吸收。化学反应大大扩展了吸收操作的应 用范围: ◇不可逆化学反应用于利用特定的气体物质实现特定液体或固体产品的生产,通常将此类 操作归于化学反应操作。 ◇可逆化学反应常用于大幅度提高溶剂对气体物质的吸收能力。显然,在吸收操作中适用 的化学反应应具有较高的反应速率和较高的选择性。 吸收操作的经济性评价一个操作的经济性,应综合考虑设备费和操作费两方面。但应注意: 设备费主要是一次性投入,而操作费则是经常性的不间断的消耗操作费用: ①流体输送消耗动能: ②吸收剂的损失(挥发、变质): ③溶剂的再生费用,即解吸操作费,再生费用不亚于吸收费用,再生费用需所占的比 例最大: 设备费用高,操作费用低(除过不会设计)但总费用取最优值。 吸收过程中气、液两相的接触方式气液两相实在吸收设备中进行接触的,吸收设备有多种 形式,但最为常用的是塔式设备,而吸收塔按气、液两相接触方式的不同又分为级式接触(如 板式塔)与微分接触(如填料塔、降膜塔或称湿壁塔)两大类。 气体 气体出 液体进 气体进 【体进 。液体出 液体出 填料塔 板式塔 ①板式塔一级式接触设备。叙述略 ②填料塔一微分接触式设备(即连续接触设备)叙述略
西北大学化工原理电子教案 利用化学反应而实现吸收的操作,被称为化学吸收。化学反应大大扩展了吸收操作的应 用范围: 不可逆化学反应用于利用特定的气体物质实现特定液体或固体产品的生产,通常将此类 操作归于化学反应操作。 可逆化学反应常用于大幅度提高溶剂对气体物质的吸收能力。显然,在吸收操作中适用 的化学反应应具有较高的反应速率和较高的选择性。 吸收操作的经济性 评价一个操作的经济性,应综合考虑设备费和操作费两方面。但应注意: 设备费主要是一次性投入,而操作费则是经常性的不间断的消耗操作费用: ① 流体输送消耗动能; ② 吸收剂的损失(挥发、变质); ③ 溶剂的再生费用,即解吸操作费,再生费用不亚于吸收费用,再生费用需所占的比 例最大; 设备费用高,操作费用低(除过不会设计)但总费用取最优值。 吸收过程中气、液两相的接触方式 气液两相实在吸收设备中进行接触的,吸收设备有多种 形式,但最为常用的是塔式设备,而吸收塔按气、液两相接触方式的不同又分为级式接触(如 板式塔)与微分接触(如填料塔、降膜塔或称湿壁塔)两大类。 ① 板式塔—级式接触设备。叙述略 ② 填料塔—微分接触式设备(即连续接触设备)叙述略 3���

西北大学化工原理电子教案 级式于微分接触两类设备可采用完全不同的两种计算方法,本章只讨论微分接触式吸收 过程的数学描述和计算法方法,但不是说吸收只能在填料塔中进行。 定态和非定态操作上述两种不同接触方式的传质设备中所进行的吸收或其它传质过程可 以是定态的连续过程,即设备内的过程参数都不随时间而变:也可以是非定态的,即间歇操 作或脉冲式的操作。以下除特别说明外,均指连续定态操作。 本章所作的基本假定只讨论微分接触的计算方法。 (1)气体混合物中只有一个组分溶于溶剂,其余组分在溶剂中的溶解度极低而可忽略不计, 因而可看作为一个惰性组分。 (2)溶剂不挥发,气相中有A和B,液相中C和A。 对本章的学习要求 ①吸收的机理 ②设计型计算一吸收剂选择一吸收剂用量 ③操作型计算 。本章所用到基本理论 ①物料平衡 ②相平衡关系 ③传递速率 8.2气液相平衡 湿壁塔吸收与第六章的套管换热器中的传热相比较,可看出异同,传热是冷、热流体之 间传递热量、推动力=T1,极限为T=1。 吸收是气一液两相之间物质传递,传递的是物质,但推动力不是浓度差,极限也不是两 相浓度相等,因为相平衡和热平衡不同。 在一定温度下,气、液两相长期或充分接触以后,两相趋于平衡,此时溶质在两相中的
西北大学化工原理电子教案 级式于微分接触两类设备可采用完全不同的两种计算方法,本章只讨论微分接触式吸收 过程的数学描述和计算法方法,但不是说吸收只能在填料塔中进行。 定态和非定态操作 上述两种不同接触方式的传质设备中所进行的吸收或其它传质过程可 以是定态的连续过程,即设备内的过程参数都不随时间而变;也可以是非定态的,即间歇操 作或脉冲式的操作。以下除特别说明外,均指连续定态操作。 本章所作的基本假定 只讨论微分接触的计算方法。 (1) 气体混合物中只有一个组分溶于溶剂,其余组分在溶剂中的溶解度极低而可忽略不计, 因而可看作为一个惰性组分。 (2) 溶剂不挥发,气相中有 A 和 B,液相中 C 和 A。 #对本章的学习要求 ① 吸收的机理 ② 设计型计算—吸收剂选择—吸收剂用量 ③ 操作型计算 #本章所用到基本理论 ① 物料平衡 ② 相平衡关系 ③ 传递速率 8.2 气液相平衡 湿壁塔吸收与第六章的套管换热器中的传热相比较,可看出异同,传热是冷、热流体之 间传递热量、推动力=T-t,极限为 T=t。 吸收是气—液两相之间物质传递,传递的是物质,但推动力不是浓度差,极限也不是两 相浓度相等,因为相平衡和热平衡不同。 在一定温度下,气、液两相长期或充分接触以后,两相趋于平衡,此时溶质在两相中的 4
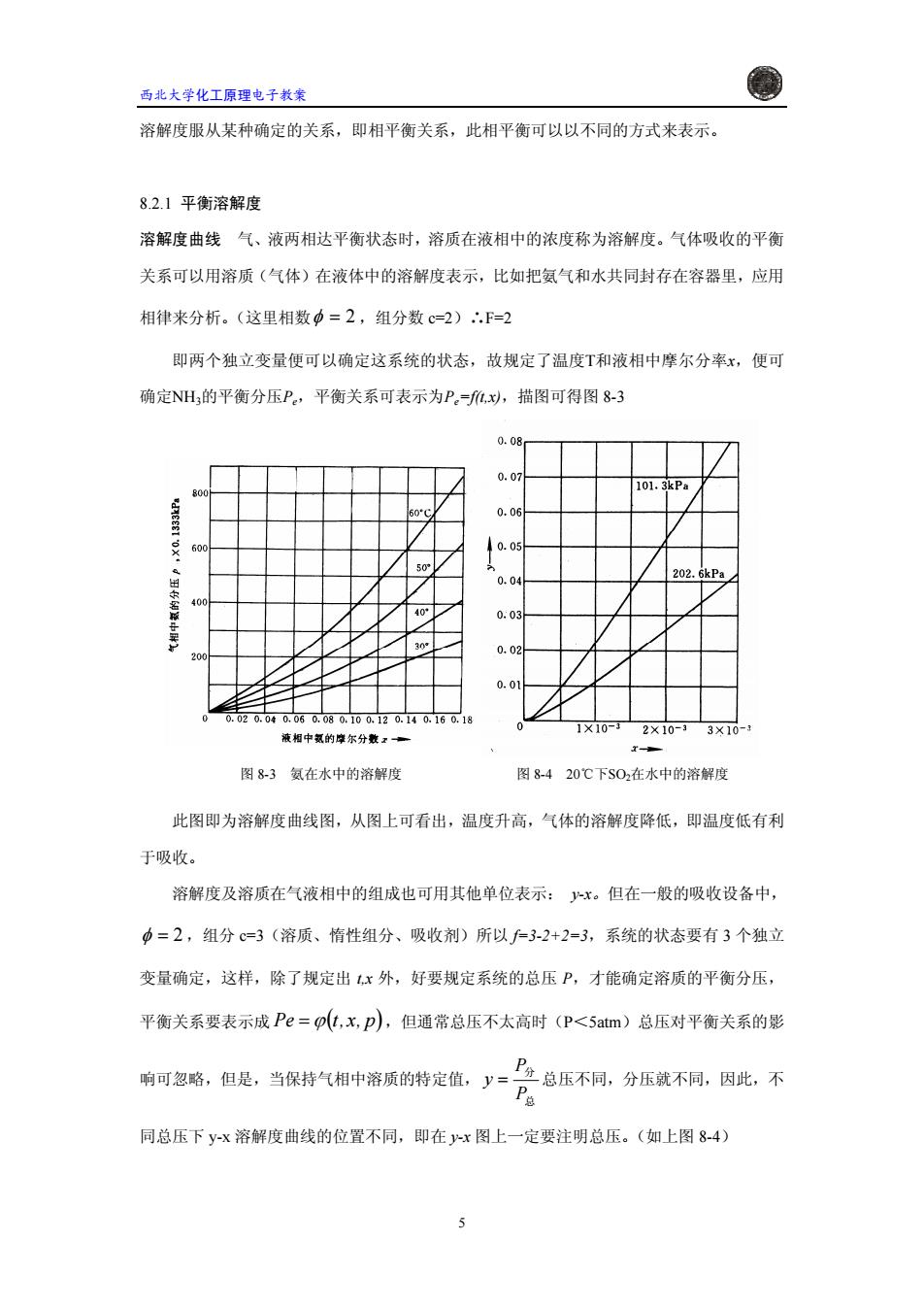
西北大学化工原理电子教案 溶解度服从某种确定的关系,即相平衡关系,此相平衡可以以不同的方式来表示。 8.2.1平衡溶解度 溶解度曲线气、液两相达平衡状态时,溶质在液相中的浓度称为溶解度。气体吸收的平衡 关系可以用溶质(气体)在液体中的溶解度表示,比如把氨气和水共同封存在容器里,应用 相律来分析。(这里相数中=2,组分数c=2)∴.F=2 即两个独立变量便可以确定这系统的状态,故规定了温度T和液相中摩尔分率x,便可 确定NH的平衡分压P。,平衡关系可表示为P。=j,x,描图可得图8-3 0.08 0.07 101.3kPa 80 60℃ 0.06 60 0.05 50 0.04 202.6kPa 40 40° 003 30 20 0.02 0.01 0.020.040.060.080.100,120.140.160.18 0 1×10-3 液相中氨的摩尔分数工一 2×10-33×10-3 图83氨在水中的溶解度 图8-420℃下S02在水中的溶解度 此图即为溶解度曲线图,从图上可看出,温度升高,气体的溶解度降低,即温度低有利 于吸收。 溶解度及溶质在气液相中的组成也可用其他单位表示:y-x。但在一般的吸收设备中, 中=2,组分c=3(溶质、惰性组分、吸收剂)所以=3-2+2=3,系统的状态要有3个独立 变量确定,这样,除了规定出1,x外,好要规定系统的总压P,才能确定溶质的平衡分压, 平衡关系要表示成Pe=p(t,x,p),但通常总压不太高时(P<5atm)总压对平衡关系的影 响可忽略,但是,当保持气相中溶质的特定值,y= P分总压不同,分压就不同,因此,不 同总压下y-x溶解度曲线的位置不同,即在y-x图上一定要注明总压。(如上图84) 5
西北大学化工原理电子教案 溶解度服从某种确定的关系,即相平衡关系,此相平衡可以以不同的方式来表示。 8.2.1 平衡溶解度 溶解度曲线 气、液两相达平衡状态时,溶质在液相中的浓度称为溶解度。气体吸收的平衡 关系可以用溶质(气体)在液体中的溶解度表示,比如把氨气和水共同封存在容器里,应用 相律来分析。(这里相数φ = 2 ,组分数 c=2)∴F=2 即两个独立变量便可以确定这系统的状态,故规定了温度T和液相中摩尔分率x,便可 确定NH3的平衡分压Pe,平衡关系可表示为Pe=f(t,x),描图可得图 8-3 图 8-3 氨在水中的溶解度 图 8-4 20℃下SO2在水中的溶解度 此图即为溶解度曲线图,从图上可看出,温度升高,气体的溶解度降低,即温度低有利 于吸收。 溶解度及溶质在气液相中的组成也可用其他单位表示: y-x。但在一般的吸收设备中, φ = 2 ,组分 c=3(溶质、惰性组分、吸收剂)所以 f=3-2+2=3,系统的状态要有 3 个独立 变量确定,这样,除了规定出 t,x 外,好要规定系统的总压 P,才能确定溶质的平衡分压, 平衡关系要表示成 =ϕ( p,x,tPe ),但通常总压不太高时(P<5atm)总压对平衡关系的影 响可忽略,但是,当保持气相中溶质的特定值, 总 分 P P y = 总压不同,分压就不同,因此,不 同总压下 y-x 溶解度曲线的位置不同,即在 y-x 图上一定要注明总压。(如上图 8-4) 5

西北大学化工原理电子教案 享利定律如果气体吸收所形成的溶液是理想溶液,则依据拉乌尔定律有P=P°x,只有 溶质分子与溶解分子的大小,结构,化学性质都很相近时,上式才成立,但这种情况在气体 吸收操作理很难遇到,吸收操作最常用于分离低浓度的气体混合物,低浓度气体混合物吸收 时液相浓度通常也较低。在稀溶液范围内,有 Pe=Ex (8-1) 此时表达溶液的浓度低于一定数值时,溶质的平衡压力与它在溶液中的摩尔分率成正 比,这就是亨利定律,E叫亨利常数,不管溶液是否理想,只要浓度足够低,亨利定律都适 用,只是对于非理想溶液E≠P°」 另外可表示成 P=H-C C-kmol/m3 H-N-m/kmol (8-2) ye=mx 一该式用得最多 (8-3) E,H,m是以不同单位表示的亨利常数,m又称相平衡常数 E,H,m是各曲线直线部分的斜率,E,Hm值越小,表示溶解度越大。(如图8-4,P6) Je=mx→ =mx (设气相为理想气体混合物) P.=Ex E .m= 又 Pe=Ex三Pe=E.C(C一混合液的总摩尔浓度kmo/nm) CM P=H-C ∴.E=HCM 而 Cu=Pa=- M。M+M,-刘P。一混合液的密度,M。一混合液的平均分子 Pm 量) 对稀溶液 CM Ps Ms 代入 E=HCm式中 E=HPs Ms 常见物系的气液溶解度数据,亨利常数E或H可查有关手册。 6
西北大学化工原理电子教案 亨利定律 如果气体吸收所形成的溶液是理想溶液,则依据拉乌尔定律有 ,只有 溶质分子与溶解分子的大小,结构,化学性质都很相近时,上式才成立,但这种情况在气体 吸收操作理很难遇到,吸收操作最常用于分离低浓度的气体混合物,低浓度气体混合物吸收 时液相浓度通常也较低。在稀溶液范围内,有 xPPe o = = ExPe (8-1) 此时表达溶液的浓度低于一定数值时,溶质的平衡压力与它在溶液中的摩尔分率成正 比,这就是亨利定律,E 叫亨利常数,不管溶液是否理想,只要浓度足够低,亨利定律都适 用,只是对于非理想溶液 E≠ o P . 另外可表示成 P e=H·C C—kmol/m3 H—N·m/kmol (8-2) e = mxy —该式用得最多 (8-3) E, H, m 是以不同单位表示的亨利常数,m 又称相平衡常数 E, H, m 是各曲线直线部分的斜率,E, H, m 值越小,表示溶解度越大。(如图 8-4,P6) ExP mx P P mxye e e = =⇒= (设气相为理想气体混合物) ∴ P E m = 又 CM C EPeExPe ⋅=⇒= ( CM—混合液的总摩尔浓度kmol/m3 ) P e=H·C ∴E=HCM 而 ( ) xMMM C sx m m m M −+ == 1 ρ ρ ( ρ m —混合液的密度,Mm—混合液的平均分子 量) 对稀溶液 S S M M C ρ ≈ 代入 E=HCm式中 S S M HE ρ = 常见物系的气液溶解度数据,亨利常数 E 或 H 可查有关手册。 6

西北大学化工原理电子教案 说明:在较宽浓度范围内y。=f(x)非直线:在有限的浓度范围内,溶解度曲线可近似 取为直线。但此直线一般不一定通过原点,与亨利定律有区别。 例某系统温度为10℃,总压101.3kP,试求此条件下在与空气充分接触后的水中,每立 方米水溶解了多少克氧气? 解:空气按理想气体处理,由道尔顿分压定律可知,氧气在气相中的分压为: PA=py=101.3×0.21=21.27kPa 氧气为难溶气体,故氧气在水中的液相组成x很低,气液相平衡关系服从亨利定律,查 表得10℃时,氧气在水中的亨利系数E为3.31×10kPa。 H=Ps EMs C=HpA .ch=PspA EMs 故 1000×21.27 CA= =3.57×104kmol/m3 3.31×106×18 mA=3.57×104×32×1000=11.42g/m3 8.2.2相平衡与吸收过程的关系 判别过程的方向过程进行的方向,(吸收还是解吸)用实例来说明。设101.3kP,20℃下, 稀MH3水的相平衡方程式为y。=0.94x。让含氨y=10%和x=0.05的氨水接触,判断过程进 行的方向,与x=0.05相平衡的气相浓度,y。=0.94×0.05=0.047.实际气相浓度y=0.1> 0.047,所以两相接触时部分氨将会从气相转入液相。实际发生的是吸收过程。 另外,与y=0.1相平衡的液相浓度 y0.1 X。== =0.106 m0.94 而x=0.05<0.106,所以两相接触发生的是吸收过程。 相反的,若y=0.05,x=0.1气液两相接触。y。=0.94x此时 y。=0.94×0.1=0.094,y<V若过程继续进行,将要使y的实际浓度增大,此时部分
西北大学化工原理电子教案 说明:在较宽浓度范围内 (xfy ) e = 非直线;在有限的浓度范围内,溶解度曲线可近似 取为直线。但此直线一般不一定通过原点,与亨利定律有区别。 例 某系统温度为 10o C,总压 101.3kPa,试求此条件下在与空气充分接触后的水中,每立 方米水溶解了多少克氧气? 解:空气按理想气体处理,由道尔顿分压定律可知,氧气在气相中的分压为: = pyp =101.3×0.21=21.27kPa * A 氧气为难溶气体,故氧气在水中的液相组成x很低,气液相平衡关系服从亨利定律,查 表得 10o C时,氧气在水中的亨利系数E为 3.31×106 kPa。 Q S S EM H ρ = A * A = Hpc ∴ S * AS A EM p c ρ = 故 = × × × = 181031.3 27.211000 6 * Ac 3.57×10-4kmol/m3 mA=3.57×10-4×32×1000=11.42g/m3 8.2.2 相平衡与吸收过程的关系 判别过程的方向 过程进行的方向,(吸收还是解吸)用实例来说明。设 101.3kPa,20o C下, 稀MH3水的相平衡方程式为 。让含氨y=10%和x=0.05 的氨水接触,判断过程进 行的方向,与x=0.05 相平衡的气相浓度, xye = 94.0 ye = × = 047.005.094.0 .实际气相浓度y=0.1> 0.047,所以两相接触时部分氨将会从气相转入液相。实际发生的是吸收过程。 另外,与 y=0.1 相平衡的液相浓度 106.0 94.0 1.0 === m y xe 而 x=0.05<0.106,所以两相接触发生的是吸收过程。 相反的,若 y=0.05,x=0.1 气液两相接触。 xye = 94.0 此时 ye =×= 094.01.094.0 , < yey 若过程继续进行,将要使 y 的实际浓度增大,此时部分 7

西北大学化工原理电子教案 香 氨将由液相转入气相,发生解吸过程或x=上=0.0 =0.053x) m0.94 即 y>y或xx,时发生的是解吸过程 指明过程的极限过程进行的极限(终点) G0,-)=k-,)→x=2-)+x ①若减L,x,即使H很高,L很小时,x也不会无限增大,传质过程进行的终点是x只能 达到与气相浓度y,相平衡的浓度x1e即xIma=xIe= m X2 X1y2e 计算过程的推动力平衡是过程的极限,只有不平衡的两相接触才会进行传质。在吸收过程 中,常以实际浓度与平衡浓度的偏离来表示吸收的推动力
西北大学化工原理电子教案 氨将由液相转入气相,发生解吸过程或 053.0 94.0 05.0 === m y xe <x( ) e > xx 即 > yey 或 时 xx e 发生的是解吸过程 指明过程的极限 过程进行的极限(终点) ( )( ) ( ) 21 21 1 221 xyy L G xxxLyyG +−=⇒−=− ①若减L,x1 即使H很高,L很小时,x1也不会无限增大,传质过程进行的终点是x1只能 达到与气相浓度y1相平衡的浓度x1e即x1max=x1e= m y1 x2 y1 x1y2e y1 x2 ②若G很小、L很大时,即使是H很高,y2也不会无限制的降低,y2的极限浓度为与x2相 平衡浓度即y2max=y2e=mx2 从此可知,相平衡关系限制了吸收剂离塔时的最高浓度x1,x1<x1e和气体混合物出塔时 的最低浓度y2>y2e 计算过程的推动力 平衡是过程的极限,只有不平衡的两相接触才会进行传质。在吸收过程 中,常以实际浓度与平衡浓度的偏离来表示吸收的推动力。 8

西北大学化工原理电子教案 I区一吸收 Ⅱ区一解吸 Xe 图8-8吸收推动力 (y-y。)一气相浓度差表示的吸收推动力 (xex)一以液相浓度差表示的吸收推动力 若塔在任一截面浓度(G,y)位于平衡溶解度曲线图上的A'点,那么此时发生的将是 解吸过程。 (y。y)一以气相浓度差表示的解吸推动力 (x-xe)一以液相浓度差表示的解吸推动力 I区为吸收(溶解区域):Ⅱ区为解吸区域 例在总压101.3kPa,温度30℃的条件下,S02摩尔分率为0.3的混合气体与S02摩尔分率 为0.01的水溶液相接触,试问: (1) 从液相分析$O2的传质方向: (2) 从气相分析,其它条件不变,温度降到0℃时SO2的传质方向: (3) 其它条件不变,从气相分析,总压提高到202.6kPa时SO2的传质方向,并计算以液 相摩尔分率差及气相摩尔率差表示的传质推动力。 解:(1)查得在总压101.3kPa,温度30℃条件下S02在水中的亨利系数E=4850kPa 所以 E4850 =47.88 p101.3 从液相分析 x=上=03 =0.00627<x=0.01 m47.88 故$O2必然从液相转移到气相,进行解吸过程。 (2)查得在总压101.3kPa,温度0℃的条件下,SO2在水中的亨利系数E=1670kPa 9
西北大学化工原理电子教案 A y ye x xe 平 衡 线 y x 图 8-8 吸收推动力 Ⅰ Ⅱ I 区 — 吸 收 II区—解吸 (y-ye)—气相浓度差表示的吸收推动力 (xe-x)—以液相浓度差表示的吸收推动力 若塔在任一截面浓度(x,y)位于平衡溶解度曲线图上的 A′点,那么此时发生的将是 解吸过程。 (ye-y)—以气相浓度差表示的解吸推动力 (x-xe)—以液相浓度差表示的解吸推动力 I 区为吸收(溶解区域);II 区为解吸区域 例 在总压 101.3kPa,温度 30o C的条件下,SO2摩尔分率为 0.3 的混合气体与SO2摩尔分率 为 0.01 的水溶液相接触,试问: (1) 从液相分析SO2的传质方向; (2) 从气相分析,其它条件不变,温度降到 0o C时SO2的传质方向; (3) 其它条件不变,从气相分析,总压提高到 202.6kPa时SO2的传质方向,并计算以液 相摩尔分率差及气相摩尔率差表示的传质推动力。 解:(1)查得在总压 101.3kPa,温度 30o C条件下SO2在水中的亨利系数E=4850kPa 所以 == p E m = 3.101 4850 47.88 从液相分析 00627.0 88.47 * 3.0 === m y x < x=0.01 故SO2必然从液相转移到气相,进行解吸过程。 (2)查得在总压 101.3kPa,温度 0o C的条件下,SO2在水中的亨利系数E=1670kPa 9

西北大学化工原理电子教案 e E1670 m= =16.49 p101.3 从气相分析 y=mx=16.49×0.01=0.16<y=0.3 故$O2必然从气相转移到液相,进行吸收过程。 (4)在总压202.6kPa,温度30℃条件下,SO2在水中的亨利系数E=4850kPa E4850 m= =23.94 p202.6 从气相分析 y=mx=23.94×0.01=0.24y=0.3 故$O2必然从气相转移到液相,进行吸收过程。 x*=上=03 =0.0125 m23.94 以液相摩尔分数表示的吸收推动力为: △x=x-3x=0.0125-0.01=0.0025 以气相摩尔分数表示的吸收推动力为: △y=y-y'=0.3-0.24=0.06 结论:降低操作温度,E↓、↓,溶质在液相中的溶解度增加,有利于吸收: 压力不太高时,P个,E变化忽略不计:但个使溶质在液相中的溶解度增加,有 利于吸收。 作业1,2,3 83扩散和单相传质 任何传质过程都涉及到两个基本问题,过程的极限和过程的速率。吸收过程的极限决定 于吸收的相平衡关系,前面己作了介绍,这一节主要讨论吸收过程的速率,以后将以速率作 为分析吸收操作与计算吸收设备的依据。 吸收过程涉及到两相间的物质传递。其物质传递的步骤与传热相似。 步骤:①可溶组分由气相主体传递到两相界面,即气相内的物质传递: ②溶质在相界面上的溶解,由气相传入液相,即界面上的溶解: ③溶质自界面被传递至液相主体,即物质在液相内的传递。 o
西北大学化工原理电子教案 == p E m 3.101 1670 =16.49 从气相分析 y * =mx=16.49×0.01=0.16<y=0.3 故SO2必然从气相转移到液相,进行吸收过程。 (4) 在总压 202.6kPa,温度 30o C条件下,SO2在水中的亨利系数E=4850kPa == p E m 6.202 4850 =23.94 从气相分析 y * =mx=23.94×0.01=0.24<y=0.3 故SO2必然从气相转移到液相,进行吸收过程。 0125.0 94.23 3.0 * === m y x 以液相摩尔分数表示的吸收推动力为: ∆x=x* -x=0.0125-0.01=0.0025 以气相摩尔分数表示的吸收推动力为: ∆y= y - y* =0.3-0.24=0.06 结论:降低操作温度,E↓、m↓,溶质在液相中的溶解度增加,有利于吸收; 压力不太高时,P↑, E 变化忽略不计;但 m↑使溶质在液相中的溶解度增加,有 利于吸收。 作业 1,2,3 8.3 扩散和单相传质 任何传质过程都涉及到两个基本问题,过程的极限和过程的速率。吸收过程的极限决定 于吸收的相平衡关系,前面已作了介绍,这一节主要讨论吸收过程的速率,以后将以速率作 为分析吸收操作与计算吸收设备的依据。 吸收过程涉及到两相间的物质传递。其物质传递的步骤与传热相似。 步骤:①可溶组分由气相主体传递到两相界面,即气相内的物质传递; ②溶质在相界面上的溶解,由气相传入液相,即界面上的溶解; ③溶质自界面被传递至液相主体,即物质在液相内的传递。 10