
西北大学化工原理 第二节 气液相平衡 在一定温度下,气、液两相长期或充分接触以 后,两相趋于平衡,此时溶质在两相中的溶解度服 从某种确定的关系,即相平衡关系,此相平衡可以 以不同的方式来表示 气液相平衡关系 1、平衡溶解度 溶解度:气、液两相达平衡状态时,溶质在液相 中的浓度。 F=C-0+2=3-2+2=3
西北大学化工原理 第二节 气液相平衡 一、气液相平衡关系 1、平衡溶解度 溶解度:气、液两相达平衡状态时,溶质在液相 中的浓度 。 F=C-ϕ+2=3-2+2=3 在一定温度下,气、液两相长期或充分接触以 后,两相趋于平衡,此时溶质在两相中的溶解度服 从某种确定的关系,即相平衡关系,此相平衡可以 以不同的方式来表示

西北大学化工原理 比如把氨气和水共同封存在容器里,应用相 律来分析 (这里相数 中=2,组分数c=2) 。。 F=2 两个独立变量便可以确定这系统的状态,规 定了温度T和液相中摩尔分率x,便可确定H 的平衡分压Pe,平衡关系可表示为 Pe=f(t,x)
西北大学化工原理 (这里相数 ,组分数c=2) ∴ F=2 φ = 2 两个独立变量便可以确定这系统的状态,规 定了温度T和液相中摩尔分率x,便可确定NH3 的平衡分压Pe,平衡关系可表示为 Pe=f(t,x) 比如把氨气和水共同封存在 容器里,应用相 律来分析
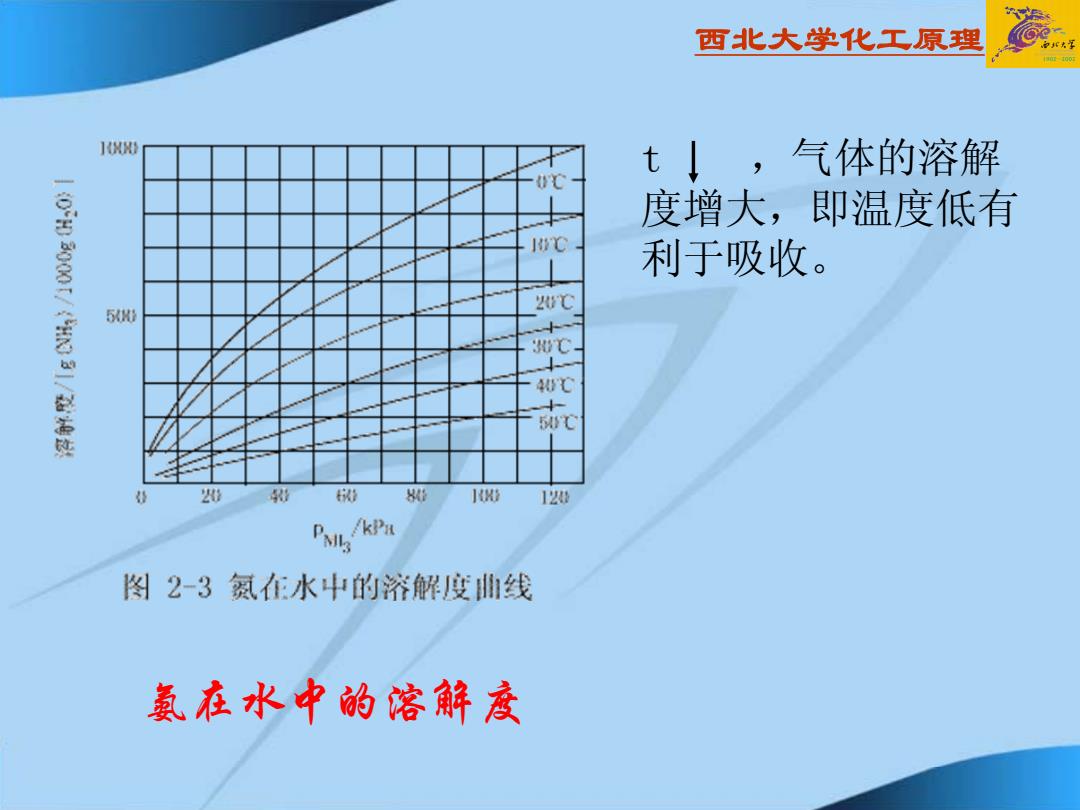
西北大学化工原理 10 t↓,气体的溶解 0℃ 度增大,即温度低有 HYC 利于吸收。 2w℃ 5 w℃ 40C 5C 20 0 80 120 PMi /KPa 图2-3氯在水中的溶解度曲线 氨在水中的溶解度
西北大学化工原理 氨在水中的溶解度 t ,气体的溶解 度增大,即温度低有 利于吸收

西北大学化工原理 在一般的吸收设备中,组分C=3(溶质、惰性组分、吸 收剂) 中=2 f=3-2+2=3 Pe=p(t,x,P) 通常总压不太高时(P<5atm),总压对平衡关系的影 响可忽略 y 总 总压不同,分压就不同, 结论:不同总压下y~x溶解度曲线的位置不同,即 在y~x图上一定要注明总压
西北大学化工原理 在一般的吸收设备中,组分c=3(溶质、惰性组分、吸 收剂) φ = 2 f=3-2+2=3 =ϕ( ,, PxtPe ) 通常总压不太高时(P<5atm),总压对平衡关系的影 响可忽略 总 分 P P y = 总压不同,分压就不同, 结论:不同总压下y~x溶解度曲线的位置不同,即 在y~x图上一定要注明总压

西北大学化工原理 250 2 10寸 150 I 40 50 0 20 40 0 80 丽 120 Psn,/kPa 图2-4三氧化硫在水中的溶解度曲线 20下SO2在水中的客解度
西北大学化工原理 20℃下SO2在水中的溶解度
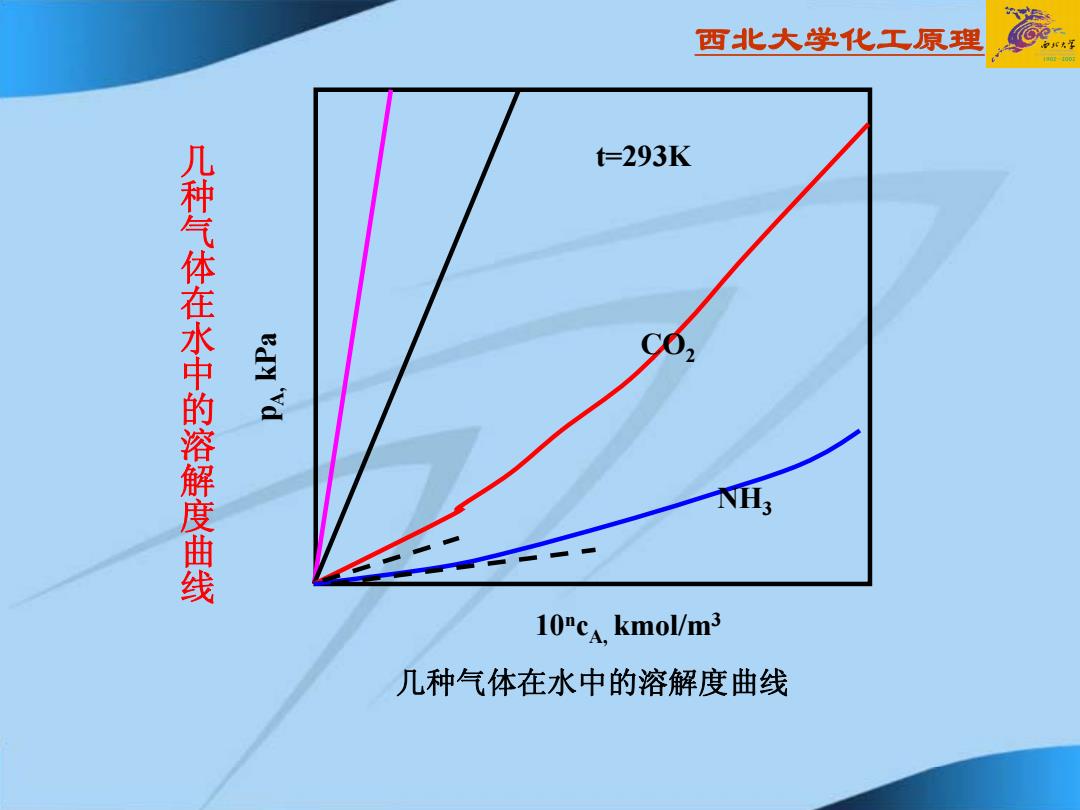
西北大学化工原理 t=293K 几种气体在水中的溶解度曲线 edy "Yd 10PcA.kmol/m3 几种气体在水中的溶解度曲线
西北大学化工原理 几种气体在水中的溶解度曲线 t=293KCO 2 NH 3 10 n cA, kmol/m 3 pA, kPa 几种气体在水中的溶解度曲线

西北大学化工原理 讨论: (1)总压、一定,温度下降,在同一溶剂中,溶质的 溶解度x随之增加,有利于吸收。 (2)温度、y一定,总压增加,在同一溶剂中,溶质的 溶解度随之增加, 有利于吸收。 (3)相同的总压及摩尔分率, C02<CCo2<CS02<CNH3 氧气等为难溶气体,氨气等为易溶气体
西北大学化工原理 讨论: (1)总压、y一定,温度下降,在同一溶剂中,溶质的 溶解度x随之增加,有利于吸收。 (2)温度、y一定,总压增加,在同一溶剂中,溶质的 溶解度x随之增加,有利于吸收。 (3)相同的总压及摩尔分率, cO2 < cCO2 < cSO2 < cNH3 氧气等为难溶气体,氨气等为易溶气体

西北大学化工原理 2.亨利定律 (1)亨利定律内容 总压不高时,在一定温度下,稀溶液上方气 相中溶质的平衡分压与溶质在液相中的摩尔分率成正 比,其比例系数为亨利系数。 Pe=Ex Pe 溶质在气相中的平衡分压,kPa; X 溶质在液相中的摩尔分率; E 亨利常数,单位同压强单位
西北大学化工原理 2.亨利定律 (1)亨利定律内容 总压不高时,在一定温度下,稀溶液上方气 相中溶质的平衡分压与溶质在液相中的摩尔分率成正 比,其比例系数为亨利系数。 = ExPe pe ——溶质在气相中的平衡分压,kPa; x——溶质在液相中的摩尔分率; E——亨利常数,单位同压强单位

西北大学化工原理 讨论: 1)E的影响因素:溶质、溶剂、T 物系一定,T↑→E↑ 2)E大的,溶解度小,难溶气体 E小的,溶解度大,易溶气体 3)E的来源:实验测得;查手册
西北大学化工原理 讨论: 1)E的影响因素:溶质、溶剂、T 物系一定,T ↑⇒ E ↑ 2)E大的,溶解度小,难溶气体 E小的,溶解度大,易溶气体 3)E的来源:实验测得;查手册

西北大学化工原理 (2)亨利定律其它形式 1) Pe=HC C一摩尔浓度,kmol/m3; H一亨利常数,KN·M/kmol 与的关系: Pe=Ex→Pe=E.C Cw一混合液的总摩尔浓度kmol/m3 E=HCM
西北大学化工原理 (2)亨利定律其它形式 1) Pe=HC C—摩尔浓度,kmol/m3; H—亨利常数,KN·M/kmol H与E的关系: CM C EPeExPe ⋅=⇒= CM—混合液的总摩尔浓度kmol/m3 E=HCM