
第十四章 微生物与食品安全 ⚫ ——食品卫生的微生物学检验 ⚫ 检验内容: ⚫ 细菌总数的测定; ⚫ 大肠菌群最近似数(MPN)的测定; ⚫ 病原菌检验;
第十四章 微生物与食品安全 ⚫ ——食品卫生的微生物学检验 ⚫ 检验内容: ⚫ 细菌总数的测定; ⚫ 大肠菌群最近似数(MPN)的测定; ⚫ 病原菌检验;

注意事项: 1、要提前了解有关微生物的特性 2、做好准备工作(培养基、标准 菌株及其他材料的准备); 3、注意无菌操作: 打开任何样品容器之前,在取样开口 处的周围表面,必须擦干净,去除会 污染样品的物质,用70%酒精擦拭消 毒,防止污染
注意事项: 1、要提前了解有关微生物的特性 2、做好准备工作(培养基、标准 菌株及其他材料的准备); 3、注意无菌操作: 打开任何样品容器之前,在取样开口 处的周围表面,必须擦干净,去除会 污染样品的物质,用70%酒精擦拭消 毒,防止污染

⚫第一节 细菌总数的测定 ⚫ ⚫ 一、概念/单位:[个/ml·g(cm2 )] ⚫ 是指每克(或每毫升)样品中所含细菌的数量。 ⚫ 二、测定方法: ⚫ (一)样品稀释及倾注平板: ⚫ 1、无菌操作,取试样10克(或10毫升)放于含有100毫 升(如检样为液体则改为90毫升)灭菌生理盐水或其它 稀释液的灭菌玻璃瓶内(瓶内予先放置适当数量的玻璃 珠)或灭菌乳钵内,经充分振摇或研磨作成1:10的均 匀稀释液
⚫第一节 细菌总数的测定 ⚫ ⚫ 一、概念/单位:[个/ml·g(cm2 )] ⚫ 是指每克(或每毫升)样品中所含细菌的数量。 ⚫ 二、测定方法: ⚫ (一)样品稀释及倾注平板: ⚫ 1、无菌操作,取试样10克(或10毫升)放于含有100毫 升(如检样为液体则改为90毫升)灭菌生理盐水或其它 稀释液的灭菌玻璃瓶内(瓶内予先放置适当数量的玻璃 珠)或灭菌乳钵内,经充分振摇或研磨作成1:10的均 匀稀释液

⚫ 2、用1毫升灭菌吸管,吸取1:10稀释液1毫升,注入 含有9毫升灭菌生理盐水或其他稀释液的试管内,振摇 试管混合均匀,作成1:100稀释液。 ⚫ 3、另取1毫升吸管,按以上操作顺序作10倍递增稀释 液,如此每递增稀释1次,即换用1支1毫升灭菌吸管。 ⚫ 4、根据对样品污染情况的估计,选择2—3个适宜稀释 度。分别在作10倍递增稀释的同时,即以吸取该稀释 度的吸管移1毫升稀释液于灭菌平皿内,每个稀释度作 2个平皿。 ⚫ 5、稀释液移入平皿内后,即时将冷至45—55℃的营养 琼脂培养基(可放置于46℃水浴保温)倾注平皿约15 毫升,并移动平皿使混合均匀
⚫ 2、用1毫升灭菌吸管,吸取1:10稀释液1毫升,注入 含有9毫升灭菌生理盐水或其他稀释液的试管内,振摇 试管混合均匀,作成1:100稀释液。 ⚫ 3、另取1毫升吸管,按以上操作顺序作10倍递增稀释 液,如此每递增稀释1次,即换用1支1毫升灭菌吸管。 ⚫ 4、根据对样品污染情况的估计,选择2—3个适宜稀释 度。分别在作10倍递增稀释的同时,即以吸取该稀释 度的吸管移1毫升稀释液于灭菌平皿内,每个稀释度作 2个平皿。 ⚫ 5、稀释液移入平皿内后,即时将冷至45—55℃的营养 琼脂培养基(可放置于46℃水浴保温)倾注平皿约15 毫升,并移动平皿使混合均匀

⚫ (二)培养 ⚫ 待琼脂凝固后,翻转平皿,置37℃温箱内培养24—48 小时后取出,计算平皿内菌落数目,乘以稀释倍数, 即得每克(或每毫升)样品所含菌落总数。 ⚫ (三)菌落计数方法 ⚫ 作平皿菌落计数时,可用肉眼观察,必要时用放大镜 检查,以防遗漏,在记下各皿的菌落数后,求出同稀 释度的各皿平均菌落数。 ⚫ 1、平皿菌落数的选择:选取菌落数在30—300之间的 平皿作为菌落总数的测定标准。一个稀释度使用两个 平皿时,应采取两个平皿平均数;如其中一个平皿有 较大片状菌落生长时,则不宜采用,而应以无片状菌 落生长的平皿作为该稀释度的菌落数。若片状菌落不 到平皿的一半时,而其余一半中菌落分布又很均匀, 则可计数半个平皿后乘以2代表全皿菌落数
⚫ (二)培养 ⚫ 待琼脂凝固后,翻转平皿,置37℃温箱内培养24—48 小时后取出,计算平皿内菌落数目,乘以稀释倍数, 即得每克(或每毫升)样品所含菌落总数。 ⚫ (三)菌落计数方法 ⚫ 作平皿菌落计数时,可用肉眼观察,必要时用放大镜 检查,以防遗漏,在记下各皿的菌落数后,求出同稀 释度的各皿平均菌落数。 ⚫ 1、平皿菌落数的选择:选取菌落数在30—300之间的 平皿作为菌落总数的测定标准。一个稀释度使用两个 平皿时,应采取两个平皿平均数;如其中一个平皿有 较大片状菌落生长时,则不宜采用,而应以无片状菌 落生长的平皿作为该稀释度的菌落数。若片状菌落不 到平皿的一半时,而其余一半中菌落分布又很均匀, 则可计数半个平皿后乘以2代表全皿菌落数

⚫ 2、稀释度的选择: ⚫ ①应选择平均菌落数在30—300之间的稀释度,乘以稀 释倍数报告之(见表中例1) ⚫ ②若有两个稀释度,其生长的菌落数均在30—300之间, 则应视二者之比如何来决定,若其比值小于2,应报告 其平均数,若大于2则报告其中较小的数字(见表中例 2及3) ⚫ ③若所有稀释度的平均菌落数均大于300,则应按稀释 度最高的平均菌落数乘以稀释倍数报告之(根据表中 例4) ⚫ ④若所有稀释度的平均菌落数均小于300,则应按稀释 倍数最低的平均菌落数乘以稀释倍数报之(见表中例5)
⚫ 2、稀释度的选择: ⚫ ①应选择平均菌落数在30—300之间的稀释度,乘以稀 释倍数报告之(见表中例1) ⚫ ②若有两个稀释度,其生长的菌落数均在30—300之间, 则应视二者之比如何来决定,若其比值小于2,应报告 其平均数,若大于2则报告其中较小的数字(见表中例 2及3) ⚫ ③若所有稀释度的平均菌落数均大于300,则应按稀释 度最高的平均菌落数乘以稀释倍数报告之(根据表中 例4) ⚫ ④若所有稀释度的平均菌落数均小于300,则应按稀释 倍数最低的平均菌落数乘以稀释倍数报之(见表中例5)

⚫ ⑤若所有稀释度的平均菌落均不在30—300之间,其中 一部分大于300或小于30时,则以最近于30或300的平 均菌数乘以稀释倍数报告之(见表中例6) ⚫ ⚫ 3、菌落数的报告:菌落数在100以内时按实有数报告, 大于100时,采用二位有效数字,在二位有效数字后面 的数值,以4舍5入方法计算,为了缩短数字后面的零 数,也可用10的指数来表示(见表中报告方式栏)
⚫ ⑤若所有稀释度的平均菌落均不在30—300之间,其中 一部分大于300或小于30时,则以最近于30或300的平 均菌数乘以稀释倍数报告之(见表中例6) ⚫ ⚫ 3、菌落数的报告:菌落数在100以内时按实有数报告, 大于100时,采用二位有效数字,在二位有效数字后面 的数值,以4舍5入方法计算,为了缩短数字后面的零 数,也可用10的指数来表示(见表中报告方式栏)
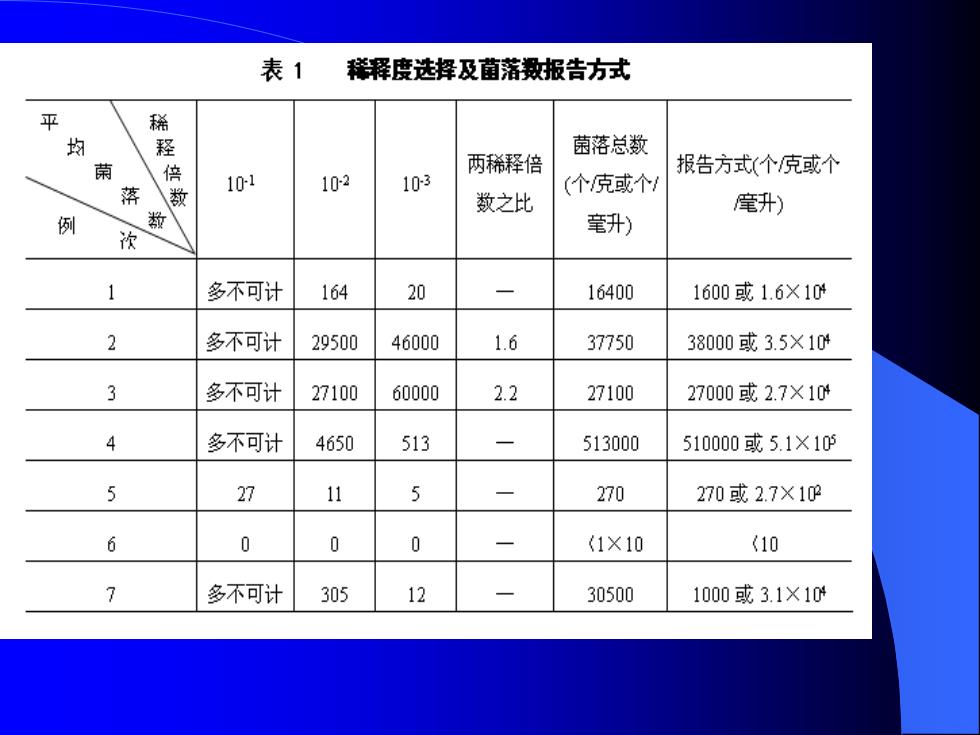
表1 稀释度选择及菌落数报告方式 灾 稀 均 菌落总数 蘭 两稀释倍 报告方式(个克或个 落 数 10-1 10-2 103 (个克或个1 数之比 毫升) 例 数 毫升) 多不可计 164 20 16400 1600或1.6X10 2 多不可计 29500 46000 1.6 37750 38000或3.5×104 3 多不可计 27100 60000 2.2 27100 27000或2.7×104 4 多不可计 4650 513 513000 510000或5.1×10的 27 11 5 270 270或2.7X19 6 0 0 0 (1×10 (10 多不可计 305 12 30500 1000或3.1×104

⚫ 第二节 大肠菌群最近似数(MPN)的测定 ⚫ ⚫ 一、概念/单位:[个/100ml·g] ⚫ 大肠菌群系指一群在37℃ 24h能发酵乳糖产酸 产气,需氧或兼性厌氧的革兰氏阴性无芽胞杆 菌。 ⚫ 二、测定方法 ⚫ 1、样品稀释(同细菌总数测定); ⚫ 2、接种乳糖胆盐发酵管(3×3=9支); ⚫ 3、鉴别培养(伊红美兰、远藤氏琼脂); ⚫ 4、乳糖复发酵试验; ⚫ 三、结果报告(按照国标及有关标准)
⚫ 第二节 大肠菌群最近似数(MPN)的测定 ⚫ ⚫ 一、概念/单位:[个/100ml·g] ⚫ 大肠菌群系指一群在37℃ 24h能发酵乳糖产酸 产气,需氧或兼性厌氧的革兰氏阴性无芽胞杆 菌。 ⚫ 二、测定方法 ⚫ 1、样品稀释(同细菌总数测定); ⚫ 2、接种乳糖胆盐发酵管(3×3=9支); ⚫ 3、鉴别培养(伊红美兰、远藤氏琼脂); ⚫ 4、乳糖复发酵试验; ⚫ 三、结果报告(按照国标及有关标准)

⚫第三节 病原菌检验 ⚫ 一、检验内容:沙门氏菌、志贺氏菌、葡萄球 菌、变形杆菌、副溶血性弧菌等。 ⚫ 二、检验方法:以沙门氏菌为例 ⚫ 1、前增菌; ⚫ 2、选择性增菌; ⚫ 3、选择性平板分离; ⚫ 4、生化试验; ⚫ 5、血清学反应; ⚫ ⚫ 三、实验结果:食品中不允许有病原菌存在。 ⚫ ★ 检验程序见下页图
⚫第三节 病原菌检验 ⚫ 一、检验内容:沙门氏菌、志贺氏菌、葡萄球 菌、变形杆菌、副溶血性弧菌等。 ⚫ 二、检验方法:以沙门氏菌为例 ⚫ 1、前增菌; ⚫ 2、选择性增菌; ⚫ 3、选择性平板分离; ⚫ 4、生化试验; ⚫ 5、血清学反应; ⚫ ⚫ 三、实验结果:食品中不允许有病原菌存在。 ⚫ ★ 检验程序见下页图