
主要角客 实验介绍 二、实验目的 三、实验原理 四、实验内容 五、实验操作 六、思考题 中因人油大学#
主要内容 一、实验介绍 二、实验目的 三、实验原理 四、实验内容 五、实验操作 六、思考题

、实验介绍 宏观粒子的运动状态 微观粒子的运动状态 经典力学:牛顿定律 量子力学:薛定谔方程 能量、动量连续变化 能量、动量量子化 本实验以C℉,CL,分子作为研究对象,应用从头算法求解薛定 谔方程来获得该分子的轨道能量、波函数及轨道电子密度分 布。 中网石油大学 CHINA UNIVERSITY OF PETROLEDM
一、实验介绍 宏观粒子的运动状态 微观粒子的运动状态 经典力学:牛顿定律 量子力学:薛定谔方程 能量、动量连续变化 能量、动量量子化 • 本实验以CF2Cl2分子作为研究对象,应用从头算法求解薛定 谔方程来获得该分子的轨道能量、波函数及轨道电子密度分 布

二、实验目的 1.了解分子轨道理论和从头算法的基础知识。 2.学习分子构型的建立和优化。 3.掌握分子结构计算的基本方法和相关软件的使用。 软件:Chem3D、Gaussian09 分子构型的建立、 计算分子波函数、轨道 显示电子密度分布 能量和电子密度分布 中网方油大学 HINA UNIVERSITY OF PETROLEOM
二、实验目的 1.了解分子轨道理论和从头算法的基础知识。 2.学习分子构型的建立和优化。 3.掌握分子结构计算的基本方法和相关软件的使用。 软件:Chem3D、Gaussian09 分子构型的建立、 显示电子密度分布 计算分子波函数、轨道 能量和电子密度分布

二、实验原理 1.从头算法 分子是一个多粒子体系,运动十分复杂。理论计算上无法准确求解其 薛定谔方程,需采用一些近似。 Born-Oppenheimeri近似:核运动与电子运动分开考虑; 两个 近似 单电子近似:认为每个电子都在各核和其他电子组成 的平均作用势场中独立地运动。 从头算法就是在这些近似的基础上,仅仅利用普朗克常数、电子质量 和电量三个基本物理常数及元素的原子序数,不借助于任何经验参数,计 算体系全部电子的分子积分,近似求解薛定谔方程。 从头算法:Hartree-Fock方法和密度泛函理论(DFT) 中网万油大学 HINA UNIVERSITY OF PETROLEDM
二、实验原理 1. 从头算法 分子是一个多粒子体系,运动十分复杂。理论计算上无法准确求解其 薛定谔方程,需采用一些近似。 从头算法就是在这些近似的基础上,仅仅利用普朗克常数、电子质量 和电量三个基本物理常数及元素的原子序数,不借助于任何经验参数,计 算体系全部电子的分子积分,近似求解薛定谔方程。 两个 近似 Born-Oppenheimer近似:核运动与电子运动分开考虑; 单电子近似:认为每个电子都在各核和其他电子组成 的平均作用势场中独立地运动。 从头算法:Hartree-Fock方法和密度泛函理论(DFT)

2.Hartree-Fock方法 ①Hartree-Fock方程 分子体系的哈密顿量为:H=H,+H2 单电子算符 +Σ-2 双电子算符 以羽 D.R.Hartree(1897-1958) V.Fock(1898-1974) 用ε表示单电子能量,p表示单电子的轨道波函数,则: 6,=(0,(0h川9,()+∑(2J,-K) Jw-oe1ak0o0-(oa之la2p0〉 令: F=h+∑(2J,-K) (Hartree-Fock哈密顿算符) 则: Fp,=8,0 (Hartree-Fock方程) 油大学 LA UNvERSITY OF PETROLEUM
2. Hartree-Fock方法 分子体系的哈密顿量为: H H H = +1 2 2 2 1 1 1 [ ] 2 n i i i i i Z H h r = = − + = 2 1 i j ij H r = 单电子算符 双电子算符 12 1 (1) (2) | | (2) j j j J r = 12 1 (1) (1) (2) | | (2) (1) Kj j j i j r = 用𝜀𝑖表示单电子能量,𝜑𝑖表示单电子的轨道波函数,则: (1) (1) | (1) (2 ) i i i ij ij j = + − h J K F i i i = (2 ) i j j j 令: F h J K = + − 则: (Hartree-Fock哈密顿算符) (Hartree-Fock方程) ①Hartree-Fock方程
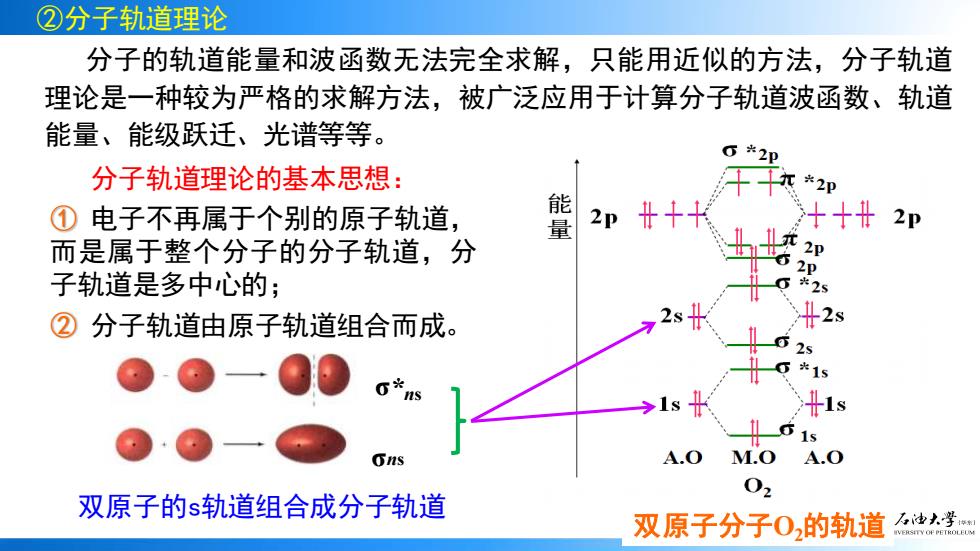
②分子轨道理论 分子的轨道能量和波函数无法完全求解,只能用近似的方法,分子轨道 理论是一种较为严格的求解方法,被广泛应用于计算分子轨道波函数、轨道 能量、能级跃迁、光谱等等。 *2p 分子轨道理论的基本思想: ①电子不再属于个别的原子轨道, 能 2p十 2p 而是属于整个分子的分子轨道,分 子轨道是多中心的; *25 ②分子轨道由原子轨道组合而成。 12 2 米15 G*ns 1 4.0 M.O A.0 02 双原子的s轨道组合成分子轨道 双原子分子02的轨道 油大学
分子的轨道能量和波函数无法完全求解,只能用近似的方法,分子轨道 理论是一种较为严格的求解方法,被广泛应用于计算分子轨道波函数、轨道 能量、能级跃迁、光谱等等。 分子轨道理论的基本思想: ① 电子不再属于个别的原子轨道, 而是属于整个分子的分子轨道,分 子轨道是多中心的; ② 分子轨道由原子轨道组合而成。 σ* ns σns 双原子的s轨道组合成分子轨道 ②分子轨道理论 双原子分子O2的轨道
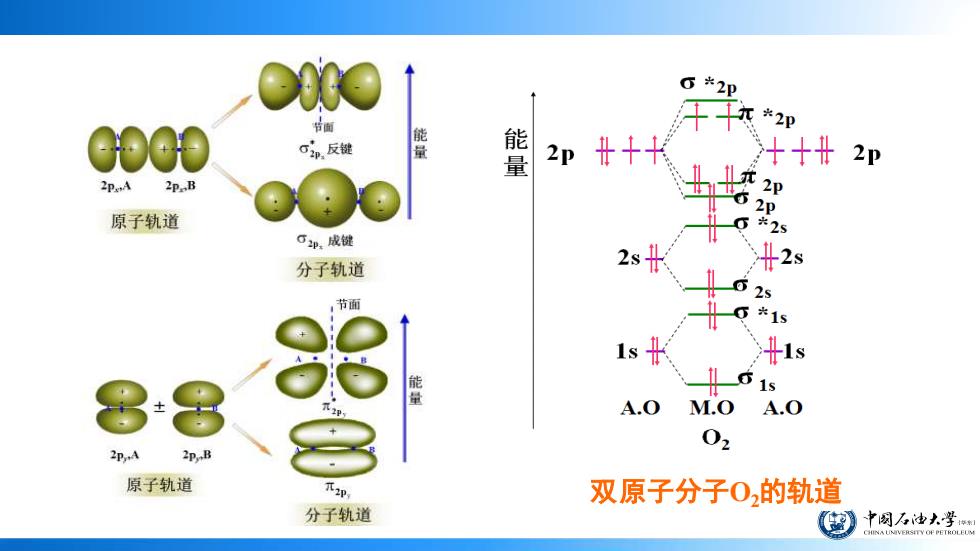
6*2p 节面 平*2 00 C单,反键 熊 2p + +2p 2P.B 2p 2p 原子轨道 25 口单,成键 分子轨道 2s 2s 节面 *15 1s 量 A.0 M.O A.0 02 2P.B 原子轨道 双原子分子02的轨道 分子轨道 中网万油大学 HINA UNIVERSITY OF PETROLEOM
双原子分子O2的轨道

02的分子轨道为: (1)(ais)(2s)(o2s)O2ps) 元2p 兀2p2 二氟二氯甲烷分子的轨道较多,加上电子排布后的轨道称为分子的电子组态: CF2C2分子的电子组态为: (core)26(1a)2(1b,)2(2a)2(1b2)月 inner valence (3a1)2(2b2)'(4a)(2b,)(1a2)2(5a)2(3b)(3b2)2(6a)2(46)2(2a2)(462)月 outer valence 中网万油大学 CHINA UNIVERSITY OF PETROLEDM
( )( )( )( )( ) ( ) 2 2 2 2 2 1 1 2 2 2 p x p z p y p z p y s s s s p x O2的分子轨道为: 二氟二氯甲烷分子的轨道较多,加上电子排布后的轨道称为分子的电子组态:

分子的单电子轨道波函数可写为原子轨道的线性组合: X是构成分子单电子轨道的原子轨道波函数,Cm是组合系数。 u=m(r,0,)=R(r)Ym(e.) 径向部分R可选择为高斯型基函数的形式: R(a,r)=cx"y"='exp(-ar2) 其中o是高斯指数,c是归一化常数。 中网方油大学 HINA UNIVERSITY OF PETROLEOM
分子的单电子轨道波函数可写为原子轨道的线性组合: m i i c = i c 是构成分子单电子轨道的原子轨道波函数, 是组合系数。 ( , , ) ( ) ( , ) nlm nl lm = = r R r Y 径向部分Rnl可选择为高斯型基函数的形式: 2 ( , ) c exp( ) n m l R r x y z r = − 其中是高斯指数,c是归一化常数

Ym(0,p)的形式 3 3 Y=P:= 2- 4元 4π Y=s= 3 3 sin 0cos= 3 3 P,=V4元 sin sin= 5 3z2- Y3=d:= (3cos20-1= V16π 15 y21 d.=\4 15x2 sin 0cosecos= 4 15 sin cossin= 152 15 sin'0sin 20= V16π 15 sin'0cos 26: 16 16元 中网万油大学 CHINA UNIVERSITY OF PETROLEDM
( , ) Ylm 的形式