
第19卷第1期 大学化学 2004年2月 师生笔谈 关于不对称合成反应中若干问题的讨论 陈平 (海南大学理工学院海口570228) 摘要在某些经验规则的基础上,从旋光特性守恒的角度归纳分析了立体化学反应中反应物 和生成物旋光特性的特点,并结合该特点的举例讨论了其应用,特别是在不对称合成中的应用。 立体化学反应涉及立体异构体的产生、转变和消失等情况较为复杂。在立体化学反应中 存在的一个特点是:在很多情况下,反应物与产物的旋光特性总体上是守恒的。此处所讲的 “旋光特性”指在旋光方面的表现,“旋光特性守恒”仅是指反应物和产物均有或均无旋光性 并未涉及旋光方向和旋光角发,同时也不涉及微观状态的守恒,而是描写反应始末状态的宏观 现象。下面试从几个方面进行讨论。 1无旋光性反应物和产物的旋光特性守恒 在非手性条件下,无旋光性的反应物生成无旋光性的产物。也就是说,由无旋光性的反应 物在非手性环境中反应,不经过拆分不可能得到具有旋光性的物质。具体有以下两种情况: (1)由非手性分子合成手性分子时产物是外消旋体(无旋光性)。例如 (1) 兼手性 外消旋体(无旋光性) OH Coo (CH-coom (2) 外消装体 CH CH H-C (3) CH 顺- 外养旋体 Br H-CCH, CH, HC-C H (4) 反 内消旋体 其中,丁烷、苯乙酮酸和顺2丁烯反应后均生成无旋光性的外消旋体(士,只有经过拆分才 51 1994-2008 China Academic Joumal Electronic Publishing House.All rights reserved.htp://www.enki.net
第 19 卷 第 1 期 大学化学 2004 年 2 月 师生笔谈 关于不对称合成反应中若干问题的讨论 陈 平 (海南大学理工学院 海口 570228) 摘要 在某些经验规则的基础上 ,从旋光特性守恒的角度归纳分析了立体化学反应中反应物 和生成物旋光特性的特点 ,并结合该特点的举例讨论了其应用 ,特别是在不对称合成中的应用。 立体化学反应涉及立体异构体的产生、转变和消失等 ,情况较为复杂。在立体化学反应中 存在的一个特点是 :在很多情况下 ,反应物与产物的旋光特性总体上是守恒的。此处所讲的 “旋光特性”指在旋光方面的表现 ,“旋光特性守恒”仅是指反应物和产物均有或均无旋光性 , 并未涉及旋光方向和旋光角度 ,同时也不涉及微观状态的守恒 ,而是描写反应始末状态的宏观 现象。下面试从几个方面进行讨论。 1 无旋光性反应物和产物的旋光特性守恒 在非手性条件下 ,无旋光性的反应物生成无旋光性的产物。也就是说 ,由无旋光性的反应 物在非手性环境中反应 ,不经过拆分不可能得到具有旋光性的物质。具体有以下两种情况 : (1) 由非手性分子合成手性分子时 ,产物是外消旋体(无旋光性) [1 ] 。例如 : 其中 ,丁烷、苯乙酮酸和顺222丁烯反应后均生成无旋光性的外消旋体( ±) ,只有经过拆分才 15

能得到有旋光性的右旋体和左旋体,而反2丁烯与溴加成则生成没有旋光性的内消旋体(m©0)。 (2)由非手性分子和外消旋体反应时产物仍然是外消旋体(无旋光)。 0 C- 一(±)RCH,0CCH,CH,C0OH (5) 外清装体 旋光性物质 外消旋体 这属于拆分既非酸又非碱的外消旋体时常用的方法之一。即在反应的醇分子中引入酸性 基团,然后按拆分酸的经典方法拆分(见式8)。 2有旋光性反应物和产物的旋光特性守恒 化合物的旋光性主要是由手性中心引起的,与手性中心直接相连的键(或基团)决定了其 构型及旋光性,这样,与手性中心相连的键是否断裂会直接影响产物的旋光性,从而影响反应 物和产物的旋光守恒。此处的反应物是广义的,也包括助剂、催化剂等。因此,下面先讨论与 手性中心相连的键不断裂的反应。 在不断裂与手性中心相连的键的反应中,有旋光性的反应物一般生成有旋光性的产物,且 该手性中心的构型保持不变)。 2.1手性分子与一般无旋光性物质的反应 例如 CH,H CH,H H (6) C.H, 含甲誉 Ⅱ2:甲烧 很明显,该反应断的是一根C①键,因为没有断裂与手性中心相连的键,所以构型保持 不变。而这类反应正是联系化合物构型的基础,即通过化学反应把其他旋光性化合物的构型 与甘油醛进行联系来确定,例如: (7) D(+-甘油醛 D.)甘油酸 GH。-十乳酸 该类反应的另一个应用是旋光纯化合物的比旋光度1,例如取代反应(式6)中,因未断裂 与手性中心相连的键,故每个具有构型I的醇分子转化成一个具有构型的氯化物分子;由于 醇是旋光纯的,比旋光度为+1.64°的氯化物也是旋光纯的。如果某一个氯化物试样的[]= +0.82°,即为最大值的50%,就可判断它为50%旋光纯。 假如把观察焦点放在无旋光性的反应物身上,则有」 还 非手性分子 手性分子 1994-2008 China Academic Journal Electronic Publishing House.All rights reserved.http://www.cnkine
能得到有旋光性的右旋体和左旋体 ,而反222丁烯与溴加成则生成没有旋光性的内消旋体(meso) 。 (2) 由非手性分子和外消旋体反应时 ,产物仍然是外消旋体(无旋光) 。 这属于拆分既非酸又非碱的外消旋体时常用的方法之一。即在反应的醇分子中引入酸性 基团 ,然后按拆分酸的经典方法拆分(见式 8) 。 2 有旋光性反应物和产物的旋光特性守恒 化合物的旋光性主要是由手性中心引起的 ,与手性中心直接相连的键(或基团) 决定了其 构型及旋光性 ,这样 ,与手性中心相连的键是否断裂会直接影响产物的旋光性 ,从而影响反应 物和产物的旋光守恒。此处的反应物是广义的 ,也包括助剂、催化剂等。因此 ,下面先讨论与 手性中心相连的键不断裂的反应。 在不断裂与手性中心相连的键的反应中 ,有旋光性的反应物一般生成有旋光性的产物 ,且 该手性中心的构型保持不变[2 ] 。 2. 1 手性分子与一般无旋光性物质的反应 例如 : 很明显 ,该反应断的是一根 C —O 键 ,因为没有断裂与手性中心相连的键 ,所以构型保持 不变。而这类反应正是联系化合物构型的基础 ,即通过化学反应把其他旋光性化合物的构型 与甘油醛进行联系来确定 ,例如 : H CHO OH CH2OH [O] H COOH OH CH2OH [ H] H COOH OH CH3 (7) D2( + )2甘油醛 D2( - )2甘油酸 D2( - )2乳酸 该类反应的另一个应用是旋光纯化合物的比旋光度[3 ] ,例如取代反应(式 6) 中 ,因未断裂 与手性中心相连的键 ,故每个具有构型 Ⅰ的醇分子转化成一个具有构型 Ⅱ的氯化物分子 ;由于 醇是旋光纯的 ,比旋光度为 + 1. 64°的氯化物也是旋光纯的。如果某一个氯化物试样的[α] = + 0. 82°,即为最大值的 50 % ,就可判断它为 50 %旋光纯。 假如把观察焦点放在无旋光性的反应物身上 ,则有 : θ C O COOH ( - )2薄荷醇 θ CCOO O 3 还原 非手性分子 手性分子 25
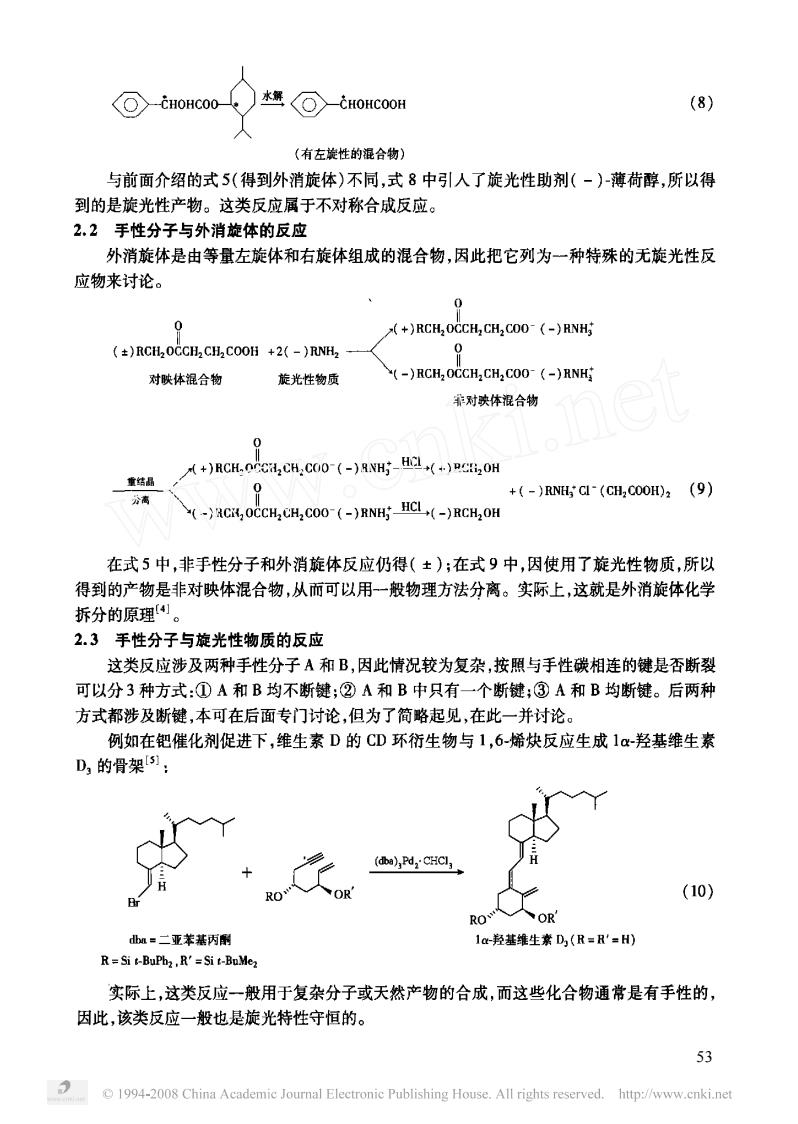
(⊙tH0Hc00 k⊙-HOHCOOH (8) (有左旋性的混合物)》 与前面介绍的式5(得到外消旋体)不同,式8中引人了旋光性助剂(-)薄荷醇,所以得 到的是旋光性产物。这类反应属于不对称合成反应。 2.2手性分子与外消旋体的反应 外消旋体是由等量左旋体和右旋体组成的混合物,因此把它列为一种特殊的无旋光性反 应物来讨论。 0 (+)RCH OCCHCHCOO-(-)RNH ()RCH2OCCH2 CH2COOH +(-)RNH 对联体混合物 旋光性物质 (-)RCH OCCH CH COO-(-)RNHi 养对映体混合物 +)RCH-0CHCH:CO0-(-)NHO +(-)RNCd(CH,000H2(9) (-RCROCCH CH2COO-(-)RNHHCL(-)RCH2OH 在式5中,非手性分子和外消旋体反应仍得(±);在式9中,因使用了旋光性物质,所以 得到的产物是非对映体混合物,从而可以用-一般物理方法分离。实际上,这就是外消旋体化学 拆分的原理 2.3手性分子与旋光性物质的反应 这类反应涉及两种手性分子A和B,因此情况较为复杂,按照与手性碳相连的键是否断裂 可以分3种方式:①A和B均不断键;②A和B中只有一个断键;③A和B均断键。后两种 方式都涉及断键,本可在后面专门讨论,但为了简略起见,在此一并讨论。 例如在钯催化剂促进下,维生素D的CD环衍生物与1,6-烯炔反应生成1α-羟基维生素 D的骨架: (), (10) a=二亚苯基丙 1-羟基维生素D(R=R'=H) R Si t-BuPbz,R'=Si t-BuMe 实际上,这类反应一般用于复杂分子或天然产物的合成,而这些化合物通常是有手性的 因此,该类反应一般也是旋光特性守恒的。 53 1994-2008 China Academic Joumal Electronie Publishing House.All rights reserved.http://www.enki.net
35
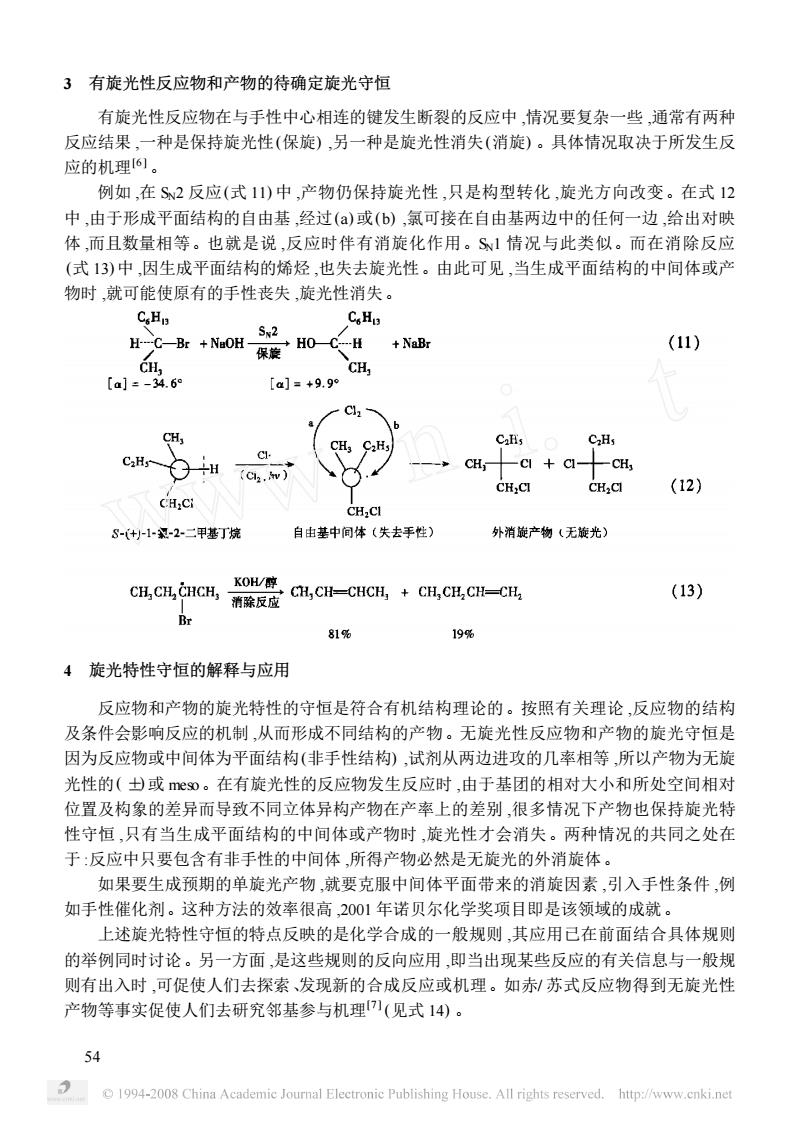
3有旋光性反应物和产物的待确定旋光守恒 有旋光性反应物在与手性中心相连的键发生断裂的反应中,情况要复杂一些,通常有两种 反应结果,一种是保持旋光性(保旋),另一种是旋光性消失(消旋)。具体情况取决于所发生反 应的机理6。 例如,在S2反应(式11)中,产物仍保持旋光性,只是构型转化,旋光方向改变。在式12 中,由于形成平面结构的自由基,经过()或(b),氯可接在自由基两边中的任何一边,给出对映 体,而且数量相等。也就是说,反应时伴有消旋化作用。S1情况与此类似。而在消除反应 (式13)中,因生成平面结构的烯烃,也失去旋光性。由此可见,当生成平面结构的中间体或产 物时,就可能使原有的手性丧失旋光性消失。 CH CoH H-C-Br +NuOH- 保旋H0一C CH +NaBr (11) CH. CH, 【aj=-34.60 【a]=+9.9 3 CaHs CH C+ CH, CH,CI (12) CH:Ci CH.CI 8-(+1-2二平基丁烧 自由基中同体(失去手性) 外消旋产物(无旋光) C.,c-cC.CC-c (13) Br 81% 19% 4旋光特性守恒的解释与应用 反应物和产物的旋光特性的守恒是符合有机结构理论的。按照有关理论,反应物的结构 及条件会影响反应的机制,从而形成不同结构的产物。无旋光性反应物和产物的旋光守恒是 因为反应物或中间体为平面结构(非手性结构),试剂从两边进攻的几率相等所以产物为无旋 光性的(士或meso。在有旋光性的反应物发生反应时,由于基团的相对大小和所处空间相对 位置及构象的差异而导致不同立体异构产物在产率上的差别,很多情况下产物也保持旋光特 性守恒,只有当生成平面结构的中间体或产物时,旋光性才会消失。两种情况的共同之处在 于:反应中只要包含有非手性的中间体,所得产物必然是无旋光的外消旋体。 如果要生成预期的单旋光产物,就要克服中间体平面带来的消旋因素,引入手性条件,例 如手性催化剂。这种方法的效率很高,2001年诺贝尔化学奖项目即是该领域的成就。 上述旋光特性守恒的特点反映的是化学合成的一般规则,其应用已在前面结合具体规则 的举例同时讨论。另一方面,是这些规则的反向应用,即当出现某些反应的有关信息与一般规 则有出入时,可促使人们去探索、发现新的合成反应或机理。如赤/苏式反应物得到无旋光性 产物等事实促使人们去研究邻基参与机理(见式14)。 54 1994-2008 China Academic Journal Electronic Publishing House.All rights reserved.http:/www.cnkinet
3 有旋光性反应物和产物的待确定旋光守恒 有旋光性反应物在与手性中心相连的键发生断裂的反应中 ,情况要复杂一些 ,通常有两种 反应结果 ,一种是保持旋光性(保旋) ,另一种是旋光性消失(消旋) 。具体情况取决于所发生反 应的机理[6 ] 。 例如 ,在 SN2 反应(式 11) 中 ,产物仍保持旋光性 ,只是构型转化 ,旋光方向改变。在式 12 中 ,由于形成平面结构的自由基 ,经过(a) 或(b) ,氯可接在自由基两边中的任何一边 ,给出对映 体 ,而且数量相等。也就是说 ,反应时伴有消旋化作用。SN1 情况与此类似。而在消除反应 (式 13) 中 ,因生成平面结构的烯烃 ,也失去旋光性。由此可见 ,当生成平面结构的中间体或产 物时 ,就可能使原有的手性丧失 ,旋光性消失。 4 旋光特性守恒的解释与应用 反应物和产物的旋光特性的守恒是符合有机结构理论的。按照有关理论 ,反应物的结构 及条件会影响反应的机制 ,从而形成不同结构的产物。无旋光性反应物和产物的旋光守恒是 因为反应物或中间体为平面结构(非手性结构) ,试剂从两边进攻的几率相等 ,所以产物为无旋 光性的( ±) 或 meso。在有旋光性的反应物发生反应时 ,由于基团的相对大小和所处空间相对 位置及构象的差异而导致不同立体异构产物在产率上的差别 ,很多情况下产物也保持旋光特 性守恒 ,只有当生成平面结构的中间体或产物时 ,旋光性才会消失。两种情况的共同之处在 于 :反应中只要包含有非手性的中间体 ,所得产物必然是无旋光的外消旋体。 如果要生成预期的单旋光产物 ,就要克服中间体平面带来的消旋因素 ,引入手性条件 ,例 如手性催化剂。这种方法的效率很高 ,2001 年诺贝尔化学奖项目即是该领域的成就。 上述旋光特性守恒的特点反映的是化学合成的一般规则 ,其应用已在前面结合具体规则 的举例同时讨论。另一方面 ,是这些规则的反向应用 ,即当出现某些反应的有关信息与一般规 则有出入时 ,可促使人们去探索、发现新的合成反应或机理。如赤/ 苏式反应物得到无旋光性 产物等事实促使人们去研究邻基参与机理[7 ] (见式 14) 。 45

(14 《+)-苏式 苯桥正离子(对称) 外消旋苏式 又如在不对称合成中,使用低光学纯度的物质作为手性助剂得到高光学纯度产物的现象 (手性放大),使人们进一步了解了对映体识别及相互作用机理s1(式15)。 H、OH PhCHO +EL.Zn 2%(-)-DAIB 甲苯,0℃ (-DAIB-NMe (15) OH 在 此外,上述规则与研究生物体的反应相结合,也可产生有益的结果。手性是生物体的基本 特征之一,与生命有关的许多分子都具有手性,其中包括蛋白质、多糖核酸和酶等。生物体中 的反应是由酶催化完成的,因此和一般的合成反应有不同之处,这方的研究,催生了不对称 催化合成、生物催化、生物反应器、仿生化学等成果。如单旋光异构体物正以每年10%以上 的速度增长,在农药、食品和材料等方面也将具有更广泛的应用。 参考文献 1张路.立体化学和有机足应历程概要北京:人民教育出版杜,983 4叶秀林,立体化学,北京:高等教育出版社,1983 5 Trost B M.Duman J ,Villa M.J Am Chem Soc.1992,114:9836 ,王积涛.高等有机化学.北京:人民教育出版社,1980 李越兰关烨第.大学化学,1997,120)22 王剑波.大学化学2000,15(4):6 (上接第27页) 极性,不仅巩固了所学的理论知识,而且提高了分析问题解决问题的能力。同学们普遍反映 以前是被老师“牵着走”、“抱着走”,现在才是自己走,觉得自己在搞科研,有一种继续研究下去 的愿望。抽样调查结果表明,绝大多数学生赞成这次改革,并给予高度的评价 参考文献 1王义道.实验室研究与探索,19%,172):1 2王义道实验室研究与探案1998173): 3余寿文实验室研究与探索,19%,17 4余寿文,实验室研究与深素,199%,17(5):9% 5王卫国.实验室研究与探索,1998,17(5):58 6陈宁,唐良宝,梁子志.实验室研究与探索,1998,175):63 55 1994-2008 China Academie Joural Electronie Publishing House.All rights reserved.http:/www.enki.net
又如在不对称合成中 ,使用低光学纯度的物质作为手性助剂得到高光学纯度产物的现象 (手性放大) ,使人们进一步了解了对映体识别及相互作用机理[8 ] (式 15) 。 此外 ,上述规则与研究生物体的反应相结合 ,也可产生有益的结果。手性是生物体的基本 特征之一 ,与生命有关的许多分子都具有手性 ,其中包括蛋白质、多糖、核酸和酶等。生物体中 的反应是由酶催化完成的 ,因此和一般的合成反应有不同之处。这方面的研究 ,催生了不对称 催化合成、生物催化、生物反应器、仿生化学等成果。如单旋光异构体药物正以每年 10 %以上 的速度增长[9 ] ,在农药、食品和材料等方面也将具有更广泛的应用。 参 考 文 献 1 张黯. 立体化学和有机反应历程概要. 北京 :人民教育出版社 ,1983 2 邢其毅 ,徐瑞秋 ,周政 ,等. 基础有机化学. 第 2 版. 北京 :高等教育出版社 ,1993 3 莫里森 R T ,博伊德 R N. 有机化学(上册) . 第 2 版. 复旦大学化学系有机化学教研室译. 北京 :科学出版社 ,1992 4 叶秀林. 立体化学. 北京 :高等教育出版社 ,1983 5 Trost B M ,Duman J ,Villa M. J Am Chem Soc ,1992 ,114 :9836 6 Kargan H. Organic Stereochemistry. London : Edward Arnold ,1979 7 王积涛. 高等有机化学. 北京 :人民教育出版社 ,1980 8 李越兰 ,关烨第. 大学化学 ,1997 ,12(1) :22 9 王剑波. 大学化学 ,2000 ,15(4) :6 (上接第 27 页) 极性 ,不仅巩固了所学的理论知识 ,而且提高了分析问题、解决问题的能力。同学们普遍反映 , 以前是被老师“牵着走”“、抱着走”,现在才是自己走 ,觉得自己在搞科研 ,有一种继续研究下去 的愿望。抽样调查结果表明 ,绝大多数学生赞成这次改革 ,并给予高度的评价。 参 考 文 献 1 王义道. 实验室研究与探索 ,1998 ,17(2) :1 2 王义道. 实验室研究与探索 ,1998 ,17(3) :1 3 余寿文. 实验室研究与探索 ,1998 ,17(4) :1 4 余寿文. 实验室研究与探索 ,1998 ,17(5) :96 5 王卫国. 实验室研究与探索 ,1998 ,17(5) :58 6 陈宁 ,唐良宝 ,梁子志. 实验室研究与探索 ,1998 ,17(5) :63 55