
第22卷第1期 大学化学 2007年2月 介绍 芳香性概念的新发展 严兢宋寅彭德高李珉 比京大学化学与分子工程学院2005级北京100871 摘要关于芳香性的定义一直是人们关注讨论的焦点。具有非传统芳香性的化合物层出不 穷,芳香性的概念也因此有了很大的发展。本文具体介绍了同芳香性、莫比乌斯体系的芳香性、C 以及三维结构中的芳香性、Y型芳香性等芳香性概念发展的前沿方向,并尝试对芳香性概念的最 新发展作简要讨论。 什么是芳香性?如此简单的一个问题却令人难以回答。先回顾一下芳香性这个概念的由 来:由于苯具有香味且最初是从苯甲酸脱羧制得,而苯甲酸是从天然安息香胶得到的,故出现 了芳香化合物这个名词口。随着人们对于芳香化合物认识的不断深入,芳香性一词的使用范 围日益扩大,从最初的苯系化合物扩充到非苯系化合物:由中性分子扩充到离子;由碳环化合 物扩充到含杂原子的环状有机物,乃至不含碳的无机环状化合物。而对于芳香性这个名词的 理解也逐步从化学性质转向物理性质,从朴素直观走向本质深入。然而,对于“什么是芳香 性这样一个基本问题至今还没有一个统一圆满的回答。本文重点就芳香性的一些最新发展 进行简要介绍,并对芳香性的定义作一些初步探讨。 表1列举了自休克尔规则提出以来比较重要的芳香性概念的发展方向)。 表1休克尔规则提出以来芳香性概念的发展历程 年代提出者 框念 年代提出者 概念 1938 EvansM G.WahurstE 芳香过渡态 1979 DewarM 0芳香性 1945 Calvin M,Wilson KW 金属化合物的芳香性 1979 SchleyerPvR 双芳香性、平面内芳香性 1959 W instein S 同芳性 1982 Jemmis ED.Schlever P y R4m+2间隙电子规则 莫比乌斯体系芳香性 1985 Shaik SS 苯中▣电子的键长交替效 1965 Breskw R 反芳香性 1985 Kp HW C的发现 1970 OsNa E 超芳香性(Co体系) 1991 lijma S 碳纳米管的发现 三线态芳香性 类环轮烯(trannulenes)) 1978 Ahara J 三推芳香性 2005 Schleyer P vR,TspisA C d轨道的芳香性 1芳香性概念的几个发展方向 L1同芳性(hom oa romatic it) 1959年,W instein提出同芳性的概念),用于解释某些共轭体系被打断但仍具有芳香性的 33 1994-2009 China Academic Joumal Electronic Publishing House.All rights reserved.http://www.enki.net
第 22卷 第 1期 大 学 化 学 2007年 2月 芳香性概念的新发展 严兢 宋寅 彭德高 李珉 (北京大学化学与分子工程学院 2005级 北京 100871) 摘要 关于芳香性的定义一直是人们关注讨论的焦点。具有非传统芳香性的化合物层出不 穷 ,芳香性的概念也因此有了很大的发展。本文具体介绍了同芳香性、莫比乌斯体系的芳香性、C60 以及三维结构中的芳香性、Y型芳香性等芳香性概念发展的前沿方向 ,并尝试对芳香性概念的最 新发展作简要讨论。 什么是芳香性 ? 如此简单的一个问题却令人难以回答。先回顾一下芳香性这个概念的由 来 :由于苯具有香味且最初是从苯甲酸脱羧制得 ,而苯甲酸是从天然安息香胶得到的 ,故出现 了芳香化合物这个名词 [ 1 ]。随着人们对于芳香化合物认识的不断深入 ,芳香性一词的使用范 围日益扩大 ,从最初的苯系化合物扩充到非苯系化合物 ;由中性分子扩充到离子 ;由碳环化合 物扩充到含杂原子的环状有机物 ,乃至不含碳的无机环状化合物。而对于芳香性这个名词的 理解也逐步从化学性质转向物理性质 ,从朴素直观走向本质深入。然而 ,对于“什么是芳香 性 ”这样一个基本问题至今还没有一个统一圆满的回答。本文重点就芳香性的一些最新发展 进行简要介绍 ,并对芳香性的定义作一些初步探讨。 表 1列举了自休克尔规则提出以来比较重要的芳香性概念的发展方向 [ 2 ]。 表 1 休克尔规则提出以来芳香性概念的发展历程 年代 提出者 概念 年代 提出者 概念 1938 EvansM G, Warhurst E 芳香过渡态 1979 DewarM σ芳香性 1945 Calvin M, W ilson KW 金属化合物的芳香性 1979 Schleyer P v R 双芳香性、平面内芳香性 1959 W instein S 同芳性 1982 Jemmis E D, Schleyer P v R 4n + 2间隙电子规则 1964 Heilbronner E 莫比乌斯体系芳香性 1985 Shaik S S 苯中σ电子的键长交替效应 1965 Breslow R 反芳香性 1985 Kroto H W C60的发现 1970 O sawa E 超芳香性 (C60体系 ) 1991 Iijima S 碳纳米管的发现 1972 Baird N C 三线态芳香性 1998 Schleyer P v R 类环轮烯 ( trannulenes) 1978 A ihara J 三维芳香性 2005 Schleyer P v R, Tsipis A C d轨道的芳香性 1 芳香性概念的几个发展方向 1. 1 同芳性 ( hom oaroma tic ity) 1959年 ,W instein提出同芳性的概念 [ 3 ] ,用于解释某些共轭体系被打断但仍具有芳香性的 33

化合物的性质。同芳性概念的引入首先可以从同共轭或匀共轭(homocon jugation)谈起。在1, 4戊二烯及类似体系中,原有的单双键交替的共轭被一个插入的饱和基团(一般是CH)打断 但仍可以发现双键之间有相互作用,被称为空间匀共轭。由此可以推想,当一个芳香体系被其 他基团阻断后,其电子之间应仍有相互作用。或者说,当环状体系不相邻的C上的p轨道 有部分重叠且总电子数为4m+2时就会呈现出芳香特性,称为同芳性。体系中跳跃一次插 入基团称为单同芳,依此类推,体系中跳跃两次或三次插入基团称为双同芳或三同芳。 同芳性会使相应化合物产生类似芳香性的特征,如键长平均化,π轨道的有效重叠,电荷 的分散,键级的变化等。磁学性质也是判别同芳性的一个方法:同芳性化合物具有类似于芳香 化合物的磁学性质,如”C谱中C化学位移的平均化,抗磁环流,以及环内环外H原子化学位 移的差别等。另外,同芳性也会对化合物起到一定的稳定作用。 下面分3类情况具体介绍同芳性的化合物 ①对于同芳性最早的讨论均集中于正离子上。其中正离子1是研究最彻底的一个,也比 其他同芳性离子稳定得多。单同环丙烯碳正离子是最简单的同芳性化合物,比平面的环丁稀 碳正离子稳定。计算表明,如图1所示的平衡,单同环丙烯碳正离子有两种等同的构型,而翻 转的势垒高达335mo1势能最高点所对应的中间体即为相对不稳定的平面型结构),充分 说明了其同芳性的存在1。类似的,环戊烯碳正离子的最稳定构型也是折叠式的结构2,属于 双同芳性体系,其二面角约等于90。将C,和C,用(CH2)连接起米,可提供有利的空间构型 相应化合物己在实验中制备成功。 图1单同环丙烯碳正离子的两种构象的平衡 分子3是第一个研究得比较彻底的三同芳性离子。实验与理论计算数据均表明3具有很 好的同芳性,键长1(C,C)=1(C,C)=1(CC,)=182A正电荷均匀地分布在3个碳 原子上。 2 同芳性概念的产生引发人们设计和合成一些非常有趣的分子,如化合物4的形状类似三 明治,而且拥有两种同芳性构型即4和5,计算证明该离子以结构4为主)。最近还有人制备 了宝塔形双正离子6以及类似的化合物,结果表明空间有利因素促进了同芳性的产生。 同芳性的概念还不局限于仅由C组成的体系,如化合物7是四氧化物8在电化学氧化过 程中的一个中间体,其结构与宝塔形分子有异曲同工之处。而化合物9则因同芳性的存在而 产生了较大的偶极距。结构10有一个四面体型的同芳结构,比结构11稳定197Jmol。Chan 和A mold等人还提出下一个类似的芳香化合物应具有8个电子,而不是休克尔规则预言的6 个,因为在这样。对称性的体系中的UMO是三重简并的 34 1994-2009 China Academic Joumal Electronic Publishing House.All rights reserved.http://www.cnki.net
化合物的性质。同芳性概念的引入首先可以从同共轭或匀共轭 ( homoconjugation)谈起。在 1, 42戊二烯及类似体系中 ,原有的单双键交替的共轭被一个插入的饱和基团 (一般是 CH2 )打断 , 但仍可以发现双键之间有相互作用 ,被称为空间匀共轭。由此可以推想 ,当一个芳香体系被其 他基团阻断后 ,其 π电子之间应仍有相互作用。或者说 ,当环状体系不相邻的 C上的 p轨道 有部分重叠且总电子数为 4n + 2时就会呈现出芳香特性 ,称为同芳性 [ 4 ]。体系中跳跃一次插 入基团称为单同芳 ,依此类推 ,体系中跳跃两次或三次插入基团称为双同芳或三同芳。 同芳性会使相应化合物产生类似芳香性的特征 ,如键长平均化 ,π轨道的有效重叠 ,电荷 的分散 ,键级的变化等。磁学性质也是判别同芳性的一个方法 :同芳性化合物具有类似于芳香 化合物的磁学性质 ,如 13 C谱中 C化学位移的平均化 ,抗磁环流 ,以及环内环外 H原子化学位 移的差别等。另外 ,同芳性也会对化合物起到一定的稳定作用。 下面分 3类情况具体介绍同芳性的化合物。 ①对于同芳性最早的讨论均集中于正离子上。其中正离子 1是研究最彻底的一个 ,也比 其他同芳性离子稳定得多。单同环丙烯碳正离子是最简单的同芳性化合物 ,比平面的环丁烯 碳正离子稳定。计算表明 ,如图 1所示的平衡 ,单同环丙烯碳正离子有两种等同的构型 ,而翻 转的势垒高达 33. 5kJ /mol(势能最高点所对应的中间体即为相对不稳定的平面型结构 ) ,充分 说明了其同芳性的存在 [ 5 ]。类似的 ,环戊烯碳正离子的最稳定构型也是折叠式的结构 2,属于 双同芳性体系 ,其二面角约等于 90 o。将 C3和 C5用 (CH2 ) n连接起来 ,可提供有利的空间构型 , 相应化合物已在实验中制备成功。 图 1 单同环丙烯碳正离子的两种构象的平衡 分子 3是第一个研究得比较彻底的三同芳性离子。实验与理论计算数据均表明 3具有很 好的同芳性 ,键长 l(C1 —C3 ) = l(C1 —C5 ) = l(C3 —C5 ) = 1. 82! ,正电荷均匀地分布在 3个碳 原子上。 同芳性概念的产生引发人们设计和合成一些非常有趣的分子 ,如化合物 4的形状类似三 明治 ,而且拥有两种同芳性构型 (即 4和 5,计算证明该离子以结构 4为主 )。最近还有人制备 了宝塔形双正离子 6以及类似的化合物 ,结果表明空间有利因素促进了同芳性的产生。 同芳性的概念还不局限于仅由 C组成的体系 ,如化合物 7是四氧化物 8在电化学氧化过 程中的一个中间体 ,其结构与宝塔形分子有异曲同工之处。而化合物 9则因同芳性的存在而 产生了较大的偶极距。结构 10有一个四面体型的同芳结构 ,比结构 11稳定 197kJ /mol。Chan 和 A rnold等人还提出下一个类似的芳香化合物应具有 8个电子 ,而不是休克尔规则预言的 6 个 ,因为在这样 Td 对称性的体系中的 LUMO是三重简并的。 34

9$ 鑫 ②关于是否存在中性同芳性化合物一直是一个存在争议的问题。Childs等人提出一些 可能具有同芳性的中性化合物,如12(单同环丙烯碳正离子的等电子体)、13、14以及一些带 有桥键的大环轮烯(如15)和带有桥键的富勒烯16。 12 13 14 15 6 化合物17曾被认为是同芳性的一个很好例子,但计算和实验数据均表明它并不具有芳香 性(构型上的不利使得其π轨道之间不能有效重合)。因此,引入有利的构型因素使三根双键 靠得更近如18)则可能产生同芳性。此类体系还有可能存在于烯烃或炔烃的金属配合物( 过渡态)中。而类似的,许多带B原子的化合物被证明是有同芳性的,如化合物19。 ③关于阴离子同芳性化合物的讨论不多,主要集中在结构20以及一些含B体系上,如 21,其中,将20的C负离子换成NH、PH或O、S,则可得到一系列中性同芳性化合物。此外有 些研究者还发现双环[3,2,2]壬三烯负离子22中也存在芳香性。可以认为22中存在两个类 似于20的同芳体系,并可能存在两个等同的互变结构。 ④过故 1。 2 12莫比乌斯芳香性 莫比乌斯芳香性这个概念来源于拓扑学中的莫比乌斯带。最早涉及莫比乌斯带的化学研 究是在电子波函数领域以及如何把180的扭转引入到闭环的原子轨道基函数(arm ic orbital basis functions)中。1959年,Cag提出了一个p轨道和d轨道交互出现的模型(图2),相翻转 出现在黑点处,AB循环重复出现。 35 ishing House.All rights reserved. httn://www.enki.ne
②关于是否存在中性同芳性化合物一直是一个存在争议的问题。Childs等人提出一些 可能具有同芳性的中性化合物 ,如 12 (单同环丙烯碳正离子的等电子体 )、13、14以及一些带 有桥键的大环轮烯 (如 15)和带有桥键的富勒烯 16。 化合物 17曾被认为是同芳性的一个很好例子 ,但计算和实验数据均表明它并不具有芳香 性 (构型上的不利使得其 π轨道之间不能有效重合 )。因此 ,引入有利的构型因素使三根双键 靠得更近 (如 18)则可能产生同芳性。此类体系还有可能存在于烯烃或炔烃的金属配合物 (或 过渡态 )中。而类似的 ,许多带 B原子的化合物被证明是有同芳性的 ,如化合物 19。 ③关于阴离子同芳性化合物的讨论不多 ,主要集中在结构 20以及一些含 B体系上 ,如 21,其中 ,将 20的 C负离子换成 NH、PH或 O、S,则可得到一系列中性同芳性化合物。此外有 些研究者还发现双环 [ 3, 2, 2 ] 2壬三烯负离子 22中也存在芳香性。可以认为 22中存在两个类 似于 20的同芳体系 ,并可能存在两个等同的互变结构。 1. 2 莫比乌斯芳香性 莫比乌斯芳香性这个概念来源于拓扑学中的莫比乌斯带。最早涉及莫比乌斯带的化学研 究是在电子波函数领域以及如何把 180°的扭转引入到闭环的原子轨道基函数 ( atom ic orbital basis functions)中。1959年 , Craig提出了一个 p轨道和 d轨道交互出现的模型 (图 2) ,相翻转 出现在黑点处 ,AB循环重复出现。 35

00 图2Cne提出的p轨道和d轨道交互出现模型 1964,Heilbonne在研究电子莫比乌斯带时,把Cag模型中的d轨道换成了p轨道,从而 形成了一个扭曲的环状莫比乌斯带(图3)。同时他用HuckelMO法证明了具有这种莫比乌斯 带的体系在填充4个电子时最稳定(卿莫比乌斯芳香性),又进一步从理论上预测了一些具 有莫比乌斯芳香性的环状共轭碳环化合物,并且证明了它们的稳定性。 00 图3 He ilbronner提出的环状莫比乌斯带 自莫比乌斯芳香性概念提出之后,化学家付出了很大努力寻找和设计合成具有莫比乌斯 形态的化合物。然而由于巨大的扭曲张力使之在能量上相当不利,大部分工作基本上仅停留 在理论层次。首先获得成功的是Zmmemann等人将此概念应用于周环反应,提出了芳香过 渡态理论。1993年,Jao和Schleyer首次精确计算了一些周环反应中的过渡态,理论上证明了 其芳香性。 对于稳定的莫比乌斯化合物的研究也在不断深入。一种方法是引入一个180的相翻转 且使相翻转尽可能地分散于整个大环体系中。其中,具有8电子的正离子23尤其引起化学家 的兴趣。第二种方法是在环上引入一个丙二烯单元,并加以适当环张力使C一C一C结构中 的两个π轨道有重叠(24)。改变丙二烯单元的数量还可进一步增加体系的相翻转点。 还有一种方法是根据Cg的模型,在一个原子或环上一点处引入相翻转。化合物25是 对此模型的一种模拟,如26所示,两个锂原子的两个空的p轨道完成了环的闭合,然而理论计 算及键长的交替变化表明其并未达到预期效果。P,S等第三周期原子的空轨道让人们自然 27=N.P) 2 30 194-00 China Publishing House.All rights reserved.hip://www
图 2 Cra ig提出的 p轨道和 d轨道交互出现模型 1964, Heilbronner在研究电子莫比乌斯带时 ,把 Craig模型中的 d轨道换成了 p轨道 ,从而 形成了一个扭曲的环状莫比乌斯带 (图 3)。同时他用 HückelMO法证明了具有这种莫比乌斯 带的体系在填充 4n个电子时最稳定 (即莫比乌斯芳香性 ) ,又进一步从理论上预测了一些具 有莫比乌斯芳香性的环状共轭碳环化合物 ,并且证明了它们的稳定性。 图 3 He ilbronner提出的环状莫比乌斯带 自莫比乌斯芳香性概念提出之后 ,化学家付出了很大努力寻找和设计合成具有莫比乌斯 形态的化合物。然而由于巨大的扭曲张力使之在能量上相当不利 ,大部分工作基本上仅停留 在理论层次。首先获得成功的是 Zimmermann等人将此概念应用于周环反应 ,提出了芳香过 渡态理论。1993年 , Jiao和 Schleyer首次精确计算了一些周环反应中的过渡态 ,理论上证明了 其芳香性。 对于稳定的莫比乌斯化合物的研究也在不断深入。一种方法是引入一个 180°的相翻转 且使相翻转尽可能地分散于整个大环体系中。其中 ,具有 8电子的正离子 23尤其引起化学家 的兴趣。第二种方法是在环上引入一个丙二烯单元 ,并加以适当环张力使 C C C 结构中 的两个 π轨道有重叠 (24)。改变丙二烯单元的数量还可进一步增加体系的相翻转点。 还有一种方法是根据 Craig的模型 ,在一个原子或环上一点处引入相翻转。化合物 25是 对此模型的一种模拟 ,如 26所示 ,两个锂原子的两个空的 p轨道完成了环的闭合 ,然而理论计 算及键长的交替变化表明其并未达到预期效果。P, S等第三周期原子的空 d轨道让人们自然 36
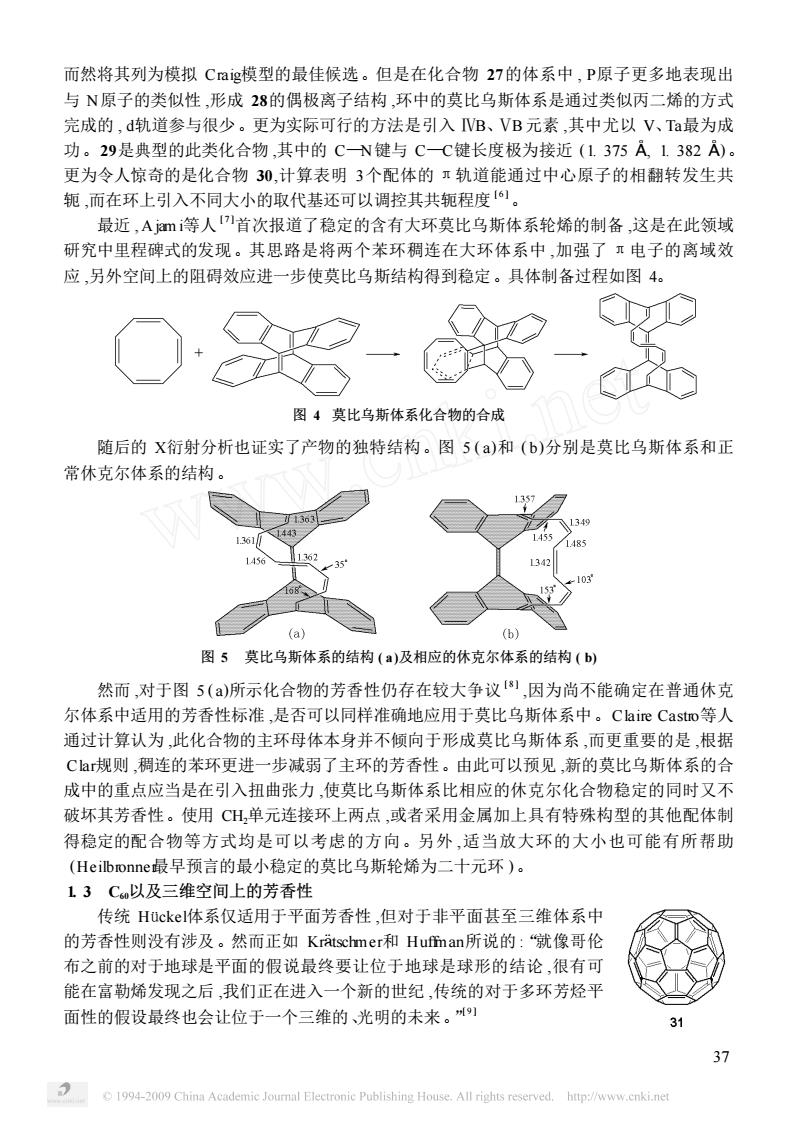
而然将其列为模拟Cag模型的最佳候选。但是在化合物27的体系中,P原子更多地表现出 与N原子的类似性,形成28的偶极离子结构,环中的莫比乌斯体系是通过类似丙二烯的方式 完成的,d轨道参与很少。更为实际可行的方法是引入VB、VB元素,其中尤以V、Ta最为成 功。29是典型的此类化合物,其中的CN键与CC键长度极为接近(1375A1382A) 更为令人惊奇的是化合物30,计算表明3个配体的π轨道能通过中心原子的相翻转发生共 轭,而在环上引入不同大小的取代基还可以调控其共轭程度。 最近,Ajm等人首次报道了稳定的含有大环莫比乌斯体系轮烯的制备,这是在此领域 研究中里程碑式的发现。其思路是将两个苯环稠连在大环体系中,加强了·电子的离域效 应,另外空间上的阻碍效应进一步使莫比乌斯结构得到稳定。具体制备过程如图4。 - 图4莫比乌斯体系化合物的合成 随后的X衍射分析也证实了产物的独特结构。图5()和(b)分别是莫比乌斯体系和正 常休克尔体系的结构。 a) (b1 图5莫比乌斯体系的结构(a)及相应的休克尔体系的结构(b) 然而,对于图5()所示化合物的芳香性仍存在较大争议,因为尚不能确定在普通休克 尔体系中适用的芳香性标准,是否可以同样准确地应用于莫比乌斯体系中。Claire Castro等人 通过计算认为,此化合物的主环母体本身并不倾向于形成莫比乌斯体系,而更重要的是,根据 Ca规则,稠连的苯环更进一步减弱了主环的芳香性。由此可以预见,新的莫比乌斯体系的合 成中的重点应当是在引入扭曲张力,使莫比乌斯体系比相应的休克尔化合物稳定的同时又不 破坏其芳香性。使用CH,单元连接环上两点,或者采用金属加上具有特殊构型的其他配体制 得稳定的配合物等方式均是可以考虑的方向。另外,适当放大环的大小也可能有所帮助 (Heilbronner最早预言的最小稳定的莫比乌斯轮烯为二十元环)。 L13C以及三维空间上的芳香性 传统Huckel体系仅适用于平面芳香性,但对于非平面甚至三维体系中 的芳香性则没有涉及。然而正如Kratschmer和Hufman所说的:“就像哥伦 布之前的对于地球是平面的假说最终要让位于地球是球形的结论,很有可 能在富勒烯发现之后,我们正在进入一个新的世纪,传统的对于多环芳烃平 面性的假设最终也会让位于一个三维的、光明的未来。州 http://www.cnki.ne
而然将其列为模拟 Craig模型的最佳候选。但是在化合物 27的体系中 , P原子更多地表现出 与 N原子的类似性 ,形成 28的偶极离子结构 ,环中的莫比乌斯体系是通过类似丙二烯的方式 完成的 , d轨道参与很少。更为实际可行的方法是引入 ⅣB、ⅤB元素 ,其中尤以 V、Ta最为成 功。29是典型的此类化合物 ,其中的 C—N键与 C—C键长度极为接近 (1. 375 ! , 1. 382 ! )。 更为令人惊奇的是化合物 30,计算表明 3个配体的 π轨道能通过中心原子的相翻转发生共 轭 ,而在环上引入不同大小的取代基还可以调控其共轭程度 [ 6 ]。 最近 , A jam i等人 [ 7 ]首次报道了稳定的含有大环莫比乌斯体系轮烯的制备 ,这是在此领域 研究中里程碑式的发现。其思路是将两个苯环稠连在大环体系中 ,加强了 π电子的离域效 应 ,另外空间上的阻碍效应进一步使莫比乌斯结构得到稳定。具体制备过程如图 4。 图 4 莫比乌斯体系化合物的合成 随后的 X衍射分析也证实了产物的独特结构。图 5 ( a)和 ( b)分别是莫比乌斯体系和正 常休克尔体系的结构。 图 5 莫比乌斯体系的结构 ( a)及相应的休克尔体系的结构 ( b) 然而 ,对于图 5 ( a)所示化合物的芳香性仍存在较大争议 [ 8 ] ,因为尚不能确定在普通休克 尔体系中适用的芳香性标准 ,是否可以同样准确地应用于莫比乌斯体系中。Claire Castro等人 通过计算认为 ,此化合物的主环母体本身并不倾向于形成莫比乌斯体系 ,而更重要的是 ,根据 Clar规则 ,稠连的苯环更进一步减弱了主环的芳香性。由此可以预见 ,新的莫比乌斯体系的合 成中的重点应当是在引入扭曲张力 ,使莫比乌斯体系比相应的休克尔化合物稳定的同时又不 破坏其芳香性。使用 CH2单元连接环上两点 ,或者采用金属加上具有特殊构型的其他配体制 得稳定的配合物等方式均是可以考虑的方向。另外 ,适当放大环的大小也可能有所帮助 (Heilbronner最早预言的最小稳定的莫比乌斯轮烯为二十元环 )。 1. 3 C60以及三维空间上的芳香性 传统 Hückel体系仅适用于平面芳香性 ,但对于非平面甚至三维体系中 的芳香性则没有涉及。然而正如 Kr¾tschmer和 Huffman所说的 :“就像哥伦 布之前的对于地球是平面的假说最终要让位于地球是球形的结论 ,很有可 能在富勒烯发现之后 ,我们正在进入一个新的世纪 ,传统的对于多环芳烃平 面性的假设最终也会让位于一个三维的、光明的未来。” [ 9 ] 37

当C0(31)于1985年第一次被合成时),Ko0就提出这个分子是第一个球芳香性 (Spherical A romaticity)分子。关于Co的各种特殊性质己有诸多研究,这里仅讨论与其芳香性 有关的一些问题 考察C的分子轨道:每个C有4个价电子,其中3个构成·骨架,剩余1个形成离域π 键。十二面体对称的Co的r键体系可以近似地被描述为球形电子气(spherical electon 盟s)。π键的波函数表达式为平(x0,中)=R()·⊙)中仲)。 对于球形体系,可以认为不变所以波函数的性质由⊙)·中仲)决定。由⊙)导出 的角量子数1(L=0,1,2,3,…)代表Ψ的角节面数;由中仲)导出的磁量子数MM=·L. 1-L,2-L,…0.…L)代表波函数与参考方向G通常是轴)的倾斜程度1。每个L有 2L+1个M值与之对应。C分子轨道图形如图6,分子的π电子排布见图7。类似于多电子 原子轨道,因为存在能级分裂,L相同M不同时的能量并不完全相同。 @-) 9般 1=0s) 28 2.000 6O0 h。 1-1(p) 搬 SC○●Q● 1 -2d 606 0 二二二 8.18 1=30 6⊙00 扑井+## -0.618 30 -184:#+#卡t+++-1.000 806@ -1.562 -1.820 1=4g -2 9③C83 -2.303 1=4(g) 井井朴 图6C的分子轨道图形 图7C分子的分子轨道图 我们可以看到,在富勒烯大键体系中,当体系含有2(W+1)(W=0,1,2,3)个电 子时,最外层电子全部充满而最为稳定这种稳定性类似于稀有气体电子构型的稳定性,可将 其作为三维体系中的芳香性标准。这个规则最先由Hirsch于2000年提出。根据这个排布规 则,π电子数为2,8,18,32,50,72,98…时最外电子壳层全充满而显芳香性。从这个规则来 看,含有60个电子的C只显示弱的芳香性,而相对不稳定的物种C,C,C,C8则被预 言具有强芳香性。实际上,芳香性只是一种稳定因素,在三维体系中,巨大的张力使符合“分 割五边形规则的分子具有更高的稳定性,而C正是符合此规则的最小富勒烯分子。 由于富勒烯分子没有可取代的氢,所以它不能通过取代反应来表现它的芳香性,而且由于 富勒烯的特殊结构,任何化学反应都会使它原有的电子结构发生较大的变化。因而化学反应 方面的判据在富勒烯面前显得无能为力。但由于富勒烯分子空腔的存在,使现在判别芳香性 38 1994-2009 China Academic Joumal Electronic Publishing House.All rights reserved.http://www.cnki.net
当 C60 (31 )于 1985 年第一次被合成时 [ 10 ] , Kroto就提出这个分子是第一个球芳香性 (Spherical A romaticity)分子。关于 C60的各种特殊性质已有诸多研究 ,这里仅讨论与其芳香性 有关的一些问题。 考察 C60的分子轨道 :每个 C有 4个价电子 ,其中 3个构成 σ骨架 ,剩余 1个形成离域 π 键。十二面体对称的 C60的 π键体系可以近似地被描述为球形电子气 ( spherical electron gas) [ 11 ]。π键的波函数表达式为 Ψ ( r,θ,φ) = R ( r) ·Θ (θ) ·Φ (φ) 。 对于球形体系 , r可以认为不变 ,所以波函数的性质由 Θ (θ) ·Φ (φ)决定。由 Θ (θ)导出 的角量子数 L (L = 0, 1, 2, 3, ……)代表Ψ的角节面数 ;由Φ (φ)导出的磁量子数 M (M = - L, 1 - L, 2 - L, ……, 0, ……, L )代表波函数与参考方向 (通常是 z轴 )的倾斜程度 [ 12 ]。每个 L 有 2L + 1个 M 值与之对应。C60分子轨道图形如图 6,分子的 π电子排布见图 7。类似于多电子 原子轨道 ,因为存在能级分裂 , L相同 M 不同时的能量并不完全相同。 图 6 C60的分子轨道图形 图 7 C60分子的分子轨道图 我们可以看到 ,在富勒烯大π键体系中 ,当体系含有 2 (N + 1) 2 (N = 0, 1, 2, 3……)个π电 子时 ,最外层电子全部充满而最为稳定 ,这种稳定性类似于稀有气体电子构型的稳定性 ,可将 其作为三维体系中的芳香性标准。这个规则最先由 H irsch于 2000年提出。根据这个排布规 则 ,π电子数为 2, 8, 18, 32, 50, 72, 98……时最外电子壳层全充满而显芳香性。从这个规则来 看 ,含有 60个 π电子的 C60只显示弱的芳香性 ,而相对不稳定的物种 C 2 + 20 , C32 , C50 , C 10 + 60 则被预 言具有强芳香性。实际上 ,芳香性只是一种稳定因素 ,在三维体系中 ,巨大的张力使符合“分 割五边形规则 ”的分子具有更高的稳定性 ,而 C60正是符合此规则的最小富勒烯分子。 由于富勒烯分子没有可取代的氢 ,所以它不能通过取代反应来表现它的芳香性 ,而且由于 富勒烯的特殊结构 ,任何化学反应都会使它原有的电子结构发生较大的变化。因而化学反应 方面的判据在富勒烯面前显得无能为力。但由于富勒烯分子空腔的存在 ,使现在判别芳香性 38

常用的NCS值(nucleus-independent chem ical shift)格外有用,相应的实际存在的化合物(何以 将一些小分子或原子引入富勒烯的空腔中心,探测富勒烯的Ⅱ电子体系的磁学性质)也仅适 用于富勒烯。相关的计算结果表明,一般富勒烯都具有芳香性,但强弱相差很远,芳香性特别 强的物种的电子数遵循2W+1)规则,也就佐证了2(N+1)规则的正确性 14Y芳香性 1972年Gud提出某些Y型化合物有特殊的稳定性,例如:三亚甲基甲烷(TMM)的二价 正离子(32)、负离子(33)、胍阳离子(34)等1优其是胍阳离子)相当稳定,并且在化学性质 上类似于苯,倾向于取代反应,其特殊稳定性可体现在肌的强碱性上(K=·2,与氢氧化钠 相当)。于是Gud首次突破了芳香体系环状结构的界限,提出了Y芳香性这一概念。 9HN、 NH: 32 33 在过去30多年里,关于Y芳香性的存在一直有着较大的争议。其争论焦点主要涉及两 个问题 (1)Y型电子离域是否对稳定性有一定贡献? (2)这样的稳定性是否能被称为芳香性? 第一个问题的答案是肯定的。Y型化合物的Ⅱ电子的 离域不是通过周边而是通过中心实现的。在胍正离子的能 量等高线图8)可以看到,胍正离子的能量分配非常平均」 同时从分子轨道能级图上看,胍的能级图与苯很相似。更重 图8胍正离子的能量等高线图 要的是,胍正离子确实具有抗磁环流。而实验也表明,胍正 离子要比想象中稳定得多。而且不止是胍正离子,三亚甲基甲烷的二正离子和二负离子也被 证实由于Y型电子离域的作用,要比它们的同分异构体丁二烯的二价正、负离子稳定。另 外,若在周边3个C或N原子上引入双键或苯环,则可能进一步扩大共轭体系,分散电荷】 关于第二个问题的争议则较大,因其本质涉及芳香性概念的定义 “个本身就争议不 断的话题。 2关于芳香性概念的探讨 从上面的讨论中可以看出,芳香性概念的应用范围在不断扩大,其内涵也在不断地发展 以适应并包容和解释新产生的化合物。然而,对于芳香性这个基本概念,人们目前却仍没有透 彻的了解。传统的休克尔规则已不能解释不断涌现的新的芳香化合物。对于芳香性的认识现 在主要可以分为4个不同角度。 (1)从能量上考虑。芳香体系的化合物具有额外的由电子离域产生的稳定化作用。但参 比物质的选取是一个非常困难的问题要想排除普通共轭产生的稳定化作用以及分子几何构 型上的差别产生的能量差异对计算结果的影响是十分困难的。 (2)从几何构型的角度。传统的芳香性总是与键长的平均化以及分子的平面结构联系在 一起,然而在许多新发现的芳香化合物中,芳香性对于平面扭曲的容忍度似乎相当大。而且, 键长趋于平均化并非芳香性化合物特有的性质。最新研究表明,在许多非芳香性分子中(如 39 C1994-2009 China Academic lournal Electronic Publishing House.All rights reserved.http://www.cnki.ne
常用的 N ICS值 ( nucleus2independent chem ical shift)格外有用 ,相应的实际存在的化合物 (可以 将一些小分子或原子引入富勒烯的空腔中心 ,探测富勒烯的 π电子体系的磁学性质 )也仅适 用于富勒烯。相关的计算结果表明 ,一般富勒烯都具有芳香性 ,但强弱相差很远 ,芳香性特别 强的物种的电子数遵循 2 (N + 1) 2规则 ,也就佐证了 2 (N + 1) 2规则的正确性。 1. 4 Y 2芳香性 1972年 Gund提出某些 Y型化合物有特殊的稳定性 ,例如 :三亚甲基甲烷 ( TMM )的二价 正离子 (32)、负离子 (33)、胍阳离子 (34)等 [ 13 ] (尤其是胍阳离子 )相当稳定 ,并且在化学性质 上类似于苯 ,倾向于取代反应 ,其特殊稳定性可体现在胍的强碱性上 (pKb = - 2,与氢氧化钠 相当 )。于是 Gund首次突破了芳香体系环状结构的界限 ,提出了 Y芳香性这一概念。 在过去 30多年里 ,关于 Y2芳香性的存在一直有着较大的争议。其争论焦点主要涉及两 个问题 : 图 8 胍正离子的能量等高线图 (1) Y型电子离域是否对稳定性有一定贡献 ? (2) 这样的稳定性是否能被称为芳香性 ? 第一个问题的答案是肯定的。Y型化合物的 π电子的 离域不是通过周边而是通过中心实现的。在胍正离子的能 量等高线 (图 8)可以看到 ,胍正离子的能量分配非常平均 , 同时从分子轨道能级图上看 ,胍的能级图与苯很相似。更重 要的是 ,胍正离子确实具有抗磁环流。而实验也表明 ,胍正 离子要比想象中稳定得多。而且不止是胍正离子 ,三亚甲基甲烷的二正离子和二负离子也被 证实由于 Y型电子离域的作用 ,要比它们的同分异构体丁二烯的二价正、负离子稳定 [ 14 ]。另 外 ,若在周边 3个 C或 N原子上引入双键或苯环 ,则可能进一步扩大共轭体系 ,分散电荷。 关于第二个问题的争议则较大 ,因其本质涉及芳香性概念的定义 ———一个本身就争议不 断的话题。 2 关于芳香性概念的探讨 从上面的讨论中可以看出 ,芳香性概念的应用范围在不断扩大 ,其内涵也在不断地发展 , 以适应并包容和解释新产生的化合物。然而 ,对于芳香性这个基本概念 ,人们目前却仍没有透 彻的了解。传统的休克尔规则已不能解释不断涌现的新的芳香化合物。对于芳香性的认识现 在主要可以分为 4个不同角度。 (1) 从能量上考虑。芳香体系的化合物具有额外的由电子离域产生的稳定化作用。但参 比物质的选取是一个非常困难的问题 ,要想排除普通共轭产生的稳定化作用以及分子几何构 型上的差别产生的能量差异对计算结果的影响是十分困难的。 (2) 从几何构型的角度。传统的芳香性总是与键长的平均化以及分子的平面结构联系在 一起 ,然而在许多新发现的芳香化合物中 ,芳香性对于平面扭曲的容忍度似乎相当大。而且 , 键长趋于平均化并非芳香性化合物特有的性质。最新研究表明 ,在许多非芳香性分子中 (如 39

C,H,N,)CC键长几乎相等】,而在芳香性化合物中键长变化的范围有时反而会很大。另 外,关于δ键和π键对于键长平均化的贡献大小仍然是一个争论的焦点。 (3)从化学性质角度。这是最原始也是最直观的表现形式,但也是现在用得最少的一个 定义方式,因为化学反应需要涉及许多动力学性质,即与分子的非基态有关,这使情况变得更 为复杂。而且在最新合成的或理论上推出的许多芳香化合物中,很多都不能进行经典的芳香 族化合物反应,其中一些化合物的化学性质甚至很不稳定。故而,根据化学反应性质的定义已 经逐步被舍弃。 (4)从分子的磁学性质上比较。这也是现在应用比较普遍,被认为最有前景的一个方法。 众所周知,传统芳香性化合物如苯等)由于Ⅱ电子的环形离域会产生抗磁环流,并且可以很 方便地从'HMR及CMR谱上得出结论。相似的抗磁环流也被证明存在于其他芳香化合 物中。Schleyer等人提出将抗磁磁化率的上升(diamagnetic susceptibility exaltation)作为惟一可 量化的芳香性标准。1996年,Schleyer又提出将与核无关的化学位移(NCS,即nucleus-inde pendent chemical shifts)作为芳香性标准s1。关于NCS的讨论也正在不断深入中,仍然有 些问题需要解决) 然而,也有很多人反对片面地理解芳香性概念,如Katritky等人指出:“芳香性是一个多 维度(multid mensional)的概念,单方面的定义或衡量标准都将是片面的t61。” 但必须看到的是,芳香性是具有极强生命力的、非常有用的概念 一仅仅因为它没有 个确切的定义或度量就将其弃置不用是难以想象的州。正像ED.Bergnann所说的:“分类 和理论本身并不是目的。如果它们能够激发新的工作,创造新的化合物,它们就是好的:如果 不能就是没有意义的。”从这个意义上讲,芳香性确实是一个非常“好的定义,它引发产 生了层出不穷的新化合物、新的计算方法和新的理论如上文中所介绍的同芳香性、莫比乌斯 芳香性,空间三维芳香性以及Y型芳香性等)。虽然目前仍然没有一个明确的芳香性定义,而 且在很长时间内也许都不会有一个统一的、完美的解答,然而在追求这个目标的过程中所引发 的化学灵感也许才是这个概念的真正价值所在。 参考文献 王文消芳香性和非苯芳香化合物,北京:高等教育出版社,1985 Chen ere C S.CominboeufC.etal Chan Rex 2005.105:3842 959,8:652 高等有机化学基 第2版 上海:华东理工大学出版社,200 200 01:118s 05:369 Vamm,2003,426:819 ,127:242 c4 al Namr,1985,318:162 1Ed,2000,39:391 2,124(6):1119 K A et al J Am Chom Katrithky A R.Karelon M.Sild S,. 998.63:5228 40 1994-2009 China Academic Joumal Electronie Publishing House.All rights reserved.http://www.cnki.ne
C5 H9N + 2 ) C—C键长几乎相等 [ 2 ] ,而在芳香性化合物中键长变化的范围有时反而会很大。另 外 ,关于 δ键和 π键对于键长平均化的贡献大小仍然是一个争论的焦点。 (3) 从化学性质角度。这是最原始也是最直观的表现形式 ,但也是现在用得最少的一个 定义方式 ,因为化学反应需要涉及许多动力学性质 ,即与分子的非基态有关 ,这使情况变得更 为复杂。而且在最新合成的或理论上推出的许多芳香化合物中 ,很多都不能进行经典的芳香 族化合物反应 ,其中一些化合物的化学性质甚至很不稳定。故而 ,根据化学反应性质的定义已 经逐步被舍弃。 (4) 从分子的磁学性质上比较。这也是现在应用比较普遍 ,被认为最有前景的一个方法。 众所周知 ,传统芳香性化合物 (如苯等 )由于 π电子的环形离域会产生抗磁环流 ,并且可以很 方便地从 1 H2NMR及 13 C2NMR谱上得出结论。相似的抗磁环流也被证明存在于其他芳香化合 物中。Schleyer等人提出将抗磁磁化率的上升 ( diamagnetic suscep tibility exaltation)作为惟一可 量化的芳香性标准。1996年 , Schleyer又提出将与核无关的化学位移 (N ICS,即 nucleus2inde2 pendent chem ical shifts)作为芳香性标准 [ 15 ]。关于 N ICS的讨论也正在不断深入中 ,仍然有一 些问题需要解决 [ 2 ]。 然而 ,也有很多人反对片面地理解芳香性概念 ,如 Katritzky等人指出 :“芳香性是一个多 维度 (multidimensional)的概念 ,单方面的定义或衡量标准都将是片面的 [ 16 ]。” 但必须看到的是 ,芳香性是具有极强生命力的、非常有用的概念 ———“仅仅因为它没有一 个确切的定义或度量就将其弃置不用是难以想象的 ” [ 17 ]。正像 E. D. Bergmann所说的 :“分类 和理论本身并不是目的。如果它们能够激发新的工作 ,创造新的化合物 ,它们就是好的 ;如果 不能 ———就是没有意义的。”从这个意义上讲 ,芳香性确实是一个非常“好 ”的定义 ,它引发产 生了层出不穷的新化合物、新的计算方法和新的理论 (如上文中所介绍的同芳香性、莫比乌斯 芳香性 ,空间三维芳香性以及 Y型芳香性等 )。虽然目前仍然没有一个明确的芳香性定义 ,而 且在很长时间内也许都不会有一个统一的、完美的解答 ,然而在追求这个目标的过程中所引发 的化学灵感也许才是这个概念的真正价值所在。 参 考 文 献 1 王文清. 芳香性和非苯芳香化合物. 北京 : 高等教育出版社 , 1985 2 Chen Z,Wannere C S, Corminboeuf C, et al. Chem Rev, 2005, 105: 3842 3 W instein S. J Am Chem Soc, 1959, 81: 6524 4 荣国斌. 高等有机化学基础. 第 2版. 上海 :华东理工大学出版社 , 2001 5 W illiams R V. Chem Rev, 2001, 101: 1185 6 Rzepa H S. Chem Rev, 2005, 105: 3697 7 A jami D, Oeckler O, Simon A, et al. N ature, 2003, 426: 819 8 Castro C. J Am Chem Soc, 2005, 127: 2425 9 Kr¾stchmerW , Lamb L D, Fostiropoulos K, et al. N ature, 1990, 347: 354 10 Kroto H W , Heath J R, O′Brien S C, et al. N ature, 1985, 318: 162 11 Chen Z, Jiao H, Hirsch A. Angew Chem Int Ed, 2000, 39: 3915 12 King R B J. Chem Educ, 1996, 73: 993 13 Sommerfeld T. J Am Chem Soc, 2002, 124 (6) : 1119 14 Dworkin A, Naumann R, Seigfred C, et al. J O rg Chem , 2005, 70 (19) : 7605 15 Schleyer P v R, Maerker C, D ransfeld A, et al. J Am Chem Soc, 1996, 118: 6317 16 Katritzky A R, Jug K, Oniciu D C. Chem Rev, 2001, 101: 1421 17 Katritzky A R, Karelson M, Sild S, et al. J O rg Chem , 1998, 63: 5228 40