
·26 化学通报1997年第11期 6郭国霖.黄向东.唐有棋等,载体表面上固相分子扩散的计算机模拟,北京大学学报(自然科学版).1992.28(5):566一574 7段世铎,林强,王积分等分数维法对V系催化剂表面的纹理及催化性质的表征.高等学校化学学报,1992,13(10:1299 130 8 Avnir D and Farin D.Molecular fractal surfaces Nature.1984.308 26263 9 Farin D and A vnir D.The reaction dmenson in catalysis on dispersed metals J.Am.Chan.Soc.1988.110.20392045 10李后强,程光钺.分形与分维.成都四川教有出版社.19906一79 11纪红兵,宋一兵.林维明.CH、C02与0,催化氧化重整制合成气的研究.1.催化剂的筛选,天然气化工.1996.21(6):911 12纪红兵.甲烷、二氧化碳与氧气催化氧化重整制合成气的研究。华南理工大学博士学位论文,1996:6个71 各类手性质子源及其在去消旋化反应中的应用 徐明华 (华东师范大学化学系,上海200062) 摘要介绍了近20年来利用各类手性质子源通过对应选择质子化进行去消旋化反应的研究进展 关键词手性质子源((urc)对应选择质子化去消旋化 获取光学活性化合物,人们通常可以通过外消旋体的拆分,天然手性源的改造和不对称合成的 方法。近年来,利用外消旋羰基化合物经烯醇化后进行对映选择质子化获得光学活性羰基化合物, 作为一个简便而有效的方法已越来越为人们所重视。从研究的现状来看,除了寻找高效合适的手性 质子源以外,酶和催化抗体)也己被用于对映选择质子化的研究,并都取得了一定的成功。本文 介绍近年来各类手性质子源及其在对映选择质子化反应或去消旋化反应中的应用。 1外消旋心氨基酸、心羟基酮及心羟基酸的去消旋化 1978年,Duham el1等用(2R,3R)-酒石酸衍生物作为手性质子源,研究了心氨基酸的去消旋 化,最高获得了62%的光学收率 0 OH 1a.R=Ph.(2R.3R)DBTA 1b,R=t-Bu,(2R,3R)D PTA le,R=1-adam antyl optically active 在进一步的研究中,Duhamn el等又发现在形成烯醇锂盐中间体后,加入手性的N-乙基(1-苯 徐明华男,26岁,博士生。 1996-11-20收稿.1997-07-25修回 1994-2008 China Academie Journal Electronie Publishing House.All rights reserved.htp://www.enki.net
6 郭国霖, 黄向东, 唐有祺等 1 载体表面上固相分子扩散的计算机模拟 1 北京大学学报(自然科学版) , 1992, 28 (5): 566~ 574 7 段世铎, 林强, 王积分等. 分数维法对V 系催化剂表面的纹理及催化性质的表征 1 高等学校化学学报, 1992, 13 (10): 1299~ 1301 8 A vnir D and Farin D. M o lecular fractal surfaces. N ature, 1984, 308: 261~ 263 9 Farin D and A vnir D. T he reaction dim ension in catalysis on dispersed m etals. J. Am. Chem. Soc. , 1988, 110: 2039~ 2045 10 李后强, 程光钺 1 分形与分维 1 成都: 四川教育出版社, 1990: 67~ 79 11 纪红兵, 宋一兵, 林维明 1CH 4、CO 2 与O 2 催化氧化重整制合成气的研究 111 催化剂的筛选 1 天然气化工, 1996, 21 (6): 9~ 11 12 纪红兵 1 甲烷、二氧化碳与氧气催化氧化重整制合成气的研究 1 华南理工大学博士学位论文, 1996: 64~ 71 徐明华 男, 26 岁, 博士生。 1996211220 收稿, 1997207225 修回 各类手性质子源及其在去消旋化反应中的应用 徐明华 (华东师范大学化学系, 上海 200062) 摘要 介绍了近 20 年来利用各类手性质子源, 通过对应选择质子化进行去消旋化反应的研究进展. 关键词 手性质子源(ch iral p ro ton source) 对应选择质子化 去消旋化 获取光学活性化合物, 人们通常可以通过外消旋体的拆分, 天然手性源的改造和不对称合成的 方法。近年来, 利用外消旋羰基化合物经烯醇化后进行对映选择质子化获得光学活性羰基化合物, 作为一个简便而有效的方法已越来越为人们所重视。从研究的现状来看, 除了寻找高效合适的手性 质子源以外, 酶[ 1 ]和催化抗体[ 2 ]也已被用于对映选择质子化的研究, 并都取得了一定的成功。本文 介绍近年来各类手性质子源及其在对映选择质子化反应或去消旋化反应中的应用。 1 外消旋 Α2氨基酸、Α2羟基酮及 Α2羟基酸的去消旋化 1978 年,D uham el[ 3 ]等用(2R, 3R ) 2酒石酸衍生物作为手性质子源, 研究了 Α2氨基酸的去消旋 化, 最高获得了 62% 的光学收率。 1a, R= Ph, (2R, 3R)DBTA 1b, R= t2Bu, (2R, 3R)D PTA 1c, R= 12adam antyl N Ph O OM e Ph racem ic LDA Ph N Ph OM e OL i 1 N Ph O OM e Ph op tically active 在进一步的研究中,D uham el 等[ 4 ]又发现在形成烯醇锂盐中间体后, 加入手性的N 2乙基(12苯 · 62 · 化学通报 1997 年 第 11 期 © 1994-2008 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net

化学通报1997年第11期 27 基乙基)胺,然后再在。70℃,用1b进行对映选择质子化,能使产物的ee%值提高到70%。 把(2R,3R)DPTA1b用于c心羟基酮的去消旋化,结果得到的对映异构体比例为90:10(80% ee1,化学收率82%ls。 Ph Ph、 1-0ò OH racemic S(90)R(10) F.Cavelier等6研究了r羟基酸的去消旋化。把其制备成前手性的硅烯醇酵后,用R)-Panto- lactone2作为手性质子源,进行对映选择质子化反应,结果获得了5O%ee 近来,他们又发现用聚合物作为手性质子源的载体3,应用于以上反应,结果在。40℃时就获 得了94%ee. 0 -CH,0-C TOH HO OSiMe3 H QH H Ph H+/H2O Ph COOH 2外消旋酯及酰胺的去消旋化反应 CFeh侧等人曾以外消旋的酯为原料,通过串联格氏反应和对映选择质子化,成功地制备了 香料重要组分(R)-(什)-和(S)-(~)-Dam ascone选用麻黄碱衍生物4和5作为手性质子源,分 别获得了58%和84%的ee值. 1993年,Fehr小组又报道了硫代羧酸酯的去消旋化反应。以光学活性的N-异丙基麻黄碱 作为手性质子源,ee值可高达99%,这是至今所报道的烯醇盐的质子化反应中获得ee值最高 的,这个研究的成功对去消旋化方法合成药物中间体光学活性的环牛儿酸有很大的应用价值。 1994-2008 China Academic Journal Electronie Publishing House.All rights reserved.htp:/www.enki.net
基乙基) 胺, 然后再在- 70℃, 用 1b 进行对映选择质子化, 能使产物的 e. e. % 值提高到 70%。 把(2R , 3R) 2D PTA 1b 用于 Α2羟基酮的去消旋化, 结果得到的对映异构体比例为 90∶10 (80% e. e. ], 化学收率 82% [ 5 ]。 F. Cavelier 等[ 6 ]研究了 Α2羟基酸的去消旋化。把其制备成前手性的硅烯醇醚后, 用(R) 2Pan to2 lactone 2 作为手性质子源, 进行对映选择质子化反应, 结果获得了 50% e. e. . 近来, 他们又发现用聚合物作为手性质子源的载体 3, 应用于以上反应, 结果在- 40℃时就获 得了 94% e. e. [ 7 ]。 2 外消旋酯及酰胺的去消旋化反应 C. Feh r[ 8 ]等人曾以外消旋的酯为原料, 通过串联格氏反应和对映选择质子化, 成功地制备了 香料重要组分(R ) - (+ ) - 和(S) 2(2) 2Α2D am ascone. 选用麻黄碱衍生物 4 和 5 作为手性质子源, 分 别获得了 58% 和 84% 的 e. e. 值。 1993 年, Feh r[ 9 ]小组又报道了硫代羧酸酯的去消旋化反应。以光学活性的N 2异丙基麻黄碱 5 作为手性质子源, e. e. 值可高达 99% , 这是至今所报道的烯醇盐的质子化反应中获得 e. e. 值最高 的, 这个研究的成功对去消旋化方法合成药物中间体光学活性的环牛儿酸有很大的应用价值。 化学通报 1997 年 第 11 期 · 72 · © 1994-2008 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net
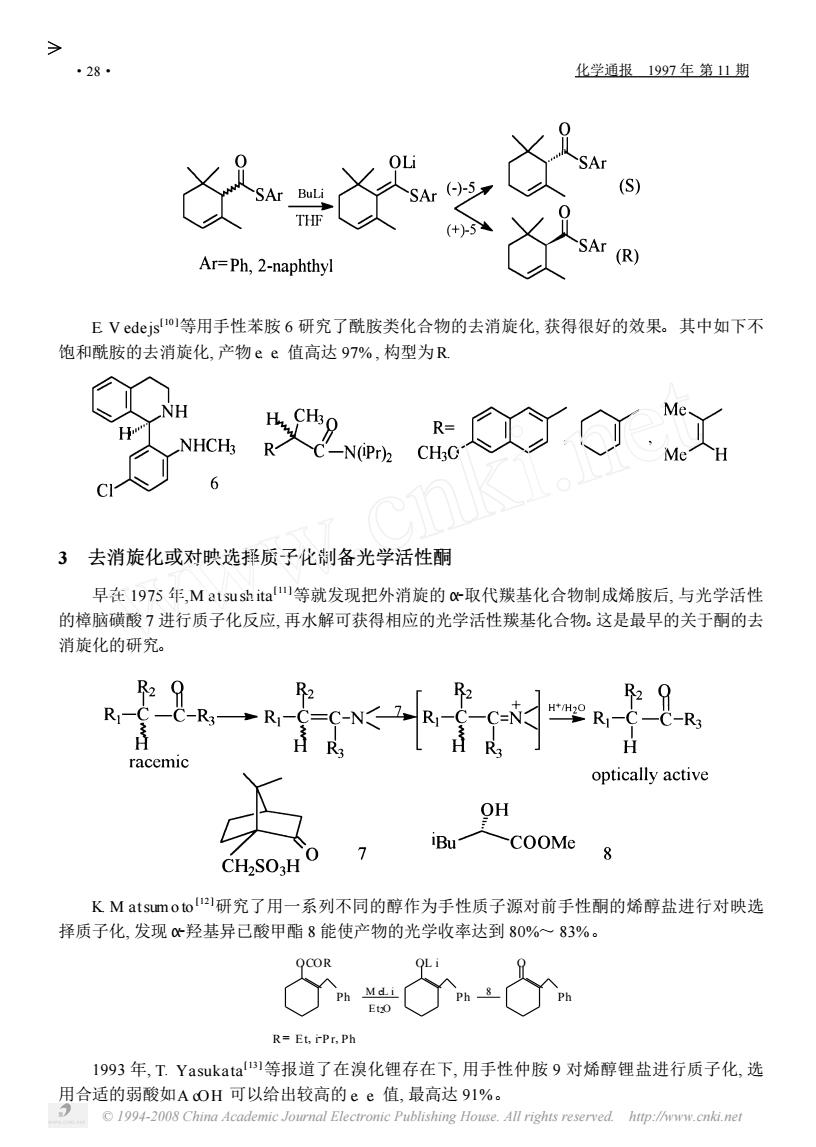
化学通报1997年第11期 r=Ph,2-naphthy E Vedejs1等用手性苯胺6研究了酰胺类化合物的去消旋化,获得很好的效果。其中如下不 饱和酰胺的去消旋化,产物ee值高达97%,构型为R NH 3 去消旋化或对映选邦质子化制备光学活性酮 早在1975年,Ma13 shita等就发现把外消旋的取代羰基化合物制成烯胺后,与光学活性 的樟脑磺酸7进行质子化反应,再水解可获得相应的光学活性羰基化合物。这是最早的关于酮的去 消旋化的研究。 R2 K2 2 29 C-R3-R optically active OH COOMe K Matsumoto研究了用一系列不同的醇作为手性质子源对前手性酮的烯醇盐进行对映选 择质子化,发现心羟基异已酸甲酯8能使产物的光学收率达到80%一83%。 胎d R=,Ph 1993年,T.Yasukatal等报道了在溴化锂存在下,用手性仲胺9对烯醇锂盐进行质子化,选 用合适的弱酸如AcOH可以给出较高的ee值,最高达91%。 c 1994-2008 China academic lournal electronic publishing house all rights reserved http/hwww cn点.ne
E. V edejs[ 10 ]等用手性苯胺 6 研究了酰胺类化合物的去消旋化, 获得很好的效果。其中如下不 饱和酰胺的去消旋化, 产物 e. e. 值高达 97% , 构型为R. 3 去消旋化或对映选择质子化制备光学活性酮 早在 1975 年,M atsu sh ita[ 11 ]等就发现把外消旋的 Α2取代羰基化合物制成烯胺后, 与光学活性 的樟脑磺酸 7 进行质子化反应, 再水解可获得相应的光学活性羰基化合物。这是最早的关于酮的去 消旋化的研究。 K. M atsum o to [ 12 ]研究了用一系列不同的醇作为手性质子源对前手性酮的烯醇盐进行对映选 择质子化, 发现 Α2羟基异已酸甲酯 8 能使产物的光学收率达到 80%~ 83%。 R= E t, i2P r, Ph OCOR Ph M eL i E t2O OL i Ph 8 O Ph 1993 年, T. Yasukata[ 13 ]等报道了在溴化锂存在下, 用手性仲胺 9 对烯醇锂盐进行质子化, 选 用合适的弱酸如A cOH 可以给出较高的 e. e. 值, 最高达 91%。 · 82 · 化学通报 1997 年 第 11 期 © 1994-2008 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net
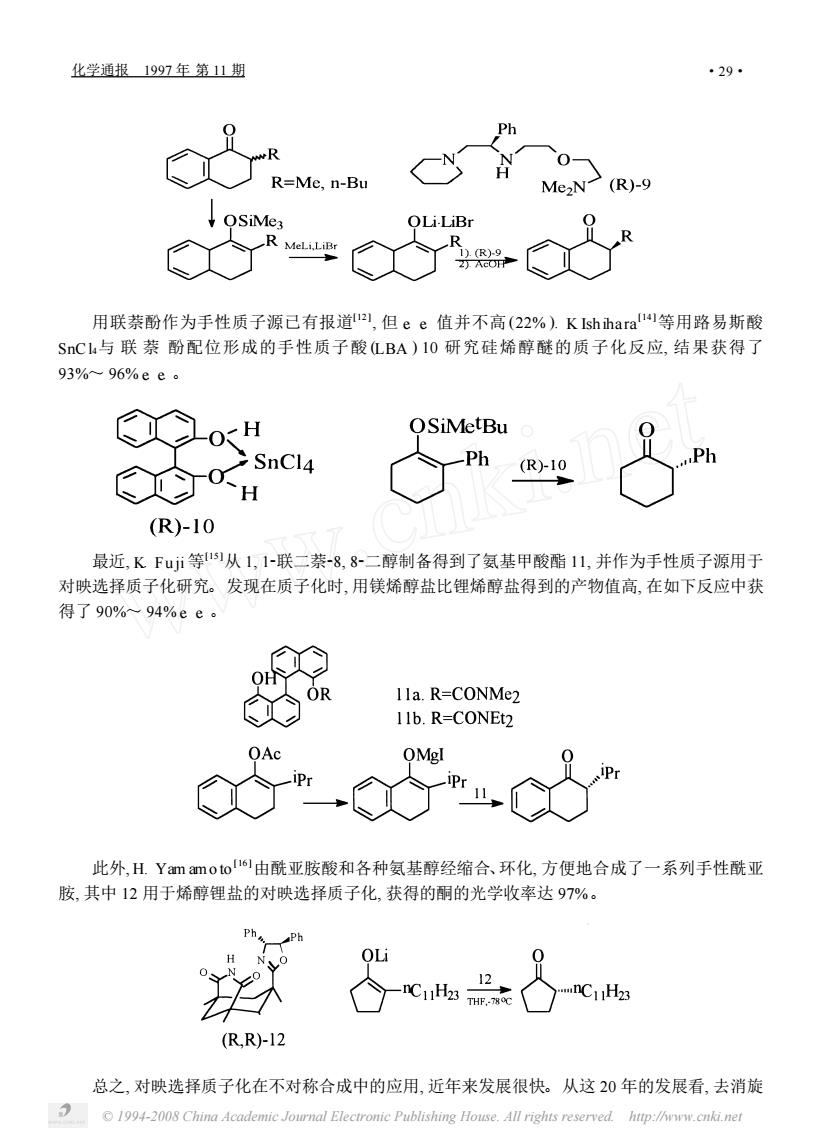
化学通报1997年第11期 ·29 Ph R=Me,n-Bu QLi-LiBr 用联萘酚作为手性质子源已有报道a,但ee值并不高(22%).K Ishihara等用路易斯酸 SC与联萘酚配位形成的手性质子酸LBA)10研究硅烯醇醚的质子化反应,结果获得了 93%~96%ee。 OSiMetBu SnCl4 -Ph (R)I0 (R)-10 最近,KFui等1从1,1-联二茶-8.8-二醇制备得到了氨基甲酸酯11,并作为手性质子源用于 对映选择质子化研究。发现在质子化时,用镁烯醇盐比锂烯醇盐得到的产物值高,在如下反应中获 得了90%~94%ee。 OH 1la.R=CONMe2 11b.R=CONEt2 OMgl 此外,H.Yam amo to!6由酰亚胺酸和各种氨基醇经缩合、环化,方便地合成了一系列手性酰亚 胺,其中12用于烯醇锂盐的对映选择质子化,获得的酮的光学收率达97%。 (RR-12 总之,对映选择质子化在不对称合成中的应用,近年来发展很快。从这20年的发展看,去消旋 1994-2008 China Academie Journal Electromic Publishing House.All rights reserved. http://www.cnki.net
用联萘酚作为手性质子源已有报道[ 12 ] , 但 e. e. 值并不高 (22% ). K Ish ihara[ 14 ]等用路易斯酸 SnC l4与 联 萘 酚配位形成的手性质子酸 (LBA ) 10 研究硅烯醇醚的质子化反应, 结果获得了 93%~ 96% e. e. 。 最近, K. Fu ji 等[ 15 ]从 1, 12联二萘28, 82二醇制备得到了氨基甲酸酯 11, 并作为手性质子源用于 对映选择质子化研究。发现在质子化时, 用镁烯醇盐比锂烯醇盐得到的产物值高, 在如下反应中获 得了 90%~ 94% e. e. 。 此外, H. Yam am o to [ 16 ]由酰亚胺酸和各种氨基醇经缩合、环化, 方便地合成了一系列手性酰亚 胺, 其中 12 用于烯醇锂盐的对映选择质子化, 获得的酮的光学收率达 97%。 总之, 对映选择质子化在不对称合成中的应用, 近年来发展很快。从这 20 年的发展看, 去消旋 化学通报 1997 年 第 11 期 · 92 · © 1994-2008 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net

·30· 化学通报1997年第11期 化或对映选择质子化反应的研究主要集中在酮,酯,氨基酸,羟基酸等化合物上,工作的重点是寻 找和筛选效果显著的手性质子源,探索合理的反应机理。从手性质子源的结构来看,大致有酒石酸 衍生物s),樟脑衍生物川,麻黄碱衍生物⑧),哌嗪衍生物的盐酸盐),含羟基或酚羟基类化合 物624,11,手性仲胺和手性或非手性弱酸的组合,手性苯胺和手性酰亚胺1这几大类,另外, 也有文献报道用糖类作为手性质子源,但选择性较差。 虽然有的工作已经取得了很大的成功,但仍存在一些不足,例如反应温度一般都需控制在 -78℃左右,有的手性质子源结构复杂,不易得到,前手性负碳离子中间体不够稳定等,这些都有待 于进一步的深入研究。 参考文献 1 Matsumoto K,Tsutsum iS et al J.Am.Chem.Soc,1990,112:9614 2 Reymond JL,Reber J et al Angew.Chem.Int Et Engl,1994,33:475 3 DuhamelL,Plaquevent J C.J.Am.Chem.Soc,1978,110:7415 4 (a)DuhamelL,Plaquevent J C.Tetrahedron Lett,1980,21:2521(b)DuhamelL,Fouquay S Tetrahedron Lett,1986,27: 4975 5 DuhamelL,Launay J C.Tetrahedron Lett,1983,24:4209 6 Cavelier F,Gomez S et al Tetra A symmetry,1993,4:2501 7 Cavelier F,Gomez S Tetrahedron Lett,1994,35:2891 8 Fehr C,Galindo J.J Am.Chem.Soc,1988,110:6910 9 Fehr C,Stempfl et al Angew.Chem.Int Et Engl,1993,32:1042 10 Vedejs E,Lee N et al J.Am.Chem.Soc,1994,116:2175 11 Matsuchita H,NoguchiM et al Bull Chem.Soc Jap,1975,48:3715 12 Matsumoto K,Ohta H.Tetrahedron Lett,1991,32:4729 13 Yasukata T,Kogo K Tetra A symmetry,1993,4:35 14 Ishihara K,Kaneeda M.J.Am.Chem.Soc,1994,116:11179 15 Fuji K,Kawabate T et al J.Org Chem..1995,60:1914 16 Yanagisawa A.Kawabate T et al Angew.Chem.Int Et Engl,1994,33:107 17 Fuji K,Tanaka K et al Tetra A symmetry.,1993,4:247 本文承陈良教授审阅并提宝贵意见,特此致谢。 陈氏重排反应(Chan Rearrangem en t) 杨扬王东 (中国科学院化学研究所北京100080) 1984年,加拿大M cGill大学陈德恒教授报道了一个全新的重排反应(乙酰氧基)乙酸酯 (1)在碱性条件下可以进行重排反应给出2-羟基-3-酮酯(2)(图1)。这一反应被认为是经过了一个 环氧中间体(3)。如果用不同的试剂淬灭反应可以得到不同的2-羟基-3-酮酯的衍生物(4~6)。1可 以由溴代乙酸酯和羧酸反应得到。因此,整个反应历程提供了一个由羧酸出发形成新的C-C键, 1997-07-20收稿 C1994-2008 China Academic Journal Electronic Publishing House.All rights reserved http://www.cnki.net
化或对映选择质子化反应的研究主要集中在酮, 酯, 氨基酸, Α2羟基酸等化合物上, 工作的重点是寻 找和筛选效果显著的手性质子源, 探索合理的反应机理。从手性质子源的结构来看, 大致有酒石酸 衍生物[ 3~ 5 ] , 樟脑衍生物[ 11 ] , 麻黄碱衍生物[ 8, 9 ] , 哌嗪衍生物的盐酸盐[ 17 ] , 含羟基或酚羟基类化合 物[ 6, 12, 14, 15 ] , 手性仲胺和手性或非手性弱酸的组合[ 4 ] , 手性苯胺和手性酰亚胺[ 10, 16 ]这几大类, 另外, 也有文献报道用糖类作为手性质子源, 但选择性较差。 虽然有的工作已经取得了很大的成功, 但仍存在一些不足, 例如反应温度一般都需控制在 - 78℃左右; 有的手性质子源结构复杂, 不易得到; 前手性负碳离子中间体不够稳定等, 这些都有待 于进一步的深入研究。 参 考 文 献 1 M atsumo to K, T sutsum i S et al. J. Am. Chem. Soc. , 1990, 112: 9614 2 Reymond J L , Reber J et al. A ngew. Chem. Int. E t. Engl. , 1994, 33: 475 3 D uham el L , P laquevent J C. J. Am. Chem. Soc, 1978, 110: 7415 4 (a) D uham elL , P laquevent J C. T etrahedron L ett, 1980, 21: 2521 (b) D uham elL , Fouquay S. T etrahedron L ett, 1986, 27: 4975 5 D uham el L , L aunay J C. T etrahedron L ett, 1983, 24: 4209 6 Cavelier F, Gom ez S et al. T etra. A symm etry, 1993, 4: 2501 7 Cavelier F, Gom ez S. T etrahedron L ett, 1994, 35: 2891 8 Feh r C, Galindo J. J. Am. Chem. Soc. , 1988, 110: 6910 9 Feh r C, Stempfl et al. A ngew. Chem. Int. E t Engl. , 1993, 32: 1042 10 V edejs E, L ee N et al. J. Am. Chem. Soc. , 1994, 116: 2175 11 M atsuch ita H , N oguch iM et al. Bull. Chem. Soc. Jap. , 1975, 48: 3715 12 M atsumo to K, O h ta H. T etrahedron L ett, 1991, 32: 4729 13 Yasukata T, Kogo K. T etra. A symm etry, 1993, 4: 35 14 Ish ihara K, Kaneeda M. J. Am. Chem. Soc. , 1994, 116: 11179 15 Fuji K, Kaw abate T et al. J. O rg. Chem. , 1995, 60: 1914 16 Yanagisaw a A. Kaw abate T et al. A ngew. Chem. Int. E t. Engl, 1994, 33: 107 17 Fuji K, T anaka K et al. T etra. A symm etry. , 1993, 4: 247 本文承陈良教授审阅并提宝贵意见, 特此致谢。 1997207220 收稿 陈氏重排反应(Chan Rearrangem en t) 杨 扬 王 东 (中国科学院化学研究所 北京 100080) 1984 年, 加拿大M cGill 大学陈德恒教授[ 1 ]报道了一个全新的重排反应 Α2(乙酰氧基) 乙酸酯 (1) 在碱性条件下可以进行重排反应给出 22羟基232酮酯(2) (图 1)。这一反应被认为是经过了一个 环氧中间体(3)。如果用不同的试剂淬灭反应可以得到不同的 22羟基232酮酯的衍生物(4~ 6)。1 可 以由 Α2溴代乙酸酯和羧酸反应得到。因此, 整个反应历程提供了一个由羧酸出发形成新的C2C 键, · 03 · 化学通报 1997 年 第 11 期 © 1994-2008 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net