
志鸿优化系列丛书 志鸿优化网,永远提供更新的: 丛书主编任志湖。 http://www.zhyh.org 综合检测(A卷) (时间:90分钟满分:100分) 一、选择题(本题共18个小题,每小题2分,共36分。每小题四个选项只有一项符合题 目要求) 1.下列说法或有关化学用语的表述正确的是()。 A.s能级的原子轨道图可表示为 B.在基态多电子原子中,p能级电子的能量一定高于s能级电子的能量 C因O的电负性比N的大,故O的第一电离能比N的大 D.根据原子核外电子排布的特点,Z在元素周期表中位于s区 答案A 解析基态多电子原子中,2p能级电子的能量低于3s能级电子的能量,B项错误。第一电离能:N>0,C 项错误。Zn的价层电子排布式为3d14s,位于ds区,D项错误。 2.XY是由电负性相差最大的两种主族元素所形成的化合物(放射性元素除外),下列有关XY及其组 成元素的说法中不正确的是( )。 AX元素的第一电离能远大于其第二电离能 B.Y元素的单质中含有共价键 CY元素位于元素周期表的右上角 D.XY一定是离子化合物 含案A 解析除放射性元素外,周期表中元素电负性相差最大的两种主族元素分别为Cs和F,CsF为离子化 合物。 3.下列叙述正确的是()。 A[Ar]3d4s2是基态铁原子的电子排布式 B.基态铬原子的电子排布式是1s22s22p3s23p4s3d C.基态铜原子的价层电子排布式是3d4s2 1s 2s 2p D基态氮原子的轨道表示式是四 团 答案A 1
1 综合检测(A 卷) (时间:90 分钟 满分:100 分) 一、选择题(本题共 18 个小题,每小题 2 分,共 36 分。每小题四个选项只有一项符合题 目要求) 1.下列说法或有关化学用语的表述正确的是( )。 A.ns 能级的原子轨道图可表示为 B.在基态多电子原子中,p 能级电子的能量一定高于 s 能级电子的能量 C.因 O 的电负性比 N 的大,故 O 的第一电离能比 N 的大 D.根据原子核外电子排布的特点,Zn 在元素周期表中位于 s 区 答案:A 解析:基态多电子原子中,2p 能级电子的能量低于 3s 能级电子的能量,B 项错误。第一电离能:N>O,C 项错误。Zn 的价层电子排布式为 3d104s2 ,位于 ds 区,D 项错误。 2.XY 是由电负性相差最大的两种主族元素所形成的化合物(放射性元素除外),下列有关 XY 及其组 成元素的说法中不正确的是( )。 A.X 元素的第一电离能远大于其第二电离能 B.Y 元素的单质中含有共价键 C.Y 元素位于元素周期表的右上角 D.XY 一定是离子化合物 答案:A 解析:除放射性元素外,周期表中元素电负性相差最大的两种主族元素分别为 Cs 和 F,CsF 为离子化 合物。 3.下列叙述正确的是( )。 A.[Ar]3d64s2 是基态铁原子的电子排布式 B.基态铬原子的电子排布式是 1s22s22p63s23p64s13d5 C.基态铜原子的价层电子排布式是 3d94s2 D.基态氮原子的轨道表示式是 答案:A

志鸿优化系列丛书 志鸿优化网,永远提供更新的: 丛书主编任志河。 http://www.zhyh.org 解析B项,在书写电子排布式时,能层低的能级要写在左边,不能按填充顺序写;C项,d轨道应是全充 满时稳定D项违反了洪特规则。 4.己知X、Y是短周期的两种元素,下表中由条件得出的结论一定正确的是()。 选项条件 结论 A 若原子半径:X>Y 原子序数:XY 元素的最高正化合价:X>Y D 若X、Y原子最外层电子数分别为1、7 元素的第一电离能X>Y 答案B 解析若原子半径大小为XY,原子序数不一定有XO,原子序数大小顺序 为N>O,A项错误。电负性大的元素吸引键合电子的能力强,化合物中电负性大的元素显负价,B项 正确。F元素原子的价层电子数大于N的,但F没有正价,C项错误。若X、Y原子的最外层电子数 分别为1、7,则X可能为H、Li、NaY可能为F、Cl,则第一电离能大小顺序为Li<F、Na<CL,D项错 误。 5.在气相中,关于BeF2和SF2的下列说法错误的是()。 A.BF2分子中,中心原子Be的价层电子对数等于2,其空间结构为直线形,成键电子对数也等于2 B.BeF2分子的VSEPR模型为直线形 C.SF2分子中,中心原子S的价层电子对数等于4,其空间结构为四面体形,成键电子对数等于2,没有 孤电子对 D.在气相中,BeF2是直线形,而SF2是V形 答案C 解析SF分子中,中心原子S上的价层电子对数等于4,其VSEPR模型为四面体形,成镀电子对数等 于2,另有2个孤电子对,因此SF2分子的空间结构为V形。 6.有机物CHCH一CH一C=CH中下方标有,的碳原子的杂化方式依次为()。 A.sp、sp2、sp3 B.sp3、sp2、Sp C.sp2、sp、sp3 D.sp3、sp、sp2 答案B 解析甲基上C有4个。键电子对,没有孤电子对,则C采取$p杂化;碳碳双键两端的2个C均有3个 。键电子对,没有孤电子对,则C采取$p2杂化;碳碳三键两端的2个C均有2个。镀电子对,没有孤电 子对,则C采取Sp杂化。 V20 7.反应2SO2+O2△2SO3在密闭容器中进行,下列关于该反应中涉及物质的说法错误的是()。 A.SO3中S采取sp3杂化 2
2 解析:B 项,在书写电子排布式时,能层低的能级要写在左边,不能按填充顺序写;C 项,d 轨道应是全充 满时稳定;D 项违反了洪特规则。 4.已知 X、Y 是短周期的两种元素,下表中由条件得出的结论一定正确的是( )。 选项 条件 结论 A 若原子半径:X>Y 原子序数:XY 元素的最高正化合价:X>Y D 若 X、Y 原子最外层电子数分别为 1、7 元素的第一电离能:X>Y 答案:B 解析:若原子半径大小为 X>Y,原子序数不一定有 XO,原子序数大小顺序 为 Na>O,A 项错误。电负性大的元素吸引键合电子的能力强,化合物中电负性大的元素显负价,B 项 正确。F 元素原子的价层电子数大于 N 的,但 F 没有正价,C 项错误。若 X、Y 原子的最外层电子数 分别为 1、7,则 X 可能为 H、Li、Na,Y 可能为 F、Cl,则第一电离能大小顺序为 Li<F、Na<Cl,D项错 误。 5.在气相中,关于 BeF2 和 SF2 的下列说法错误的是( )。 A.BeF2 分子中,中心原子 Be 的价层电子对数等于 2,其空间结构为直线形,成键电子对数也等于 2 B.BeF2 分子的 VSEPR 模型为直线形 C.SF2 分子中,中心原子 S 的价层电子对数等于 4,其空间结构为四面体形,成键电子对数等于 2,没有 孤电子对 D.在气相中,BeF2 是直线形,而 SF2 是 V 形 答案:C 解析:SF2 分子中,中心原子 S 上的价层电子对数等于 4,其 VSEPR 模型为四面体形,成键电子对数等 于 2,另有 2 个孤电子对,因此 SF2 分子的空间结构为 V 形。 6.有机物 C.H3CH C.H—C.≡CH 中下方标有“·”的碳原子的杂化方式依次为( )。 A.sp、sp2、sp3 B.sp3、sp2、sp C.sp2、sp、sp3 D.sp3、sp、sp2 答案:B 解析:甲基上 C 有 4 个 σ 键电子对,没有孤电子对,则 C 采取 sp3 杂化;碳碳双键两端的 2 个 C 均有 3个 σ 键电子对,没有孤电子对,则 C 采取 sp2 杂化;碳碳三键两端的 2 个 C 均有 2 个 σ 键电子对,没有孤电 子对,则 C 采取 sp 杂化。 7.反应 2SO2+O2 2SO3 在密闭容器中进行,下列关于该反应中涉及物质的说法错误的是( )。 A.SO3 中 S 采取 sp3 杂化

志鸿优化系列丛书 志鸿优化网永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org B.固态O2的晶体结构采取密堆积方式 C增大O2的浓度能增大反应速率 D.V位于第四周期第VB族 答案A 解析0,中S采取sp2杂化,A项错误。 8.晶体硅是一类非常重要的材料,在很多领域都有广泛的应用。下列对晶体硅的叙述中正确的是 ()。 A形成晶体硅的速率越快越好 B.晶体硅没有固定的熔、沸点 C.可用X射线衍射实验来鉴别晶体硅和玻璃 D.晶体硅的形成与晶体的自范性有关,而与各向异性无关 答案c 解析项,晶体的形成都要有一定的形成条件,如温度、压强、结晶速率等,但并不是说结晶速率越 快越好,速率太快可能导致得不到呈现规则外形的晶体。B项,晶体有较固定的熔、沸点,不正确。C 项,通过X射线衍射实验能够测出物质的内部结构,根据粒子是否有规则的排列就能区分出晶体与非 晶体。D项,晶体的形成与晶体的自范性和各向异性都有密切关系。 9.下列说法正确的是( )。 A.冰融化时,分子中的H一O发生断裂 B.分子晶体中,分子间作用力越大,通常熔点越高 C.分子晶体中,共价键的键能越大,分子的熔、沸点越高 D.分子晶体中,分子间作用力越大,分子越稳定 含案B 解析冰融化时,破坏的是氢键和范德华力,水分子中的共价键不被破坏。分子晶体的熔、沸点高低与 分子间作用力的大小有关,与化学键的强弱无关。分子的稳定性与化学键的强弱有关,与分子间作用 力的大小无关。 10硅酸盐与二氧化硅一样,都以硅氧四面体作为基本结构单元。硅氧四面体可以表示成 ,其中 “。”表示氧原子,“,”表示硅原子(注:图中原子的相对大小不表示实际的大小关系)。硅氧四面体通过不 同方式的连接可以组成不同的多聚硅酸根离子。如图所示为某无限长单链的多聚硅酸根离子的结 构,试确定该阴离子中硅原子与氧原子的个数之比为( 3
3 B.固态 O2 的晶体结构采取密堆积方式 C.增大 O2 的浓度能增大反应速率 D.V 位于第四周期第ⅤB 族 答案:A 解析:SO3 中 S 采取 sp2 杂化,A 项错误。 8.晶体硅是一类非常重要的材料,在很多领域都有广泛的应用。下列对晶体硅的叙述中正确的是 ( )。 A.形成晶体硅的速率越快越好 B.晶体硅没有固定的熔、沸点 C.可用 X 射线衍射实验来鉴别晶体硅和玻璃 D.晶体硅的形成与晶体的自范性有关,而与各向异性无关 答案:C 解析:A 项,晶体的形成都要有一定的形成条件,如温度、压强、结晶速率等,但并不是说结晶速率越 快越好,速率太快可能导致得不到呈现规则外形的晶体。B 项,晶体有较固定的熔、沸点,不正确。C 项,通过 X 射线衍射实验能够测出物质的内部结构,根据粒子是否有规则的排列就能区分出晶体与非 晶体。D 项,晶体的形成与晶体的自范性和各向异性都有密切关系。 9.下列说法正确的是( )。 A.冰融化时,分子中的 H—O 发生断裂 B.分子晶体中,分子间作用力越大,通常熔点越高 C.分子晶体中,共价键的键能越大,分子的熔、沸点越高 D.分子晶体中,分子间作用力越大,分子越稳定 答案:B 解析:冰融化时,破坏的是氢键和范德华力,水分子中的共价键不被破坏。分子晶体的熔、沸点高低与 分子间作用力的大小有关,与化学键的强弱无关。分子的稳定性与化学键的强弱有关,与分子间作用 力的大小无关。 10.硅酸盐与二氧化硅一样,都以硅氧四面体作为基本结构单元。硅氧四面体可以表示成 ,其中 “ ”表示氧原子,“ ”表示硅原子(注:图中原子的相对大小不表示实际的大小关系)。硅氧四面体通过不 同方式的连接可以组成不同的多聚硅酸根离子。如图所示为某无限长单链的多聚硅酸根离子的结 构,试确定该阴离子中硅原子与氧原子的个数之比为( )

志鸿优化系列丛书 志鸿优化网,永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org A1:2 B.1:3 C.1:4 D.2:5 答案B 解析由无限长单链的多聚硅酸根离子的结构图可知,重复结构单元为!,0表示氧原子,表示硅原 子,则结构单元中硅原子个数为1,氧原子个数为2+2×3,所以该阴离子中硅原子与氧原子的个数之 比为1:3。 11.下列叙述中正确的是()。 A.CS2为V形的极性分子,形成分子晶体 B.C10;的空间结构为平面三角形 C.氯化硼(BC)的熔点为-107℃,氯化硼液态时能导电而固态时不导电 D.SiF4和S0的中心原子均为sp3杂化,SiF4呈正四面体形,S0子呈三角锥形 含案p 解析CS2分子的空间结构与C02相似,是直线形的非极性分子,A项错误。C10中心原子上的孤电子 对数之X(8-3x2)=l,故该离子为三角锥形,B项错误。由BC的熔点可知它形成分子晶体,故在国态或 液态时都不导电,C项错误。SiF4的结构类似CH4,故Si原子采用sp杂化:S0好中心原子上的孤电子 对数-(8-3×2)=1,价层电子对数为4,故S米用sp杂化,S0?呈三角锥形,D项正确。 12.下列关于物质特殊聚集状态结构的叙述中,错误的是 A液晶具有液体的流动性,在某些物理性质方面具有类似晶体的各向异性 B.氧化镁晶体中离子键的百分数为50%,氧化镁晶体是一种过渡晶体 C如图氧化锌纳米晶体的晶胞中锌离子与氧离子的个数比为1:1 纳米氧化锌晶体的晶胞结构 D.等离子体的基本构成粒子只有阴、阳离子 答案p 解析液晶是介于液态和晶态之间的物质状态,既具有液体的流动性,在某些物理性质方面又具有类似 晶体的各向异性,A项正确。氧化镁晶体中离子键的百分数为50%,所以氧化镁晶体中化学键不是纯
4 A.1∶2 B.1∶3 C.1∶4 D.2∶5 答案:B 解析:由无限长单链的多聚硅酸根离子的结构图可知,重复结构单元为 , 表示氧原子, 表示硅原 子,则结构单元中硅原子个数为 1,氧原子个数为 2+2× 1 2 =3,所以该阴离子中硅原子与氧原子的个数之 比为 1∶3。 11.下列叙述中正确的是( )。 A.CS2 为 V 形的极性分子,形成分子晶体 B.ClO3 - 的空间结构为平面三角形 C.氯化硼(BCl3)的熔点为-107 ℃,氯化硼液态时能导电而固态时不导电 D.SiF4 和 SO3 2-的中心原子均为 sp3 杂化,SiF4 呈正四面体形,SO3 2-呈三角锥形 答案:D 解析:CS2 分子的空间结构与 CO2 相似,是直线形的非极性分子,A 项错误。ClO3 - 中心原子上的孤电子 对数= 1 2 ×(8-3×2)=1,故该离子为三角锥形,B 项错误。由 BCl3 的熔点可知它形成分子晶体,故在固态或 液态时都不导电,C 项错误。SiF4 的结构类似 CH4,故 Si 原子采用 sp3 杂化;SO3 2-中心原子上的孤电子 对数= 1 2 ×(8-3×2)=1,价层电子对数为 4,故 S采用 sp3 杂化,SO3 2-呈三角锥形,D 项正确。 12.下列关于物质特殊聚集状态结构的叙述中,错误的是 ( )。 A.液晶具有液体的流动性,在某些物理性质方面具有类似晶体的各向异性 B.氧化镁晶体中离子键的百分数为 50%,氧化镁晶体是一种过渡晶体 C.如图氧化锌纳米晶体的晶胞中锌离子与氧离子的个数比为 1∶1 纳米氧化锌晶体的晶胞结构 D.等离子体的基本构成粒子只有阴、阳离子 答案:D 解析:液晶是介于液态和晶态之间的物质状态,既具有液体的流动性,在某些物理性质方面又具有类似 晶体的各向异性,A 项正确。氧化镁晶体中离子键的百分数为 50%,所以氧化镁晶体中化学键不是纯

志鸿优化系列丛书 志鸿优化网永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org 粹的离子键,氧化镁晶体属于过渡晶体,B项正确。氧化锌纳米晶体的晶胞中含有6个锌离子与6个 氧离子,两种离子的个数比为1:1,C项正确。等离子体的基本构成粒子既有带电的阳离子,也有电中 性粒子,是一种复杂的物质聚集体系,D项错误。 13.酞菁钴近年来被广泛应用于光电材料、非线性光学材料、催化剂等方面。酞菁钴的熔点约为 163℃,其结构如图所示(部分化学键未画明)。下列说法错误的是()。 A酞菁钴中三种非金属元素的电负性大小顺序为N>C>H B.酞菁钴中碳原子的杂化方式有sp杂化和sp杂化两种 C.与钴离子通过配位键结合的是2号和4号N原子 D.酞菁钴是分子晶体 答案B 解析电负性大小顺序为NCH,A项正确。酞菁钻中碳原子均形成3个G镀,没有孤电子对,均采取 sp2杂化,B项错误。通常N原子形成3个共价键即可达到8电子稳定结构,所以2号和4号N原子与 钻离子通过配位键结合,C项正确。从酞菁钻的熔点来看,酞菁钻应该属于分子晶体,D项正确。 14.我国科研人员发现了一种新型超导体Bi3O2S2CL,由[Bi2O2]2+和[BiS2CI]2交替堆叠构成。己知Bi 位于第六周期第VA族,下列有关说法错误的是()。 A.Bi的价层电子排布式为5d16s26p3 B.有关元素的电负性:O>CI>S C.Bi3O2S2CI属于含共价键的离子化合物 D.该新型超导体的组成元素全部位于元素周期表p区 含案A 解析Bi位于第六周期第VA族,Bí原子核外有6个电子层,价层电子数为5,价层电子排布式为 6s26p3,A项错误。 15.有机化合物M的结构如图所示。下列说法不正确的是()。 OH HO CH2CH-CHCH2CH, A.分子中既有σ键,又有π键 5
5 粹的离子键,氧化镁晶体属于过渡晶体,B 项正确。氧化锌纳米晶体的晶胞中含有 6 个锌离子与 6 个 氧离子,两种离子的个数比为 1∶1,C 项正确。等离子体的基本构成粒子既有带电的阳离子,也有电中 性粒子,是一种复杂的物质聚集体系,D 项错误。 13.酞菁钴近年来被广泛应用于光电材料、非线性光学材料、催化剂等方面。酞菁钴的熔点约为 163 ℃,其结构如图所示(部分化学键未画明)。下列说法错误的是( )。 A.酞菁钴中三种非金属元素的电负性大小顺序为 N>C>H B.酞菁钴中碳原子的杂化方式有 sp2 杂化和 sp3 杂化两种 C.与钴离子通过配位键结合的是 2 号和 4 号 N 原子 D.酞菁钴是分子晶体 答案:B 解析:电负性大小顺序为 N>C>H,A 项正确。酞菁钴中碳原子均形成 3 个 σ 键,没有孤电子对,均采取 sp2 杂化,B 项错误。通常 N 原子形成 3 个共价键即可达到 8 电子稳定结构,所以 2 号和 4 号 N原子与 钴离子通过配位键结合,C 项正确。从酞菁钴的熔点来看,酞菁钴应该属于分子晶体,D 项正确。 14.我国科研人员发现了一种新型超导体 Bi3O2S2Cl,由[Bi2O2] 2+和[BiS2Cl]2-交替堆叠构成。已知 Bi 位于第六周期第ⅤA 族,下列有关说法错误的是( )。 A.Bi 的价层电子排布式为 5d106s26p3 B.有关元素的电负性:O>Cl>S C.Bi3O2S2Cl 属于含共价键的离子化合物 D.该新型超导体的组成元素全部位于元素周期表 p 区 答案:A 解析:Bi 位于第六周期第ⅤA 族,Bi 原子核外有 6 个电子层,价层电子数为 5,价层电子排布式为 6s26p3 , A 项错误。 15.有机化合物 M 的结构如图所示。下列说法不正确的是( )。 A.分子中既有 σ 键,又有 π 键

志鸿优化系列丛书 志鸿优化网,永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org B.碳原子有sp、sp2、sp3三种杂化方式 C.O一H的极性强于C一H的极性 D.羟基中氧原子采取sp杂化,VSEPR模型为四面体形 答案B 解析共价单键为。键,共价双键中既含有。键,又含有元键,该有机化合物中含共价单键和碳碳双键, 则既有6键,又有π键,A项正确。饱和碳原子采用$p3杂化方式,苯环和碳碳双键中的碳原子采用Sp 杂化,该有机化合物结构中无s即杂化的碳原子,B项错误。电负性:O>C,则O一H的极性强于C一H 的极性,C项正确。羟基中氧原子上的。键电子对数为2,孤电子对数为2,则羟基中氧原子采取$即杂 化,其VSEPR模型为四面体形,D项正确。 16.下表列出了某短周期元素R的各级电离能数据(用1、2…表示,单位为kJmo。下列关于元 素R的判断中一定正确的是( 。 电离能/kJmo 元素 738 1451 7733 10540 ①R的最高正价为+3价②R元素位于元素周期表中第ⅡA族 ③R元素第一电离能大于同周期相 邻元素④元素基态原子的电子排布式为1s22s2 A.①② B.②③ c.③④ D.①④ 含案B 解析由表中数据可知,R元素的第三电离能与第二电离能的差距最大,故最外层有两个电子,最高正 价为+2价,位于第ⅡA族,应为Mg元素,因此①不正确,②正确,④不正确;短周期第ⅡA族(s2p)的元 素,因p轨道处于全空状态,比较稳定,所以其第一电离能大于同周期相邻主族元素,③正确。 17.F2和Xe在一定条件下反应可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧 化性依次增强),都极易与水反应。已知6XeF4+12HC一2Xe03+4Xe↑+24HF+3O2↑,下列推测正确的 是()。 AXF2分子中各原子均达到8电子的稳定结构 B.某种氟化氙晶体的基本结构单元如图所示,可推知其化学式为XF6 6
6 B.碳原子有 sp、sp2、sp3 三种杂化方式 C.O—H 的极性强于 C—H 的极性 D.羟基中氧原子采取 sp3 杂化,VSEPR 模型为四面体形 答案:B 解析:共价单键为 σ 键,共价双键中既含有 σ 键,又含有 π 键,该有机化合物中含共价单键和碳碳双键, 则既有 σ 键,又有 π 键, A 项正确。饱和碳原子采用 sp3 杂化方式,苯环和碳碳双键中的碳原子采用 sp2 杂化,该有机化合物结构中无 sp 杂化的碳原子, B 项错误。电负性:O>C,则 O—H 的极性强于 C—H 的极性, C 项正确。羟基中氧原子上的 σ 键电子对数为 2,孤电子对数为 2,则羟基中氧原子采取 sp3杂 化,其 VSEPR 模型为四面体形, D 项正确。 16.下表列出了某短周期元素 R 的各级电离能数据(用 I1、I2……表示,单位为 kJ·mol-1 )。下列关于元 素 R 的判断中一定正确的是( )。 元素 电离能/(kJ·mol-1 ) I1 I2 I3 I4 …… R 738 1 451 7 733 10 540 …… ①R 的最高正价为+3 价 ②R 元素位于元素周期表中第ⅡA 族 ③R 元素第一电离能大于同周期相 邻元素 ④R 元素基态原子的电子排布式为 1s22s2 A.①② B.②③ C.③④ D.①④ 答案:B 解析:由表中数据可知,R 元素的第三电离能与第二电离能的差距最大,故最外层有两个电子,最高正 价为+2 价,位于第ⅡA 族,应为 Mg 元素,因此①不正确,②正确,④不正确;短周期第ⅡA 族(ns 2np 0 )的元 素,因 p 轨道处于全空状态,比较稳定,所以其第一电离能大于同周期相邻主族元素,③正确。 17.F2 和 Xe 在一定条件下反应可生成 XeF2、XeF4 和 XeF6 三种氟化氙,它们都是极强的氧化剂(其氧 化性依次增强),都极易与水反应。已知 6XeF4+12H2O 2XeO3+4Xe↑+24HF+3O2↑,下列推测正确的 是( )。 A.XeF2 分子中各原子均达到 8 电子的稳定结构 B.某种氟化氙晶体的基本结构单元如图所示,可推知其化学式为 XeF6
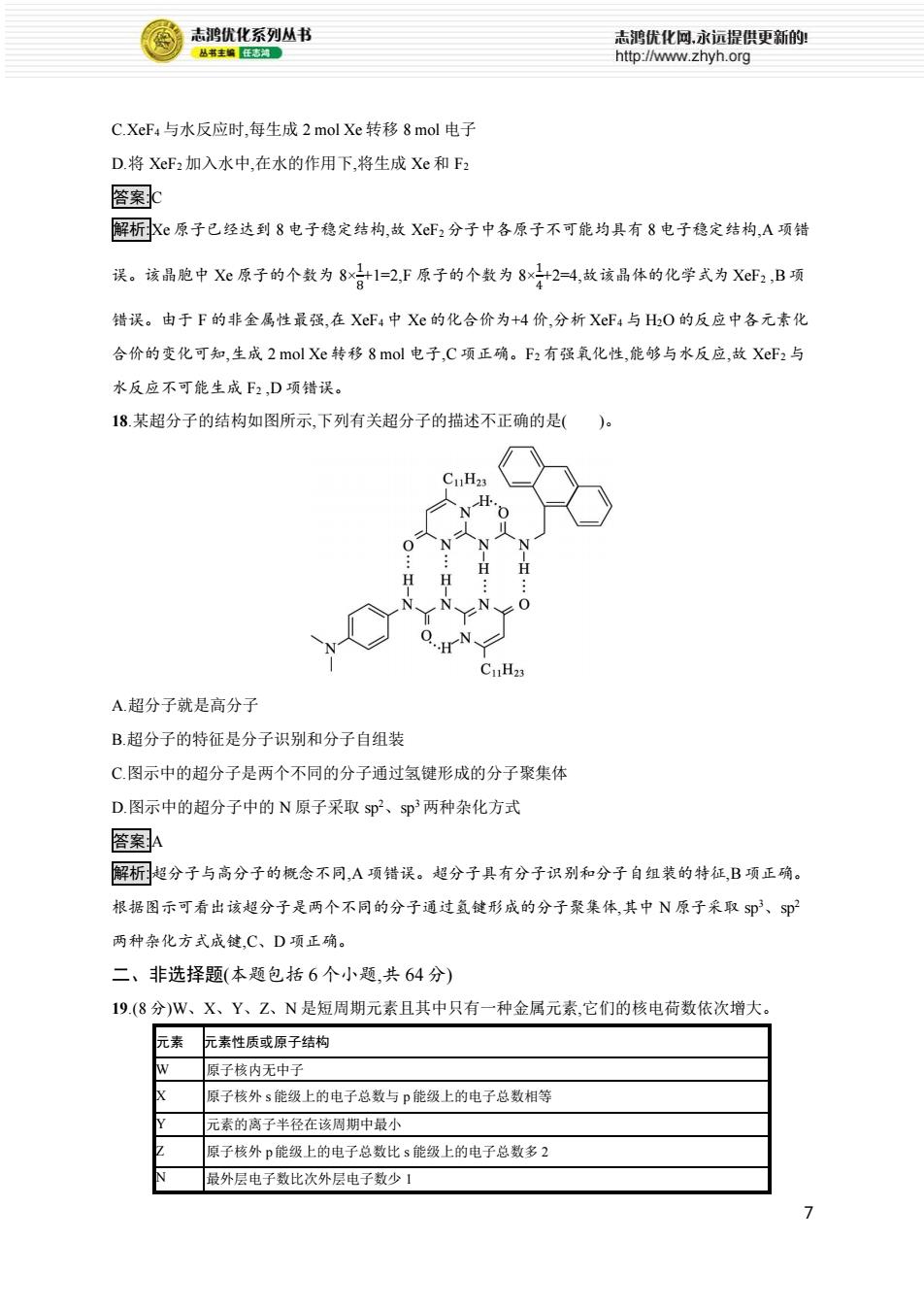
志鸿优化系列丛书 志鸿优化网,永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org C.XeF4与水反应时,每生成2 mol Xe转移8mol电子 D.将XeF2加入水中,在水的作用下,将生成Xe和F2 答案c 解析原子已经达到8电子稳定结构,故XF2分子中各原子不可能均具有8电子稳定结构,A项错 误。该晶胞中Xe原子的个数为8×日1=2,F原子的个数为8x2=4,故该晶体的化学式为XF2,B项 错误。由于F的非金属性最强,在XeF4中Xe的化合价为+4价,分析XF4与HO的反应中各元素化 合价的变化可知,生成2 mol Xe转移8mol电子,C项正确。F2有强氧化性,能够与水反应,故XF2与 水反应不可能生成F2,D项错误。 18.某超分子的结构如图所示,下列有关超分子的描述不正确的是( C1H23 CuH23 A.超分子就是高分子 B.超分子的特征是分子识别和分子自组装 C图示中的超分子是两个不同的分子通过氢键形成的分子聚集体 D.图示中的超分子中的N原子采取sp2、sp两种杂化方式 答案A 解析超分子与高分子的概念不同,A项错误。超分子具有分子识别和分子自组装的特征,B项正确。 根据图示可看出该超分子是两个不同的分子通过氢键形成的分子聚集体,其中N原子采取S即3、$即 两种杂化方式成键,C、D项正确。 二、非选择题(本题包括6个小题,共64分) 19.(8分)W、X、Y、Z、N是短周期元素且其中只有一种金属元素,它们的核电荷数依次增大。 元素 元素性质或原子结构 原子核内无中子 原子核外s能级上的电子总数与P能级上的电子总数相等 元素的离子半径在该周期中最小 原子核外p能级上的电子总数比s能级上的电子总数多2 最外层电子数比次外层电子数少1 7
7 C.XeF4 与水反应时,每生成 2 mol Xe 转移 8 mol 电子 D.将 XeF2 加入水中,在水的作用下,将生成 Xe 和 F2 答案:C 解析:Xe 原子已经达到 8 电子稳定结构,故 XeF2 分子中各原子不可能均具有 8 电子稳定结构,A 项错 误。该晶胞中 Xe 原子的个数为 8× 1 8 +1=2,F 原子的个数为 8× 1 4 +2=4,故该晶体的化学式为 XeF2 ,B 项 错误。由于 F 的非金属性最强,在 XeF4 中 Xe 的化合价为+4 价,分析 XeF4 与 H2O 的反应中各元素化 合价的变化可知,生成 2 mol Xe 转移 8 mol 电子,C 项正确。F2 有强氧化性,能够与水反应,故 XeF2 与 水反应不可能生成 F2 ,D 项错误。 18.某超分子的结构如图所示,下列有关超分子的描述不正确的是( )。 A.超分子就是高分子 B.超分子的特征是分子识别和分子自组装 C.图示中的超分子是两个不同的分子通过氢键形成的分子聚集体 D.图示中的超分子中的 N 原子采取 sp2、sp3 两种杂化方式 答案:A 解析:超分子与高分子的概念不同,A 项错误。超分子具有分子识别和分子自组装的特征,B 项正确。 根据图示可看出该超分子是两个不同的分子通过氢键形成的分子聚集体,其中 N 原子采取 sp3、sp2 两种杂化方式成键,C、D 项正确。 二、非选择题(本题包括 6 个小题,共 64 分) 19.(8 分)W、X、Y、Z、N 是短周期元素且其中只有一种金属元素,它们的核电荷数依次增大。 元素 元素性质或原子结构 W 原子核内无中子 X 原子核外 s 能级上的电子总数与 p 能级上的电子总数相等 Y 元素的离子半径在该周期中最小 Z 原子核外 p 能级上的电子总数比 s 能级上的电子总数多 2 N 最外层电子数比次外层电子数少 1

志鸿优化系列丛书 志鸿优化网,永远提供更新的: 丛书主编任志湖。 http://www.zhyh.org (1)W单质的化学式为 ,Z元素原子核外有 个原子轨道填充了电子。 (2)Y、Z和N三种元素第一电离能由大到小的顺序为. (填元素符号)。 (3)X与Z两元素的电负性较大的是」 (填元素符号)。 (4)Z元素原子共有 种不同运动状态的电子。 答案1)H8 (2)CI>Si>AI (3)0 (4)14 解析根据题给信息可判断Y为金属元素,然后进行后续推断。原子核内无中子的元素是氢元素;原 子核外s能级电子数与p能级电子数相等的非金属元素原子的核外电子排布是1s22s22p,X为氧元 素;元素的离子半径在第三周期中最小的是A13+,Y为铝元素;原子核外s能级电子总数比p能级电子 总数少2的元素原子的核外电子排布是1s22s22p3s23p2,Z为硅元素;最外层电子数比次外层电子数少 1的元素是氯元素。核外有多少个电子就有多少种不同的运动状态。 20.(10分)硼砂是含结晶水的四硼酸钠。以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请 根据下列信息回答有关问题。 B H (1)硼砂中阴离子X(含B、O、H三种元素)的球棍模型如图所示,则在Xm中,2号硼原子的杂化类型 为 :4号硼原子是否参与形成配位键? (填“是”或“否”;m=(填数字)。 (2)BN中B的化合价为请解释原因: (3)BF3和过量NaF作用可生成NaBF4,BF4的空间结构为 :NaBF4的电子式 为 含案1)sp2是2 (2)+3价N的电负性大于B的电负性 。 :F: N:E:B:ET (3)正四面体形 8
8 (1)W 单质的化学式为 ,Z 元素原子核外有 个原子轨道填充了电子。 (2)Y、Z 和 N 三种元素第一电离能由大到小的顺序为 (填元素符号)。 (3)X 与 Z 两元素的电负性较大的是 (填元素符号)。 (4)Z 元素原子共有 种不同运动状态的电子。 答案:(1)H2 8 (2)Cl>Si>Al (3)O (4)14 解析:根据题给信息可判断 Y 为金属元素,然后进行后续推断。原子核内无中子的元素是氢元素;原 子核外 s 能级电子数与 p 能级电子数相等的非金属元素原子的核外电子排布是 1s22s22p4 ,X 为氧元 素;元素的离子半径在第三周期中最小的是 Al3+,Y 为铝元素;原子核外 s 能级电子总数比 p 能级电子 总数少 2 的元素原子的核外电子排布是 1s22s22p63s23p2 ,Z 为硅元素;最外层电子数比次外层电子数少 1 的元素是氯元素。核外有多少个电子就有多少种不同的运动状态。 20.(10 分)硼砂是含结晶水的四硼酸钠。以硼砂为原料,可以得到 BF3、BN 和硼酸等重要化合物,请 根据下列信息回答有关问题。 (1)硼砂中阴离子 X m- (含 B、O、H 三种元素)的球棍模型如图所示,则在 X m-中,2号硼原子的杂化类型 为 ;4 号硼原子是否参与形成配位键? (填“是”或“否”);m= (填数字)。 (2)BN 中 B 的化合价为 ,请解释原因: 。 (3)BF3 和过量 NaF 作用可生成 NaBF4,BF4 -的空间结构为 ;NaBF4 的电子式 为 。 答案:(1)sp2 是 2 (2)+3 价 N 的电负性大于 B 的电负性 (3)正四面体形

志鸿优化系列丛书 志鸿优化网永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org 解析根据图示可知,2号硼原子的价层电子对数为3,且无孤电子对,故采取sp2杂化:4号硼原子与3、 5、6号氧原子间形成σ键,与4号硼原子相连的另一个氧原子提供孤电子对,4号硼原子提供空轨道, 两者间形成配位键;根据图示可知,该阴离子的化学式为[H4B4Og],其中H显+1价、B显+3价、O显 -2价,所以m=2。由于电负性:N>B,所以BN中B显+3价,BF:的空间结构为正四面体形;NaBF4的电 :F: Na'[:F:B:F:T 子式为 :F: 。 21.(10分)1)配位化学创始人维尔纳发现,取CoCl36NH(黄色人CoC15NH(紫红色) CoCl34NH(绿色)和CoC34NH(紫色)四种化合物各1mol,分别溶于水,再加入足量硝酸银溶液,立 即产生氯化银沉淀,氯化银沉淀的物质的量分别为3mol、2mol、1mol和1mol。 请根据实验事实用配合物的形式写出它们的化学式。 CoCl36NH3: CoCl;5NH3: CoCl4NH(绿色和紫色): (2)锌和铝都是较活泼的金属,其氢氧化物既能溶于强酸溶液,又能溶于强碱溶液。但氢氧化铝不溶于 氨水,而氢氧化锌能溶于氨水,生成配合物离子[Z(NH)4]P+。请回答下列问题。 ①Z与氢氧化钠溶液反应的化学方程式为一。 ②写出向可溶性锌盐溶液中逐滴加入氨水过程中发生反应的离子方程 式 试解释在实验室不宜用可溶性锌盐与氨水反应制备氢氧化锌的原 因 ③实验室一瓶A1C13溶液中混有少量Zn2+,如何提纯? 答案1)[CoNH)6JCL,[Co(NH3)sCIC2 [Co(NH3)4Cl2]CI (2)①Zn+2 NaOH Na2ZnO2+H2↑ @Zn2++2NH3H2O Zn(OH)2J+2NH+, Zn(OH)2+4NHHC一[Zn(NH)4]2*+2OH+4HO可溶性锌盐与氨水反应产生的Zn(OH2沉淀可 溶于过量的氨水中生成[Zn(NH3)4]P+,氨水的量不容易控制 ③在混有少量Z2+的A1C,溶液中加入氨水到生成的沉淀不再减少为止,过滤出沉淀,用蒸馏水洗净, 然后再加入适量的盐酸将沉淀溶解 解析1)根据题给信息,将物质的量均为1mol的四种化合物分别与足量AgNO3溶液反应,生成AgCI 沉淀的物质的量为3mol、2mol、1mol和1mol,可知物质的量分别为1mol的四种配合物,能电离 9
9 解析:根据图示可知,2 号硼原子的价层电子对数为 3,且无孤电子对,故采取 sp2 杂化;4 号硼原子与 3、 5、6 号氧原子间形成 σ 键,与 4 号硼原子相连的另一个氧原子提供孤电子对,4 号硼原子提供空轨道, 两者间形成配位键;根据图示可知,该阴离子的化学式为[H4B4O9] m- ,其中 H 显+1 价、B 显+3 价、O 显 -2 价,所以 m=2。由于电负性:N>B,所以 BN 中 B 显+3 价,BF4 -的空间结构为正四面体形;NaBF4 的电 子式为 。 21.(10 分)(1)配位化学创始人维尔纳发现,取 CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、 CoCl3·4NH3(绿色)和 CoCl3·4NH3(紫色)四种化合物各 1 mol,分别溶于水,再加入足量硝酸银溶液,立 即产生氯化银沉淀,氯化银沉淀的物质的量分别为 3 mol、2 mol、1 mol 和 1 mol。 请根据实验事实用配合物的形式写出它们的化学式。 CoCl3·6NH3: ; CoCl3·5NH3: ; CoCl3·4NH3(绿色和紫色): 。 (2)锌和铝都是较活泼的金属,其氢氧化物既能溶于强酸溶液,又能溶于强碱溶液。但氢氧化铝不溶于 氨水,而氢氧化锌能溶于氨水,生成配合物离子[Zn(NH3)4] 2+。请回答下列问题。 ①Zn 与氢氧化钠溶液反应的化学方程式为 。 ②写出向可溶性锌盐溶液中逐滴加入氨水过程中发生反应的离子方程 式: ,试解释在实验室不宜用可溶性锌盐与氨水反应制备氢氧化锌的原 因: 。 ③实验室一瓶 AlCl3 溶液中混有少量 Zn2+ ,如何提纯? 。 答案:(1)[Co(NH3)6]Cl3 [Co(NH3)5Cl]Cl2 [Co(NH3)4Cl2]Cl (2)①Zn+2NaOH Na2ZnO2+H2↑ ②Zn2++2NH3·H2O Zn(OH)2↓+2NH4 +, Zn(OH)2+4NH3·H2O [Zn(NH3)4] 2++2OH-+4H2O 可溶性锌盐与氨水反应产生的 Zn(OH)2 沉淀可 溶于过量的氨水中生成[Zn(NH3)4] 2+ ,氨水的量不容易控制 ③在混有少量 Zn2+的 AlCl3 溶液中加入氨水到生成的沉淀不再减少为止,过滤出沉淀,用蒸馏水洗净, 然后再加入适量的盐酸将沉淀溶解 解析:(1)根据题给信息,将物质的量均为 1 mol 的四种化合物分别与足量 AgNO3 溶液反应,生成 AgCl 沉淀的物质的量为 3 mol、2 mol、1 mol 和 1 mol,可知物质的量分别为 1 mol 的四种配合物,能电离

志鸿优化系列丛书 志鸿优化网永远提供更新的! 丛书主编任志河。 http://www.zhyh.org 出来的CI即外界C1的物质的量分别为3mol、2mol、1mol、1mol,故它们的化学式分别为 [Co(NH3)6]Cl、[Co(NHs)5CI]C2、[CoNH)4C]CI、[Co(NH3)4C]Cl。 (2)Al与NaOH溶液反应的化学方程式为2Al+2NaOH+2HC一2 NaAlO2+3H↑,依此类比可写出锌 与氢氧化钠溶液反应的化学方程式为Zn+2 NaOH-Na2ZnO2+H2↑。可溶性锌盐溶液中逐滴加入气 水应先生成白色的Zn(OH2沉淀,当氦水过量时白色沉淀溶解得无色溶液,Zn(OH2沉淀转化为 [Z(NH3),]2+,氨水的量不容易控制。可利用Zn(OH2溶于氨水而AI(OH3不溶于氨水来进行提纯。 22.(10分)X、Z、Q、R、T为前四周期元素,且原子序数依次增大。X和Q属同族元素,X和R可形 成化合物XR4,R2为黄绿色气体;Z与X同周期且基态原子的s轨道和p轨道的电子总数相等:T2+的 3d轨道中有5个电子。请回答下列问题。 (1)Z基态原子的电子排布式是」 Z所在周期元素中,最高价氧化物对应的水化物酸性最强 的是(填化学式)。 (2)利用价层电子对互斥模型判断RZ4的空间结构是 :RZ的中心原子的杂化轨道类型 为」 (3)水中T含量超标,容易使洁具和衣物染色。RZ可以用来除去水中超标的T2+,生成黑色沉淀TZ2, 当消耗0.2 mol RZ2时,共转移了1mol电子,则反应的离子方程式 为 答案1)1s22s22pHN0 (2)正四面体形sp杂化 (3)2CI02+5Mn2+6H0—5MnO2J+2C1+12H 解析K、Z、Q、R、T为前四周期元素,且原子序数依次增大,R为黄绿色气体,则R为C1X和R可 形成化合物XR4,则X为+4价,处于第ⅣA族,X和Q属同族元素,可推知X为C、Q为SiZ与X(碳) 同周期且基态原子的s轨道和p轨道的电子总数相等,Z基态原子的核外电子排布为1s22s22p,故Z 为0,T2+的3d轨道中有5个电子,T的基态原子的核外电子排布式为1s22s22p3s23p3d54s2,则T为 Mno 23.(12分)C、Si元素组成的一些单质或化合物在科研领域中具有重要的作用。请回答下列问题。 (1)硅原子价层电子的轨道表示式中能量最低的是 3p, 3p、 30 3p, 3p. 马 3p 3p. 3p. 3s 3px 3p. 3p. D 10
10 出来的 Cl-即外界 Cl-的物质的量分别为 3 mol、2 mol、1 mol、1 mol,故它们的化学式分别为 [Co(NH3)6]Cl3、[Co(NH3)5Cl]Cl2、[Co(NH3)4Cl2]Cl、[Co(NH3)4Cl2]Cl。 (2)Al 与 NaOH 溶液反应的化学方程式为 2Al+2NaOH+2H2O 2NaAlO2+3H2↑,依此类比可写出锌 与氢氧化钠溶液反应的化学方程式为 Zn+2NaOH Na2ZnO2+H2↑。可溶性锌盐溶液中逐滴加入氨 水应先生成白色的 Zn(OH)2 沉淀,当氨水过量时白色沉淀溶解得无色溶液,Zn(OH)2 沉淀转化为 [Zn(NH3 ) 4 ] 2+ ,氨水的量不容易控制。可利用 Zn(OH)2 溶于氨水而 Al(OH)3 不溶于氨水来进行提纯。 22.(10 分)X、Z、Q、R、T 为前四周期元素,且原子序数依次增大。X 和 Q 属同族元素,X 和 R 可形 成化合物 XR4;R2 为黄绿色气体;Z 与 X 同周期且基态原子的 s 轨道和 p 轨道的电子总数相等;T2+的 3d 轨道中有 5 个电子。请回答下列问题。 (1)Z 基态原子的电子排布式是 ;Z 所在周期元素中,最高价氧化物对应的水化物酸性最强 的是 (填化学式)。 (2)利用价层电子对互斥模型判断 RZ4 -的空间结构是 ;RZ3 -的中心原子的杂化轨道类型 为 。 (3)水中 T 含量超标,容易使洁具和衣物染色。RZ2 可以用来除去水中超标的 T 2+ ,生成黑色沉淀 TZ2, 当消耗 0.2 mol RZ2 时,共转移了 1 mol 电子,则反应的离子方程式 为 。 答案:(1)1s22s22p4 HNO3 (2)正四面体形 sp3 杂化 (3)2ClO2+5Mn2++6H2O 5MnO2↓+2Cl-+12H+ 解析:X、Z、Q、R、T 为前四周期元素,且原子序数依次增大,R2 为黄绿色气体,则 R 为 Cl;X 和 R 可 形成化合物 XR4,则 X 为+4 价,处于第ⅣA 族,X 和 Q 属同族元素,可推知 X 为 C、Q 为 Si;Z 与 X(碳) 同周期且基态原子的 s 轨道和 p 轨道的电子总数相等,Z 基态原子的核外电子排布为 1s22s22p4 ,故 Z 为 O;T2+的 3d 轨道中有 5 个电子,T 的基态原子的核外电子排布式为 1s22s22p63s23p63d54s2 ,则 T 为 Mn。 23.(12 分)C、Si 元素组成的一些单质或化合物在科研领域中具有重要的作用。请回答下列问题。 (1)硅原子价层电子的轨道表示式中能量最低的是