
第1课时金属矿物的开发利用 课后·训练提升 1从石器、青铜器到铁器时代,金属的治炼体现了人类文明的发展水平。如图表示了三种金 属被人类开发利用的大致年限,之所以有先后,主要取决于( 约200年前 约6000年前 K Ca Na MgAIZn Fe Sn Pb(H)CuHgAg Pt Au 约2500年前 A金属的导电性强弱 B.金属在地壳中的含量多少 C.金属的化合价高低 D.金属的活动性强弱 答案D 解析由于人类掌握科学知识的局限性,越活泼的金属越难以冶炼,故发现年代越晚。 2.(双选)下列关于物质的制备原理错误的是()。 A.工业制备金属镁:2Na+MgCl2一2NaCl+Mg B工业生产铁Fe,0s+3C0高温2Fe+3CO, C.湿法炼铜:Fe+CuSO,Cu+FeSO4 D.以S为原料,工业生产硫酸在沸腾炉中的反应:2S+30一2$03 答案AD 解析A项,钠的金属性强于镁,但钠比镁贵重,工业操作要求经济价值较高,所以工业上不通过 高强 反应2Na+MgCl2一2NaCl+Mg冶炼金属镁,A项错误;工业生产铁的原理为Fe2O3+3CC 2Fe+3CO2,B项正确;湿法炼铜的原理为Fe+CuSO一Cu+FeSO4,C项正确:以S为原料,工业 高温 生产硫酸在沸腾炉中的反应为S+O2一SO2,S不能直接转化为SO3D项错误。 3.成语、诗词话科学一下列对成语或诗句所描述现象的解释中,你认为错误的是( 选项成语或诗句 用化学知识解释 A 唐代李白诗句“风吹柳花满店香” 这是生活中常见的一种分子扩散运动 B “烈火见真金” 金的性质稳定,在烈火中也不会发生反应 明代于谦诗句粉骨碎身浑不怕” 它指石灰石碾碎成粉末状的物理变化过程 D 成语“百炼成钢 通过反复锤炼,减少铁合金中碳元素的质量分数 答案0 解析诗句“粉骨碎身浑不怕”,描述的是生石灰遇水生成氢氧化钙的过程,是化学过程。 4.(双选)在治金工业上,均不能用通常化学还原剂制得的金属组是()。 A.Na、Mg、Al B.Na、K、Zn C.Fe、Cu、Ag D.Na、Ca、K 答案AD 解析A项,Na、Mg、Al都是非常活泼的金属,工业上采用电解熔融盐或氧化物的方法治炼 均不能用通常化学还原剂制得;B项,Zn是中等活泼金属,通常采用化学还原剂制得;C项,F、 C是中等活泼金属,通常采用化学还原剂制得,Ag是不活泼金属,通常采用热分解法冶炼;D 项,N、Ca、K都是非常活泼的金属,工业上采用电解熔融盐的方法冶炼,均不能用通常化学 还原剂制得。 5诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分 解催化剂。工业上治炼钼的化学反应过程为 ①2MoS2+70,高温 =2Mo03+4S0方
第 1 课时 金属矿物的开发利用 课后· 1.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。如图表示了三种金 属被人类开发利用的大致年限,之所以有先后,主要取决于( )。 A.金属的导电性强弱 B.金属在地壳中的含量多少 C.金属的化合价高低 D.金属的活动性强弱 答案 D 解析由于人类掌握科学知识的局限性,越活泼的金属越难以冶炼,故发现年代越晚。 2.(双选)下列关于物质的制备原理错误的是( )。 A.工业制备金属镁:2Na+MgCl2 2NaCl+Mg B.工业生产铁:Fe2O3+3CO 2Fe+3CO2 C.湿法炼铜:Fe+CuSO4 Cu+FeSO4 D.以 S 为原料,工业生产硫酸在沸腾炉中的反应:2S+3O2 2SO3 答案 AD 解析 A 项,钠的金属性强于镁,但钠比镁贵重,工业操作要求经济价值较高,所以工业上不通过 反应 2Na+MgCl2 2NaCl+Mg 冶炼金属镁,A 项错误;工业生产铁的原理为 Fe2O3+3CO 2Fe+3CO2,B 项正确;湿法炼铜的原理为 Fe+CuSO4 Cu+FeSO4,C 项正确;以 S 为原料,工业 生产硫酸在沸腾炉中的反应为 S+O2 SO2,S 不能直接转化为 SO3,D 项错误。 3.成语、诗词话科学——下列对成语或诗句所描述现象的解释中,你认为错误的是( )。 选项 成语或诗句 用化学知识解释 A 唐代李白诗句“风吹柳花满店香” 这是生活中常见的一种分子扩散运动 B “烈火见真金” 金的性质稳定,在烈火中也不会发生反应 C 明代于谦诗句“粉骨碎身浑不怕” 它指石灰石碾碎成粉末状的物理变化过程 D 成语“百炼成钢” 通过反复锤炼,减少铁合金中碳元素的质量分数 答案 C 解析诗句“粉骨碎身浑不怕”,描述的是生石灰遇水生成氢氧化钙的过程,是化学过程。 4.(双选)在冶金工业上,均不能用通常化学还原剂制得的金属组是( )。 A.Na、Mg、Al B.Na、K、Zn C.Fe、Cu、Ag D.Na、Ca、K 答案 AD 解析 A 项,Na、Mg、Al 都是非常活泼的金属,工业上采用电解熔融盐或氧化物的方法冶炼, 均不能用通常化学还原剂制得;B 项,Zn 是中等活泼金属,通常采用化学还原剂制得;C 项,Fe、 Cu 是中等活泼金属,通常采用化学还原剂制得,Ag 是不活泼金属,通常采用热分解法冶炼;D 项,Na、Ca、K 都是非常活泼的金属,工业上采用电解熔融盐的方法冶炼,均不能用通常化学 还原剂制得。 5.诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分 解催化剂。工业上冶炼钼的化学反应过程为 ①2MoS2+7O2 2MoO3+4SO2

2MoO3+2NH3H2O-(NH4)2MoO4+H2O 3(NH4)2MoO4+2HCl-H2MoO4J+2NH4CI ④HMoO,商温Mo0,+H0 ⑤用还原剂将MoO3还原成金属钼。 则下列说法中正确的是( )。 A.MoS2煅烧产生的尾气可直接排放 B.MoO3是金属氧化物,也是碱性氧化物 C.H2MoO4是一种强酸 D.利用H、CO和Al分别还原等量的MoO,所消耗还原剂的物质的量之比为3:3:2 答案D 解析A项,生成物SO2对环境污染严重,不能直接排放,错误;B项,根据②中生成物 (NH4)2MoO4可知,该化合物属于盐,对应的酸是HMoO4,故MoO3不属于碱性氧化物,错误:;C 项,根据反应③HMoO4是一种不溶性酸,溶液中c(H)不可能很大,故H2MoO4不可能是强酸 错误;D项,1molH2、1molC0和1 mol Al做还原剂时,失去的电子数分别为2mol、2mol 和3mol,还原等量的MoO3转移的电子数相同,此时nH2):n(CO):(A)=3:3:2,正确。 6.把铝粉和氧化亚铁粉末配成铝热剂,分成两等份。一份在高温下恰好完全反应后,再与足量 盐酸反应:另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体的质量 比是()。 A.3:2 B.2:3 C.1:1 D.28:9 答案c 解析铝能置换出铁,铁再与盐酸反应生成和铝直接与烧碱反应生成转移的电子数目相 同,化学方程式如下:2AI+3Fc0高 -Al2O3+3Fe.3Fe+6HCI3FeCl2+3H21:2Al+2NaOH+2H2O 一2 NaAIO2+3H2↑:由此可看出两种情况下生成的气体的质量比为1:1。 7.下列关于废旧金属的处理说法不正确的是()。 A对废旧金属的最好处理方法是回收、再利用 B.重金属对人体有害,对废旧重金属材料的处理方法是填埋 C.废旧钢铁可用于炼钢,废铁屑可用于制铁盐 D.照相业、科研单位和医院X光室回收的定影液中,可以提取金属银 答案B 解析重金属材科填埋将会对环境造成污染。 8(双选)以辉铜矿(CS)为原料治炼铜,其反应原理可表示为CuS+0高 =2Cu+S02。下列说 法不正确的是 A.化合价发生变化的元素有2种 B.Cu2S在该反应中,既是氧化剂,又是还原剂 C.1molO2参加上述反应时.反应转移的电子总物质的量为4mol D.SO2被分离、回收后氧化生成SO3,可作为制取硫酸的原料 答案AC +1-20高温0 +4-2 解标分析反应中化合价的变化:Cu25+022Cu+S02,反应过程中Cu、S、0三种元素 的化合价均发生改变,A项错误;Cu2S中Cu元素化合价降低,S元素化合价升高,因此CuS既 是氧化剂,又是还原剂,B项正确;根据S元素化合价的改变可知,当1olO2参加反应时,共转 移电子6mol,C项错误;SO2催化氧化可得SO3,SO3被水吸收可得H2SO4,D项正确。 9.铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁 的方法。某研究性学习小组的同学在实验室中模拟工业炼铁的过程,实验装置如下
②MoO3+2NH3·H2O (NH4)2MoO4+H2O ③(NH4)2MoO4+2HCl H2MoO4↓+2NH4Cl ④H2MoO4 MoO3+H2O ⑤用还原剂将 MoO3 还原成金属钼。 则下列说法中正确的是( )。 A.MoS2 煅烧产生的尾气可直接排放 B.MoO3 是金属氧化物,也是碱性氧化物 C.H2MoO4 是一种强酸 D.利用 H2、CO 和 Al 分别还原等量的 MoO3,所消耗还原剂的物质的量之比为 3∶3∶2 答案 D 解析 A 项,生成物 SO2 对环境污染严重,不能直接排放,错误;B 项,根据②中生成物 (NH4)2MoO4 可知,该化合物属于盐,对应的酸是 H2MoO4,故 MoO3 不属于碱性氧化物,错误;C 项,根据反应③H2MoO4 是一种不溶性酸,溶液中 c(H+ )不可能很大,故 H2MoO4 不可能是强酸, 错误;D 项,1 mol H2、1 mol CO 和 1 mol Al 做还原剂时,失去的电子数分别为 2 mol、2 mol 和 3 mol,还原等量的 MoO3 转移的电子数相同,此时 n(H2)∶n(CO)∶n(Al)=3∶3∶2,正确。 6.把铝粉和氧化亚铁粉末配成铝热剂,分成两等份。一份在高温下恰好完全反应后,再与足量 盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体的质量 比是( )。 A.3∶2 B.2∶3 C.1∶1 D.28∶9 答案 C 解析铝能置换出铁,铁再与盐酸反应生成 H2 和铝直接与烧碱反应生成 H2 转移的电子数目相 同,化学方程式如下:2Al+3FeO Al2O3+3Fe,3Fe+6HCl 3FeCl2+3H2↑;2Al+2NaOH+2H2O 2NaAlO2+3H2↑;由此可看出两种情况下生成的气体的质量比为 1∶1。 7.下列关于废旧金属的处理说法不正确的是( )。 A.对废旧金属的最好处理方法是回收、再利用 B.重金属对人体有害,对废旧重金属材料的处理方法是填埋 C.废旧钢铁可用于炼钢,废铁屑可用于制铁盐 D.照相业、科研单位和医院 X 光室回收的定影液中,可以提取金属银 答案 B 解析重金属材料填埋将会对环境造成污染。 8.(双选)以辉铜矿(Cu2S)为原料冶炼铜,其反应原理可表示为 Cu2S+O2 2Cu+SO2。下列说 法不正确的是 ( )。 A.化合价发生变化的元素有 2 种 B.Cu2S 在该反应中,既是氧化剂,又是还原剂 C.1 mol O2 参加上述反应时,反应转移的电子总物质的量为 4 mol D.SO2 被分离、回收后氧化生成 SO3,可作为制取硫酸的原料 答案 AC 解析分析反应中化合价的变化:Cu +1 2 S -2 + O 0 2 2Cu 0 + S +4 O -2 2 ,反应过程中 Cu、S、O 三种元素 的化合价均发生改变,A 项错误;Cu2S 中 Cu 元素化合价降低,S 元素化合价升高,因此 Cu2S 既 是氧化剂,又是还原剂,B 项正确;根据 S 元素化合价的改变可知,当 1 mol O2 参加反应时,共转 移电子 6 mol,C 项错误;SO2 催化氧化可得 SO3,SO3 被水吸收可得 H2SO4,D 项正确。 9.铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁 的方法。某研究性学习小组的同学在实验室中模拟工业炼铁的过程,实验装置如下:
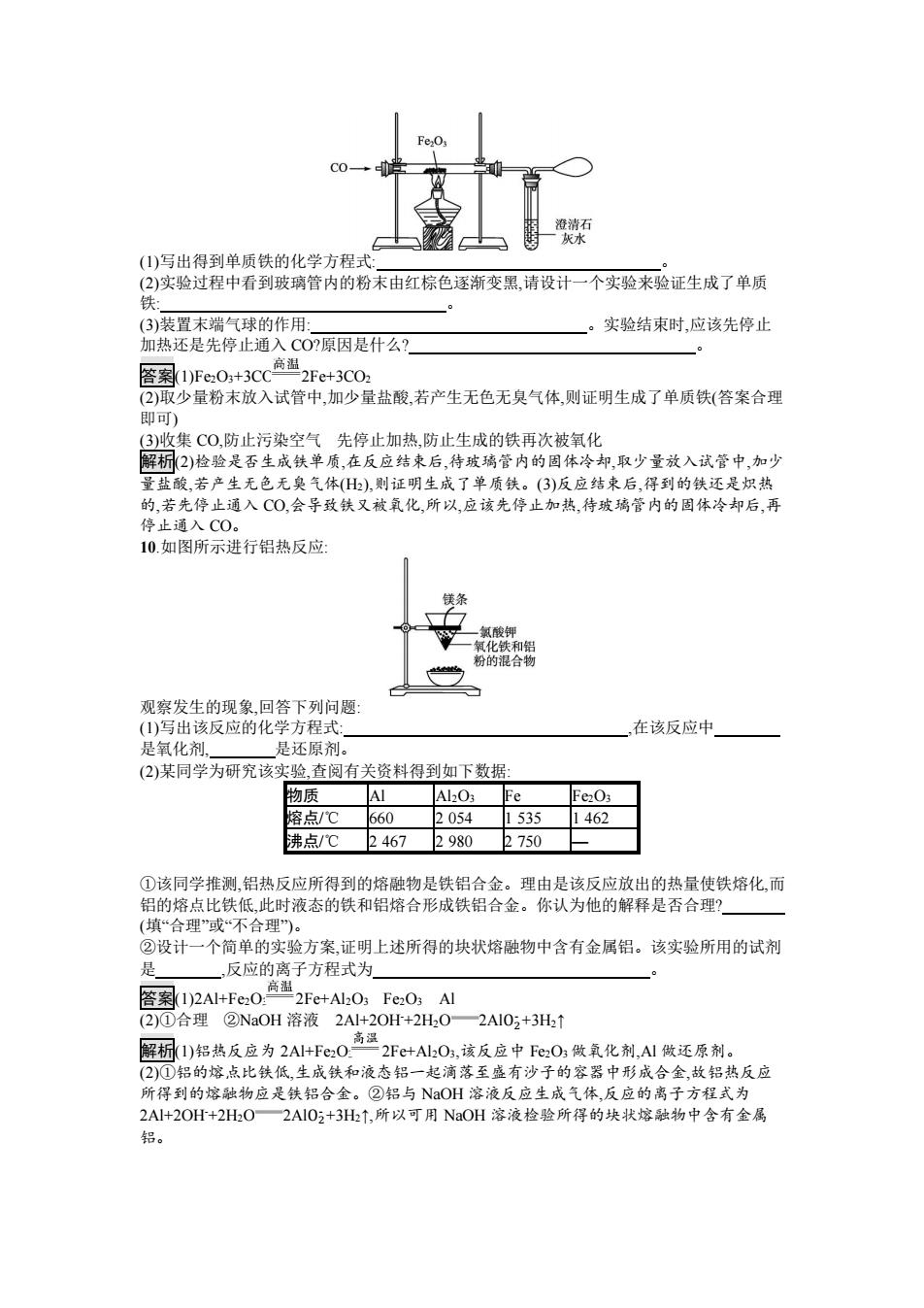
澄清石 灰水 (1)写出得到单质铁的化学方程式: (2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质 铁: (3)装置末端气球的作用: 实验结束时,应该先停止 加热还是先停止通入CO?原因是什么? 答案1)Fe,0,+3CC高温2Fe+3C0 (2)取少量粉末放入试管中,加少量盐酸,若产生无色无臭气体,则证明生成了单质铁(答案合理 即可) (3)收集CO,防止污染空气先停止加热,防止生成的铁再次被氧化 解析(2)检验是否生成铁单质,在反应结束后,待玻璃管内的固体冷却,取少量放入试管中,加少 量盐酸,若产生无色无臭气体(),则证明生成了单质铁。(3)反应结束后,得到的铁还是炽热 的,若先停止通入CO,会导致铁又被氧化,所以,应该先停止加热,待玻璃管内的固体冷却后,再 停止通入CO。 10.如图所示进行铝热反应 氯酸钾 氧化铁和铝 粉的混合物 观察发生的现象回答下列问题 (1)写出该反应的化学方程式: 在该反应中 是氧化剂 是还原剂。 (2)某同学为研究该实验,查阅有关资料得到如下数据: 物质 AI Al2O; Fe Fe203 熔点/℃ 660 2054 1535 1462 沸点/℃ 2467 2980 2750 ①该同学推测,铝热反应所得到的熔融物是铁铝合金。理由是该反应放出的热量使铁熔化,而 铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理? (填“合理”或“不合理)。 ②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用的试剂 是 ,反应的离子方程式为 含率12AI+Fc,0高2Fc+A0,FeO,A (2)①合理②NaOH溶液2A+2OH+2H02AI02+3H2↑ 解1)铝热反应为2AI+Fc,0高温2Fe+Ab0,该反应中Fe,05微氧化剂,A1做还原剂。 (2)①铝的熔,点比铁低,生成铁和液态铝一起滴落至盛有沙子的容器中形成合金,故铝热反应 所得到的熔融物应是铁铝合金。②铝与NOH溶液反应生成气体,反应的离子方程式为 2A+2OH+2H2O2AIO2+3H↑,所以可用NaOH溶液检验所得的块状熔融物中含有金属 铝
(1)写出得到单质铁的化学方程式: 。 (2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质 铁: 。 (3)装置末端气球的作用: 。实验结束时,应该先停止 加热还是先停止通入 CO?原因是什么? 。 答案(1)Fe2O3+3CO 2Fe+3CO2 (2)取少量粉末放入试管中,加少量盐酸,若产生无色无臭气体,则证明生成了单质铁(答案合理 即可) (3)收集 CO,防止污染空气 先停止加热,防止生成的铁再次被氧化 解析(2)检验是否生成铁单质,在反应结束后,待玻璃管内的固体冷却,取少量放入试管中,加少 量盐酸,若产生无色无臭气体(H2),则证明生成了单质铁。(3)反应结束后,得到的铁还是炽热 的,若先停止通入 CO,会导致铁又被氧化,所以,应该先停止加热,待玻璃管内的固体冷却后,再 停止通入 CO。 10.如图所示进行铝热反应: 观察发生的现象,回答下列问题: (1)写出该反应的化学方程式: ,在该反应中 是氧化剂, 是还原剂。 (2)某同学为研究该实验,查阅有关资料得到如下数据: 物质 Al Al2O3 Fe Fe2O3 熔点/℃ 660 2 054 1 535 1 462 沸点/℃ 2 467 2 980 2 750 — ①该同学推测,铝热反应所得到的熔融物是铁铝合金。理由是该反应放出的热量使铁熔化,而 铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理? (填“合理”或“不合理”)。 ②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用的试剂 是 ,反应的离子方程式为 。 答案(1)2Al+Fe2O3 2Fe+Al2O3 Fe2O3 Al (2)①合理 ②NaOH 溶液 2Al+2OH-+2H2O 2AlO2 - +3H2↑ 解析(1)铝热反应为 2Al+Fe2O3 2Fe+Al2O3,该反应中 Fe2O3 做氧化剂,Al 做还原剂。 (2)①铝的熔点比铁低,生成铁和液态铝一起滴落至盛有沙子的容器中形成合金,故铝热反应 所得到的熔融物应是铁铝合金。②铝与 NaOH 溶液反应生成气体,反应的离子方程式为 2Al+2OH-+2H2O 2AlO2 - +3H2↑,所以可用 NaOH 溶液检验所得的块状熔融物中含有金属 铝