
第2课时化学反应与电能 课后·训练提升 合格考基础巩固 1.下列设备工作时可以将化学能转化为电能的是( A.手机电池 B.硅太阳能电池 上游水位进水闸门 拦污槽 水答气下游水位 导管 C.水力发电 D.电烤箱 答案A 解析手机电池工作时可以将化学能转化为电能,A项正确:硅太阳能电池工作时可以将太阳 能转化为电能,B项错误;水力发电是将水的机械能转化为电能,C项错误;电烤箱工作时可以 将电能转化为热能等,D项错误。 2.下列四个化学反应不可用于设计原电池的是()。 A.2Al+2NaOH+2H2O-2NaAlO2+3H21 点燃 B.2H2+022H20 C.Mg3N2+6H2O3Mg(OH)2+2NH31 DCH+20,点燃 =C02+2H2O 答案c 解析只有氧化还原反应才能用于设计原电池。A、B、D属于氧化还原反应,均可以设计为 原电池。C不属于氧化还原反应,不能设计成原电池。 3.为探究原电池的形成条件和反应原理,某同学设计了如下实验,并记录了实验现象: ①向一定浓度的稀硫酸中插入锌片,看到有气泡生成: ②向上述浓度的稀硫酸中插入铜片,没有气泡生成: ③将锌片与铜片上端接触并捏住一起插入上述浓度的稀硫酸中,看到铜片上有气泡生成.且 生成气泡的速率比实验(①中的大: ④在锌片和铜片中间接上电流计,再将锌片和铜片插入上述浓度的稀疏酸中,发现电流计指针 偏转。 下列关于以上实验设计及现象的分析,不正确的是 ()。 A实验①、②说明锌能与稀硫酸反应而铜不能 B.实验③说明发生原电池反应时可以加快反应 C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气 D.实验③、④说明该原电池中铜为正极、锌为负极 答案C 4.用如图所示装置进行实验,若下图中x轴表示流入正极的电子的物质的量,则y轴可以表示 ()。 ①c(Ag)②cN0)③a棒的质量④b棒的质量 ⑤溶液的质量
第 2 课时 化学反应与电能 课后· 合格考基础巩固 1.下列设备工作时可以将化学能转化为电能的是( )。 A.手机电池 B.硅太阳能电池 C.水力发电 D.电烤箱 答案 A 解析手机电池工作时可以将化学能转化为电能,A 项正确;硅太阳能电池工作时可以将太阳 能转化为电能,B 项错误;水力发电是将水的机械能转化为电能,C 项错误;电烤箱工作时可以 将电能转化为热能等,D 项错误。 2.下列四个化学反应不可用于设计原电池的是( )。 A.2Al+2NaOH+2H2O 2NaAlO2+3H2↑ B.2H2+O2 2H2O C.Mg3N2+6H2O 3Mg(OH)2+2NH3↑ D.CH4+2O2 CO2+2H2O 答案 C 解析只有氧化还原反应才能用于设计原电池。A、B、D 属于氧化还原反应,均可以设计为 原电池。C 不属于氧化还原反应,不能设计成原电池。 3.为探究原电池的形成条件和反应原理,某同学设计了如下实验,并记录了实验现象: ①向一定浓度的稀硫酸中插入锌片,看到有气泡生成; ②向上述浓度的稀硫酸中插入铜片,没有气泡生成; ③将锌片与铜片上端接触并捏住,一起插入上述浓度的稀硫酸中,看到铜片上有气泡生成,且 生成气泡的速率比实验①中的大; ④在锌片和铜片中间接上电流计,再将锌片和铜片插入上述浓度的稀硫酸中,发现电流计指针 偏转。 下列关于以上实验设计及现象的分析,不正确的是 ( )。 A.实验①、②说明锌能与稀硫酸反应而铜不能 B.实验③说明发生原电池反应时可以加快反应 C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气 D.实验③、④说明该原电池中铜为正极、锌为负极 答案 C 4.用如图所示装置进行实验,若下图中 x 轴表示流入正极的电子的物质的量,则 y 轴可以表示 ( )。 ①c(Ag+ ) ②c(NO3 - ) ③a 棒的质量 ④b 棒的质量 ⑤溶液的质量
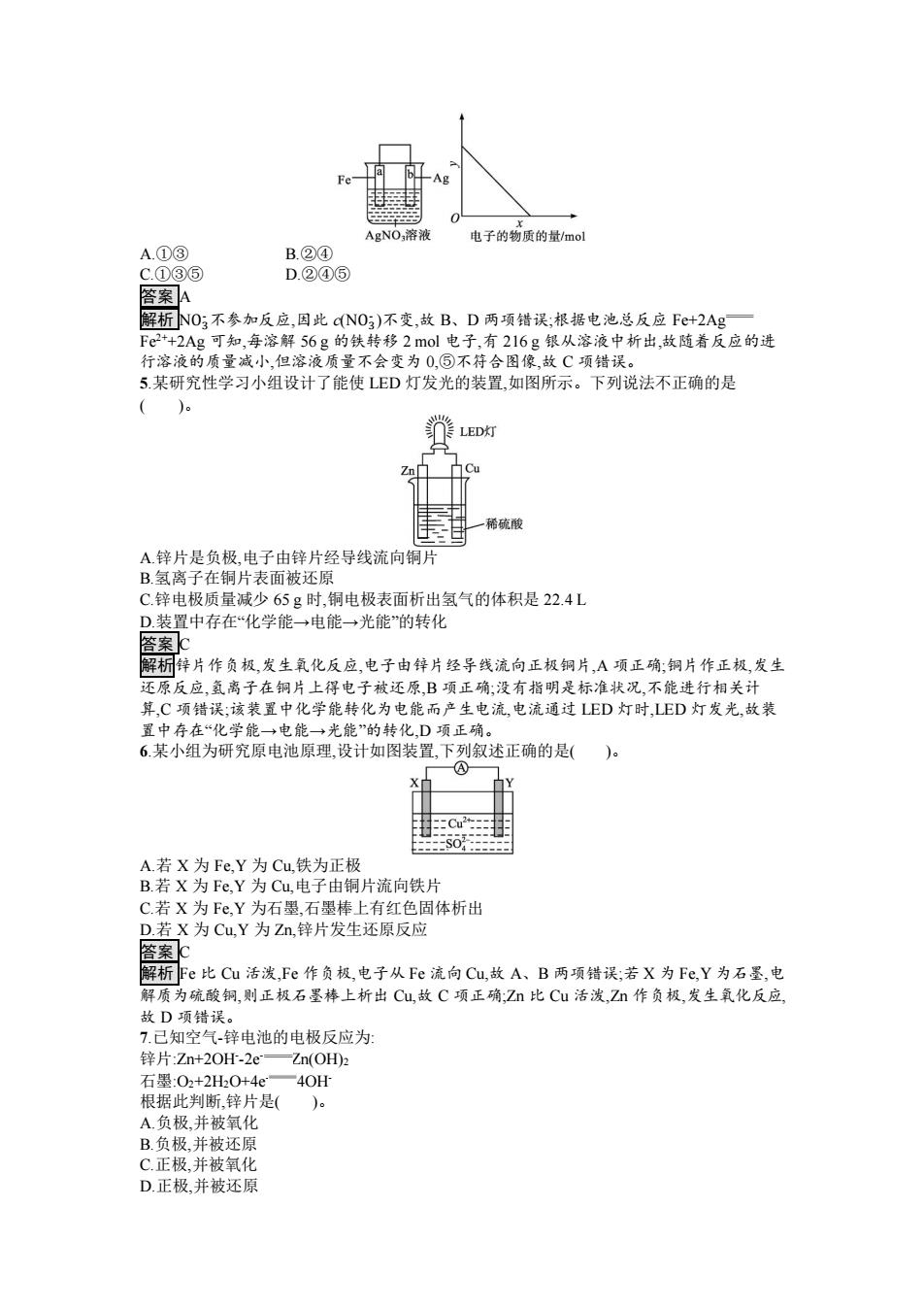
AgNO:溶液 电子的物质的量/mol A.①③ B.②④ c.①③⑤ D.②④⑤ 答案A 解析NO;不参加反应,因此cNO;)不变,故B、D两项错误:根据电池总反应Fε+2Ag F2+2Ag可知,每溶解56g的铁转移2mol电子,有216g银从溶液中析出,故随着反应的进 行溶液的质量减小,但溶液质量不会变为0,⑤不符合图像,故C项错误。 5.某研究性学习小组设计了能使LED灯发光的装置,如图所示。下列说法不正确的是 ()。 LED灯 稀硫酸 A锌片是负极,电子由锌片经导线流向铜片 B.氢离子在铜片表面被还原 C.锌电极质量减少65g时,铜电极表面析出氢气的体积是22.4L D.装置中存在“化学能→电能→光能”的转化 答案c 解桐锌片作负极,发生氧化反应,电子由锌片经导线流向正极铜片,A项正确:铜片作正极,发生 还原反应,氢离子在铜片上得电子被还原B项正确:没有指明是标准状况,不能进行相关计 算,C项错误;该装置中化学能转化为电能而产生电流,电流通过LED灯时,LED灯发光,故装 置中存在“化学能→电能→光能”的转化,D项正确。 6某小组为研究原电池原理,设计如图装置,下列叙述正确的是()。 A.若X为Fe,Y为Cu,铁为正极 B.若X为Fe,Y为Cu,电子由铜片流向铁片 C.若X为Fe,Y为石墨,石墨棒上有红色固体析出 D.若X为Cu,Y为Zn,锌片发生还原反应 答案c 解析Fe比Cu活泼,Fe作负极,电子从Fe流向Cu,故A、B两项错误;若X为Fe,Y为石墨,电 解质为硫酸铜,则正极石墨棒上析出Cu,故C项正确:Zn比Cu活泼,Zn作负极,发生氧化反应 故D项错误。 7.己知空气-锌电池的电极反应为: 锌片:Zn+2OH-2e一Zn(OH2 石墨:02+2H20+4e一40H 根据此判断,锌片是( )。 A.负极,并被氧化 B.负极并被还原 C.正极.并被氧化 D.正极,并被还原
A.①③ B.②④ C.①③⑤ D.②④⑤ 答案 A 解析 NO3 - 不参加反应,因此 c(NO3 - )不变,故 B、D 两项错误;根据电池总反应 Fe+2Ag+ Fe2++2Ag 可知,每溶解 56 g 的铁转移 2 mol 电子,有 216 g 银从溶液中析出,故随着反应的进 行溶液的质量减小,但溶液质量不会变为 0,⑤不符合图像,故 C 项错误。 5.某研究性学习小组设计了能使 LED 灯发光的装置,如图所示。下列说法不正确的是 ( )。 A.锌片是负极,电子由锌片经导线流向铜片 B.氢离子在铜片表面被还原 C.锌电极质量减少 65 g 时,铜电极表面析出氢气的体积是 22.4 L D.装置中存在“化学能→电能→光能”的转化 答案 C 解析锌片作负极,发生氧化反应,电子由锌片经导线流向正极铜片,A 项正确;铜片作正极,发生 还原反应,氢离子在铜片上得电子被还原,B 项正确;没有指明是标准状况,不能进行相关计 算,C 项错误;该装置中化学能转化为电能而产生电流,电流通过 LED 灯时,LED 灯发光,故装 置中存在“化学能→电能→光能”的转化,D 项正确。 6.某小组为研究原电池原理,设计如图装置,下列叙述正确的是( )。 A.若 X 为 Fe,Y 为 Cu,铁为正极 B.若 X 为 Fe,Y 为 Cu,电子由铜片流向铁片 C.若 X 为 Fe,Y 为石墨,石墨棒上有红色固体析出 D.若 X 为 Cu,Y 为 Zn,锌片发生还原反应 答案 C 解析 Fe 比 Cu 活泼,Fe 作负极,电子从 Fe 流向 Cu,故 A、B 两项错误;若 X 为 Fe,Y 为石墨,电 解质为硫酸铜,则正极石墨棒上析出 Cu,故 C 项正确;Zn 比 Cu 活泼,Zn 作负极,发生氧化反应, 故 D 项错误。 7.已知空气-锌电池的电极反应为: 锌片:Zn+2OH- -2e- Zn(OH)2 石墨:O2+2H2O+4e- 4OH- 根据此判断,锌片是( )。 A.负极,并被氧化 B.负极,并被还原 C.正极,并被氧化 D.正极,并被还原
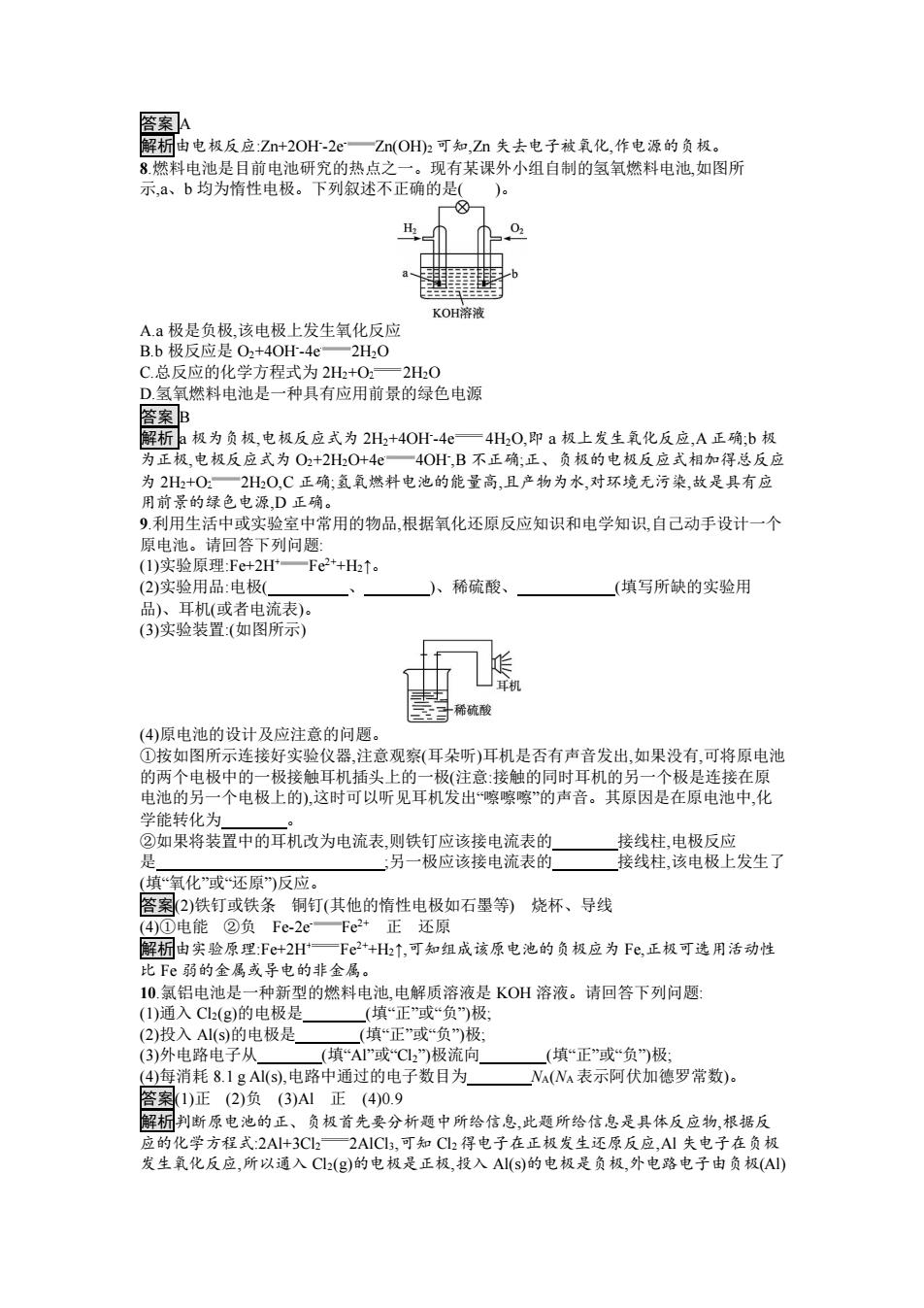
答案A 解析由电极反应:Zn+2OH-2eZn(OH)2可知,Zn失去电子被氧化,作电源的负极。 8燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所 示,a、b均为惰性电极。下列叙述不正确的是( KOH溶液 A.a极是负极,该电极上发生氧化反应 B.b极反应是O2+4OH-4e一2H2O C.总反应的化学方程式为2H2+O2一2H0 D氢氧燃料电池是一种具有应用前景的绿色电源 答案B 解析a极为负极,电极反应式为2H2+4OH-4e一4H0,即a极上发生氧化反应,A正确:b极 为正极,电极反应式为O2+2H2O+4一4OH,B不正确:正、负极的电极反应式相加得总反应 为2H2+O一2H2O,C正确:氢氧燃料电池的能量高,且产物为水,对环境无污染,故是具有应 用前景的绿色电源D正确。 9.利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个 原电池。请回答下列问题: (1)实验原理:Fe+2H一Fe2+H↑。 (2)实验用品:电极( )、 稀硫酸、 (填写所缺的实验用 品)、耳机(或者电流表)。 (3)实验装置(如图所示) 稀硫酸 (4)原电池的设计及应注意的问题。 ①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池 的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原 电池的另一个电极上的),这时可以听见耳机发出嚓嚓嚓”的声音。其原因是在原电池中,化 学能转化为 ②如果将装置中的耳机改为电流表,则铁钉应该接电流表的 接线柱,电极反应 :另一极应该接电流表的 接线柱,该电极上发生了 (填“氧化”或还原反应。 答案2)铁钉或铁条铜钉(其他的惰性电极如石墨等)烧杯、导线 (4)①电能②负Fe-2eFe2+正还原 懈桐由实验原理Fe+2H一F2+H2↑,可知组成该原电池的负极应为Fe,正极可选用活动性 比Fe弱的金属或导电的非金属。 10.氯铝电池是一种新型的燃料电池,电解质溶液是KOH溶液。请回答下列问题! (1)通入C1(g)的电极是(填“正”或“负”)极 (2)投入AI(s)的电极是 (填“正”或“负)极: (3)外电路电子从 (填“A”或C2)极流向 (填“正”或“负)极 (4)每消耗81gA1(s),电路中通过的电子数目为 NA(Na表示阿伏加德罗常数)。 答案1)正(2)负(3)A1正(4)0.9 解析判断原电池的正、负极首先要分析题中所给信息,此题所给信息是具体反应物,根据反 应的化学方程式:2A+3C2一2A1C3,可知Cl2得电子在正极发生还原反应,Al失电子在负极 发生氧化反应,所以通入Cl2(g)的电极是正极,投入AI(s)的电极是负极,外电路电子由负极(AI)
答案 A 解析由电极反应:Zn+2OH- -2e- Zn(OH)2 可知,Zn 失去电子被氧化,作电源的负极。 8.燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所 示,a、b 均为惰性电极。下列叙述不正确的是( )。 A.a 极是负极,该电极上发生氧化反应 B.b 极反应是 O2+4OH- -4e- 2H2O C.总反应的化学方程式为 2H2+O2 2H2O D.氢氧燃料电池是一种具有应用前景的绿色电源 答案 B 解析 a 极为负极,电极反应式为 2H2+4OH- -4e- 4H2O,即 a 极上发生氧化反应,A 正确;b 极 为正极,电极反应式为 O2+2H2O+4e- 4OH- ,B 不正确;正、负极的电极反应式相加得总反应 为 2H2+O2 2H2O,C 正确;氢氧燃料电池的能量高,且产物为水,对环境无污染,故是具有应 用前景的绿色电源,D 正确。 9.利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个 原电池。请回答下列问题: (1)实验原理:Fe+2H+ Fe2++H2↑。 (2)实验用品:电极( 、 )、稀硫酸、 (填写所缺的实验用 品)、耳机(或者电流表)。 (3)实验装置:(如图所示) (4)原电池的设计及应注意的问题。 ①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池 的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原 电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓”的声音。其原因是在原电池中,化 学能转化为 。 ②如果将装置中的耳机改为电流表,则铁钉应该接电流表的 接线柱,电极反应 是 ;另一极应该接电流表的 接线柱,该电极上发生了 (填“氧化”或“还原”)反应。 答案(2)铁钉或铁条 铜钉(其他的惰性电极如石墨等) 烧杯、导线 (4)①电能 ②负 Fe-2e- Fe2+ 正 还原 解析由实验原理:Fe+2H+ Fe2++H2↑,可知组成该原电池的负极应为 Fe,正极可选用活动性 比 Fe 弱的金属或导电的非金属。 10.氯铝电池是一种新型的燃料电池,电解质溶液是 KOH 溶液。请回答下列问题: (1)通入 Cl2(g)的电极是 (填“正”或“负”)极; (2)投入 Al(s)的电极是 (填“正”或“负”)极; (3)外电路电子从 (填“Al”或“Cl2”)极流向 (填“正”或“负”)极; (4)每消耗 8.1 g Al(s),电路中通过的电子数目为 NA(NA 表示阿伏加德罗常数)。 答案(1)正 (2)负 (3)Al 正 (4)0.9 解析判断原电池的正、负极首先要分析题中所给信息,此题所给信息是具体反应物,根据反 应的化学方程式:2Al+3Cl2 2AlCl3,可知 Cl2 得电子在正极发生还原反应,Al 失电子在负极 发生氧化反应,所以通入 Cl2(g)的电极是正极,投入 Al(s)的电极是负极,外电路电子由负极(Al)

宽向正极。81gAlS)的物质的量为270,3mol1molA1反应转移3mol电于,0.3m0l A1反应在电路中通过的电子数目为0.9NA。 等级考拓展提高 1.(双选)某原电池总反应的离子方程式为2Fe3+F(一3Fe2+,该原电池的合理组成是()。 A.正极为Cu,负极为Fe,电解质溶液为FeCl溶液 B.正极为石墨,负极是Fe,电解质溶液为Fe2(SO4)3溶液 C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液 答案AB 解析该原电池总反应的离子方程式为2Fe3+Fc一3F2+,铁离子得电子被还原,则可溶性铁盐 溶液为电解质溶液,Fe失电子发生氧化反应,则F作负极,不如Fe活泼的金属或导电的非金 属作正极。Fe作负极,Cu作正极,氯化铁溶液为电解质溶液,符合题给信息,A项正确:Fe比石 墨活泼,则Fe作负极,石墨作正极,硫酸铁溶液为电解质溶液,符合题给信息,B项正确,Zn比F® 活泼,则Z作负极.不符合题给信息,C项错误:电解质为硫酸铜.应该为可溶性铁盐.D项错 误。 2.(双选)在金属活动性顺序中,a、b均排在氢前面,a可以从b的硝酸盐溶液中置换出b。将 a、b用导线相连放入CuSO4溶液中,下列叙述不正确的是()。 A.导线上有电流,电流方向由a到b B.a极质量减小,b极质量增大 C.b极上析出氢气 D.a极发生氧化反应,b极发生还原反应 答案AC 解析a可以从b的硝酸盐溶液中置换出b,说明金属活动性a>b。将a、b用导线相连放入 CuSO4溶液中,构成原电池,a是负极,b是正极。导线上有电流,电流方向由b到aA项错误在 该原电池中,极为负极,发生失电子的氧化反应,质量减小,b极为正极,发生得电子的还原反 应生成Cu,质量增大B项正确:b极上发生的电极反应为Cu+2一Cu.不会生成氢气.C项 错误;极为负极,发生失电子的氧化反应,b极为正极发生得电子的还原反应,D项正确。 3.目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系, 下列说法中错误的是( )。 太阳能 光分解催化剂 H0 电能 H2+02 氢发电机 燃料电池 A.燃料电池能够使化学反应产生的能量转化为电能 B.燃料电池中通入H的一极作负极,发生氧化反应 通电 C.在此循环中发生了反应:2H0兰2H↑+O2↑ D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂 答案 解析原电池都是将化学能转化为电能的装置,故A正确;氢氧燃料电池的负极通入H2,发生氧 化反应;正极通入O2,发生还原反应,故B正确;题述循环过程中HO分解为H和O2的条件 是光、催化剂,故C错误;推广氢能的关键是寻找合适的催化剂,利用太阳能分解水,故D正 确。 4.X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,Z极上有H2放 出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知MP+的氧化性强于Y2+。则这四种金属的活 动性由强到弱的顺序为()。 A.X>Z>Y>M B.X>Y>Z>M
流向正极。8.1 g Al(s)的物质的量为 8.1 g 27 g·mol -1=0.3 mol,1 mol Al 反应转移 3 mol 电子,0.3 mol Al 反应在电路中通过的电子数目为 0.9NA。 等级考拓展提高 1.(双选)某原电池总反应的离子方程式为 2Fe3++Fe 3Fe2+ ,该原电池的合理组成是( )。 A.正极为 Cu,负极为 Fe,电解质溶液为 FeCl3 溶液 B.正极为石墨,负极是 Fe,电解质溶液为 Fe2(SO4)3 溶液 C.正极为 Fe,负极为 Zn,电解质溶液为 Fe2(SO4)3 溶液 D.正极为 Ag,负极为 Fe,电解质溶液为 CuSO4 溶液 答案 AB 解析该原电池总反应的离子方程式为 2Fe3++Fe 3Fe2+ ,铁离子得电子被还原,则可溶性铁盐 溶液为电解质溶液,Fe 失电子发生氧化反应,则 Fe 作负极,不如 Fe 活泼的金属或导电的非金 属作正极。Fe 作负极,Cu 作正极,氯化铁溶液为电解质溶液,符合题给信息,A 项正确;Fe 比石 墨活泼,则 Fe 作负极,石墨作正极,硫酸铁溶液为电解质溶液,符合题给信息,B 项正确;Zn 比 Fe 活泼,则 Zn 作负极,不符合题给信息,C 项错误;电解质为硫酸铜,应该为可溶性铁盐,D 项错 误。 2.(双选)在金属活动性顺序中,a、b 均排在氢前面,a 可以从 b 的硝酸盐溶液中置换出 b。将 a、b 用导线相连放入 CuSO4 溶液中,下列叙述不正确的是( )。 A.导线上有电流,电流方向由 a 到 b B.a 极质量减小,b 极质量增大 C.b 极上析出氢气 D.a 极发生氧化反应,b 极发生还原反应 答案 AC 解析 a 可以从 b 的硝酸盐溶液中置换出 b,说明金属活动性 a>b。将 a、b 用导线相连放入 CuSO4 溶液中,构成原电池,a 是负极,b 是正极。导线上有电流,电流方向由 b 到 a,A 项错误;在 该原电池中,a 极为负极,发生失电子的氧化反应,质量减小,b 极为正极,发生得电子的还原反 应生成 Cu,质量增大,B 项正确;b 极上发生的电极反应为 Cu2++2e- Cu,不会生成氢气,C 项 错误;a 极为负极,发生失电子的氧化反应,b 极为正极,发生得电子的还原反应,D 项正确。 3.目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系, 下列说法中错误的是( )。 A.燃料电池能够使化学反应产生的能量转化为电能 B.燃料电池中通入 H2 的一极作负极,发生氧化反应 C.在此循环中发生了反应:2H2O 2H2↑+O2↑ D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂 答案 C 解析原电池都是将化学能转化为电能的装置,故 A 正确;氢氧燃料电池的负极通入 H2,发生氧 化反应;正极通入 O2,发生还原反应,故 B 正确;题述循环过程中 H2O 分解为 H2 和 O2 的条件 是光、催化剂,故 C 错误;推广氢能的关键是寻找合适的催化剂,利用太阳能分解水,故 D 正 确。 4.X、Y、Z、M 代表四种金属元素,金属 X 和 Z 用导线连接放入稀硫酸中时,Z 极上有 H2 放 出;若电解 Y2+和 Z 2+共存的溶液时,Y 先析出;又知 M2+的氧化性强于 Y2+。则这四种金属的活 动性由强到弱的顺序为( )。 A.X>Z>Y>M B.X>Y>Z>M

C.M->Z>X>Y D.X>Z>M>Y 答案A 解析金属X和Z用导线连接放入稀硫酸中时,Z极上有氢气放出,所以X是负极,Z是正极,金 属的活动性X>Z,若电解Y2+和Z2+共存的溶液时,Y先析出,说明Y2+氧化性强于Z2+,所以金 属的活动性Z>Y:M2+的氧化性强于Y2+所以金属的活动性Y>M。综上可知四种金属的活动 性由强到弱的顺序为X>>Y>M。 5.(双选)由质量均为10g的铁片、铜片和足量的Cu$04溶液组成原电池装置,经过一段时间 后,两电极的质量差变为12g,则下列说法正确的是( )。 A.铁片溶解了5.6g B.导线中通过了0.2mol电子 C.铜片上析出了6gCu D.铜片溶解了6.4g 答案AB 解析负极反应式为Fe-2e一Fe2+,正极反应式为Cu2*+2e一Cu,设有x mol Fe在负极上反 应,则正极生成x mol Cu,(10+64x)-(10-56x)=12,x=0.1,则m(Fe)=0.1mol×56gmol1=5.6g,A项 正确:x=0.1,则转移电子的物质的量为0.2mol,B项正确;在正极上析出的铜为m(Cu)=0.1 mol×64gmol=6.4g,而不是铜片溶解,C、D两项错误。 6甲、乙两位同学均想利用原电池反应检测金属的活动性顺序两人均用镁片和铝片作电极 但甲同学将电极放入6mol-L1的HSO4溶液中,乙同学将电极放入6molL1的NaOH溶液 中,如图所示。 HSO溶液 NaOH溶液 甲 (1)写出甲中正极的电极反应式: (2)乙中负极为 ,总反应的离子方程式: (3)若甲与乙同学均认为构成原电池的电极材料如果都是金属,则负极材料的金属应比正极 材料的金属活泼”,则甲会判断出 金属活动性更强,而乙会判断出金属活动性 更强。(填写元素符号) (4)由此实验得出的下列结论中,正确的有 A利用原电池反应判断金属活动性顺序时应注意选择合适的介质 B.镁的金属性不一定比铝的金属性强 C.该实验说明金属活动性顺序已过时,没有实用价值了 D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 答案1)2H+2e一H↑ (2)A12A1+2OH+2H202A102+3H2↑ (3)Mg Al (4)AD 解析甲同学依据的化学反应原理是Mg+HSO,一MgSO4+H↑,乙同学依据的化学反应原理 是2Al+2NaOH+2H2O一2 NaAlO2+3H2↑。但是由于Al与碱的反应是一特例,不可作为判断 金属活动性强弱的依据。所以判断一个原电池的正、负极应具体问题具体分析。 挑战创新 如下图所示装置可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸 时)和碱式(当电解质溶液为NaOH溶液或KOH溶液时)两种。请回答下列问题:
C.M>Z>X>Y D.X>Z>M>Y 答案 A 解析金属 X 和 Z 用导线连接放入稀硫酸中时,Z 极上有氢气放出,所以 X 是负极,Z 是正极,金 属的活动性 X>Z;若电解 Y2+和 Z 2+共存的溶液时,Y 先析出,说明 Y2+氧化性强于 Z 2+ ,所以金 属的活动性 Z>Y;M2+的氧化性强于 Y2+ ,所以金属的活动性 Y>M。综上可知四种金属的活动 性由强到弱的顺序为 X>Z>Y>M。 5.(双选)由质量均为 10 g 的铁片﹑铜片和足量的 CuSO4 溶液组成原电池装置,经过一段时间 后,两电极的质量差变为 12 g,则下列说法正确的是( )。 A.铁片溶解了 5.6 g B.导线中通过了 0.2 mol 电子 C.铜片上析出了 6 g Cu D.铜片溶解了 6.4 g 答案 AB 解析负极反应式为 Fe-2e- Fe2+ ,正极反应式为 Cu2++2e- Cu,设有 x mol Fe 在负极上反 应,则正极生成 x mol Cu,(10+64x)-(10-56x)=12,x=0.1,则 m(Fe)=0.1 mol×56 g·mol-1=5.6 g,A 项 正确;x=0.1,则转移电子的物质的量为 0.2 mol,B 项正确;在正极上析出的铜为 m(Cu)=0.1 mol×64 g·mol-1=6.4 g,而不是铜片溶解,C、D 两项错误。 6.甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极, 但甲同学将电极放入 6 mol·L -1 的 H2SO4 溶液中,乙同学将电极放入 6 mol·L -1 的 NaOH 溶液 中,如图所示。 (1)写出甲中正极的电极反应式: 。 (2)乙中负极为 ,总反应的离子方程式: 。 (3)若甲与乙同学均认为“构成原电池的电极材料如果都是金属,则负极材料的金属应比正极 材料的金属活泼”,则甲会判断出 金属活动性更强,而乙会判断出 金属活动性 更强。(填写元素符号) (4)由此实验得出的下列结论中,正确的有 。 A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 B.镁的金属性不一定比铝的金属性强 C.该实验说明金属活动性顺序已过时,没有实用价值了 D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 答案(1)2H++2e- H2↑ (2)Al 2Al+2OH-+2H2O 2AlO2 - +3H2↑ (3)Mg Al (4)AD 解析甲同学依据的化学反应原理是 Mg+H2SO4 MgSO4+H2↑,乙同学依据的化学反应原理 是 2Al+2NaOH+2H2O 2NaAlO2+3H2↑。但是由于 Al 与碱的反应是一特例,不可作为判断 金属活动性强弱的依据。所以判断一个原电池的正、负极应具体问题具体分析。 挑战创新 如下图所示装置可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸 时)和碱式(当电解质溶液为 NaOH 溶液或 KOH 溶液时)两种。请回答下列问题:

H,O 电 电 H OH 氧 合 H+一OH 入口 电解质溶液H,O 负极 正极 氢氧燃料电池示意图 (1)酸式电池的电极反应,负极: 正极: :电池总反应 电解质溶液pH的变化 (填“变大“变小”或“不变”。 (2)碱式电池的电极反应,负极: 正极: :电池总反应 电解质溶液pH的变化 (填变大变小”或“不变”。 答1)2H2-4e—4HO2+4H+4e一2H02H+02一2H0变大 (2)2H+4OH-4e4H0O2+2H0+4e一4OH2H+022H0变小 解析1)正极上,O2得电子变为O2,溶液中O2不能单独存在,酸性条件下与H结合生成HO 负极上,H2失电子变为H,H进入电解质溶液。电池总反应为H2与O2反应生成H2O,由于有 HO生成,溶液将逐渐变稀,故电解质溶液的pH增大。 (2)正极上,O2得电子变为O2,溶液中02不能单独存在,碱性条件下与H0分子结合生成 OH:负极上,H失去电子变为H,碱性条件下H不能大量存在,与OH结合生成水。电池总反 应也是H与O2反应生成水。由于有水生成,c(OH)变小,电解质溶液的pH变小
氢氧燃料电池示意图 (1)酸式电池的电极反应,负极: , 正极: ;电池总反应: ; 电解质溶液 pH 的变化 (填“变大”“变小”或“不变”)。 (2)碱式电池的电极反应,负极: , 正极: ;电池总反应: ; 电解质溶液 pH 的变化 (填“变大”“变小”或“不变”)。 答案(1)2H2-4e- 4H+ O2+4H++4e- 2H2O 2H2+O2 2H2O 变大 (2)2H2+4OH- -4e- 4H2O O2+2H2O+4e- 4OH- 2H2+O2 2H2O 变小 解析(1)正极上,O2 得电子变为 O2- ,溶液中 O2-不能单独存在,酸性条件下与 H+结合生成 H2O; 负极上,H2 失电子变为 H+ ,H+进入电解质溶液。电池总反应为 H2 与 O2 反应生成 H2O,由于有 H2O 生成,溶液将逐渐变稀,故电解质溶液的 pH 增大。 (2)正极上,O2 得电子变为 O2- ,溶液中 O2-不能单独存在,碱性条件下与 H2O 分子结合生成 OH- ;负极上,H2 失去电子变为 H+ ,碱性条件下 H+不能大量存在,与 OH-结合生成水。电池总反 应也是 H2 与 O2 反应生成水。由于有水生成,c(OH- )变小,电解质溶液的 pH 变小