
第五章过关检测 (时间:90分钟满分:100分) 一、选择题(本题共10小题,每小题2分,共20分。在每小题给出的四个选项中, 只有一项符合题目要求) 1.下列物质不能用于吸收HS的是()。 A.NaOH溶液 B.FeSO4溶液 C.CuCl2溶液 D.酸性KMnO4溶液 答案B 解析HS能与NaOH溶液反应生成硫化钠和水,所以NaOH溶液能用于吸收HS,故A项不 符合题意;HS的酸性弱于硫酸,所以FSO4溶液不能用于吸收HS,故B项符合题意;HS与 CuC2溶液反应生成更难溶的CuS沉淀,所以CuC2溶液能用于吸收HS,故C项不符合题 意,HS具有还原性,能被酸性KMnO4溶液氧化,所以酸性KMnO4溶液能用于吸收HS,故D 项不符合题意。 2.下列说法正确的是()。 A实验室用氯化铵溶液与氢氧化钙溶液混合制取氨 B.雷雨天气时空气中能生成少量的氮氧化物 C铵盐易溶于水,化学性质稳定,受热不易分解 D.O2、NO、NO2都能用浓硫酸干燥,且通常情况下能大量共存 含案B 解桐实验室用氯化铵与氢氧化钙的固体混合物在加热条件下制取氨,A项错误;放电条件下, 氮气与氧气反应生成NO,B项正确;绝大多数铵盐易溶于水,受热易分解,C项错误NO极易与 O2反应,两者不能大量共存,D项错误。 3.下列说法正确的是()。 A.在未知液中滴加BaC2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知液中存在 S0?或S02 B.由矿盐生产食盐,除去S0最合适的试剂是Ba(NO)2 C.用BaCl2溶液和稀盐酸鉴别S0与S0 D.向溶液中滴加酸化的BaNO)2溶液出现白色沉淀,说明该溶液中一定有S0 答案 解析由于加入了C,如果原溶液中无S0?、S0?,但存在Ag,也能生成不溶于稀硝酸的白色 沉淀,A项错误;由矿盐生产食盐,除去SO?最合适的试剂为BaC2,若用BaNO3)2会引入杂质 离子N0;,B项错误:加入盐酸酸化的BaCl2溶液,产生气泡的是S0好,产生白色沉淀的是 S0好,C项正确;当溶液中含有SO时,加入酸化的BaNO3)2溶液也会出现白色沉淀,D项错 误。 4.下列气体组合中,都能用如图所示装置进行喷泉实验的是(注:胶头滴管和烧杯内均为NOH 溶液)()
第五章过关检测 (时间:90 分钟 满分:100 分) 一、选择题(本题共 10 小题,每小题 2 分,共 20 分。在每小题给出的四个选项中, 只有一项符合题目要求) 1.下列物质不能用于吸收 H2S 的是( )。 A.NaOH 溶液 B.FeSO4 溶液 C.CuCl2 溶液 D.酸性 KMnO4 溶液 答案 B 解析 H2S 能与 NaOH 溶液反应生成硫化钠和水,所以 NaOH 溶液能用于吸收 H2S,故 A 项不 符合题意;H2S 的酸性弱于硫酸,所以 FeSO4 溶液不能用于吸收 H2S,故 B 项符合题意;H2S 与 CuCl2 溶液反应生成更难溶的 CuS 沉淀,所以 CuCl2 溶液能用于吸收 H2S,故 C 项不符合题 意;H2S 具有还原性,能被酸性 KMnO4 溶液氧化,所以酸性 KMnO4 溶液能用于吸收 H2S,故 D 项不符合题意。 2.下列说法正确的是( )。 A.实验室用氯化铵溶液与氢氧化钙溶液混合制取氨 B.雷雨天气时空气中能生成少量的氮氧化物 C.铵盐易溶于水,化学性质稳定,受热不易分解 D.O2、NO、NO2 都能用浓硫酸干燥,且通常情况下能大量共存 答案 B 解析实验室用氯化铵与氢氧化钙的固体混合物在加热条件下制取氨,A 项错误;放电条件下, 氮气与氧气反应生成 NO,B 项正确;绝大多数铵盐易溶于水,受热易分解,C 项错误;NO 极易与 O2 反应,两者不能大量共存,D 项错误。 3.下列说法正确的是( )。 A.在未知液中滴加 BaCl2 溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知液中存在 SO4 2-或 SO3 2- B.由矿盐生产食盐,除去 SO4 2-最合适的试剂是 Ba(NO3)2 C.用 BaCl2 溶液和稀盐酸鉴别 SO4 2-与 SO3 2- D.向溶液中滴加酸化的 Ba(NO3)2 溶液出现白色沉淀,说明该溶液中一定有 SO4 2- 答案 C 解析由于加入了 Cl- ,如果原溶液中无 SO4 2-、SO3 2- ,但存在 Ag+ ,也能生成不溶于稀硝酸的白色 沉淀,A 项错误;由矿盐生产食盐,除去 SO4 2-最合适的试剂为 BaCl2,若用 Ba(NO3)2 会引入杂质 离子 NO3 - ,B 项错误;加入盐酸酸化的 BaCl2 溶液,产生气泡的是 SO3 2- ,产生白色沉淀的是 SO4 2- ,C 项正确;当溶液中含有 SO3 2-时,加入酸化的 Ba(NO3)2 溶液也会出现白色沉淀,D 项错 误。 4.下列气体组合中,都能用如图所示装置进行喷泉实验的是(注:胶头滴管和烧杯内均为 NaOH 溶液)( )

d A.HCI和CO2 B.NH和H C.SOh和CO D.CO2和C0 答案A 解析H、CO不溶于NaOH溶液,也不与NaOH溶液反应,所以不能做喷泉实验,而HCI、 SO2、CO2不仅可溶于NaOH溶液,还可与NaOH溶液反应,所以能形成喷泉。 5.一定温度下,Iol金属铜与足量某浓度的硝酸完全反应,生成NO2和NO的物质的量之比 为1:3,则反应过程中转移的电子为( )o A.2 mol B.3 mol C.4 mol D.5 mol 答案A 解析由题意可知,硝酸过量,铜完全反应,根据得失电子守恒可知,铜失去的电子数=HNO得到 的电子数=反应中转移的电子数。1mol金属铜全部转化为Cu2+时失去2mol电子,因此该反 应过程中转移电子的物质的量为2mol。 6.下列关于物质性质的叙述正确的是()。 A.C12能与金属活动性顺序中的大多数金属反应 B.N2是大气中的主要成分之一,雷雨时,可直接转化为NO2 C硫是一种淡黄色的能溶于水的晶体,既有氧化性,又有还原性 D.硅是应用广泛的半导体材料,常温下化学性质活泼 答案A 解析C具有较强的氧化性,能与金属活动性顺序中大多数金属反应,A项正确;雷雨时N2与 O2反应可生成NO,而不是NO2,B项错误;硫不溶于水,C项错误;硅在常温下化学性质不活 泼,D项错误。 7有下列物品或设备:①门窗玻璃、②水晶镜片、③石英钟表、④玛瑙手镯、⑤硅太阳能电 池、⑥光导纤维、⑦计算机芯片、⑧陶瓷餐具、⑨水泥路桥。其中所用材料为SO2的是 ()。 A.①②③④⑥ B.①②③④⑤⑥⑦⑧⑨ c.⑤⑦ D.①②⑥⑦ 答案A 解析所用材料为$iO2的是①②③④⑥,⑤⑦用到的是硅单质,⑧⑨为硅酸盐产品。 8.下列事实可以用同一原理解释的是( )。 A.SO2、Cl2均能使品红溶液褪色 B.NH4HCO3晶体、固体碘受热均能变成气体 C.S与铁、铜反应均生成低价硫化物
A.HCl 和 CO2 B.NH3 和 H2 C.SO2 和 CO D.CO2 和 CO 答案 A 解析 H2、CO 不溶于 NaOH 溶液,也不与 NaOH 溶液反应,所以不能做喷泉实验,而 HCl、 SO2、CO2 不仅可溶于 NaOH 溶液,还可与 NaOH 溶液反应,所以能形成喷泉。 5.一定温度下,1 mol 金属铜与足量某浓度的硝酸完全反应,生成 NO2 和 NO 的物质的量之比 为 1∶3,则反应过程中转移的电子为( )。 A.2 mol B.3 mol C.4 mol D.5 mol 答案 A 解析由题意可知,硝酸过量,铜完全反应,根据得失电子守恒可知,铜失去的电子数=HNO3 得到 的电子数=反应中转移的电子数。1 mol 金属铜全部转化为 Cu2+时失去 2 mol 电子,因此该反 应过程中转移电子的物质的量为 2 mol。 6.下列关于物质性质的叙述正确的是( )。 A.Cl2 能与金属活动性顺序中的大多数金属反应 B.N2 是大气中的主要成分之一,雷雨时,可直接转化为 NO2 C.硫是一种淡黄色的能溶于水的晶体,既有氧化性,又有还原性 D.硅是应用广泛的半导体材料,常温下化学性质活泼 答案 A 解析 Cl2 具有较强的氧化性,能与金属活动性顺序中大多数金属反应,A 项正确;雷雨时 N2 与 O2 反应可生成 NO,而不是 NO2,B 项错误;硫不溶于水,C 项错误;硅在常温下化学性质不活 泼,D 项错误。 7.有下列物品或设备:①门窗玻璃、②水晶镜片、③石英钟表、④玛瑙手镯、⑤硅太阳能电 池、⑥光导纤维、⑦计算机芯片、⑧陶瓷餐具、⑨水泥路桥。其中所用材料为 SiO2 的是 ( )。 A.①②③④⑥ B.①②③④⑤⑥⑦⑧⑨ C.⑤⑦ D.①②⑥⑦ 答案 A 解析所用材料为 SiO2 的是①②③④⑥,⑤⑦用到的是硅单质,⑧⑨为硅酸盐产品。 8.下列事实可以用同一原理解释的是( )。 A.SO2、Cl2 均能使品红溶液褪色 B.NH4HCO3 晶体、固体碘受热均能变成气体 C.S 与铁、铜反应均生成低价硫化物

D.CIO与S2-、H均不能在溶液中大量共存 答案c 解析A项,SO2能使品红溶液褪色是因为SO2与品红结合为无色物质,C使品红溶液褪色是 因为C2与水反应生成的HCIO能氧化漂白品红.不符合题意:B项NH4HCO晶体受热分解 变成气体,固体碘受热升华变成气体,不符合题意:C项,S与铁、铜反应均生成低价硫化物,是 因为S的氧化性较弱,符合题意:D项,CIO与S2发生氧化还原反应,CIO与H结合生成HCIO, 不符合题意。 9.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下 列各组物质:①Cu与HNO3溶液、②Cu与FeCl3溶液、③Zn与HSO4溶液、④Fe与HCI 溶液,其中由于浓度不同而能发生不同氧化还原反应的是()。 A.①③ B.②④ c.①② D.①③④ 答案A 解析一般而言,同种氧化剂,浓度大的氧化性强。Cu与稀硝酸反应的还原产物是NO,C1与浓 硝酸反应的还原产物是NO2:Zn与稀硫酸反应的还原产物是2,Zn与浓硫酸反应的还原产 物是S02。 10.如图所示装置,烧瓶中充满干燥气体a将滴管中的液体b挤入烧瓶中,然后打开弹簧夹,不 能出现“喷泉现象”,则a、b对应物质正确的是( 选项 a(干燥气体)b(液体) 装置 HCI H2O Cl2 饱和NaCI溶液 S02 浓NaOH溶液 1 molL的盐 NH: 酸 客案B 解桐干燥气体a与液体b发生反应,或溶于液体b,导致烧瓶内气体的压强小于外界大气压,即 能出现“喷泉现象”。HCI极易溶于水,能出现“喷泉现象”,A项不符合题意;Cl2在饱和NaCl溶 液中溶解度较小,不能出现e喷泉现象”B项符合题意:SOh与浓NOH溶液发生反应生成 NaSO3,能出现“喷泉现象”,C项不符合题意,NH3与盐酸发生反应生成NH4CL,能出现“喷泉现 象”,D项不符合题意。 二、选择题(本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合 题目要求,全部选对得4分,选对但不全得2分,有选错的得0分) 11.下列实验过程中,能观察到明显现象的是()。 ANO2通入FeSO4溶液中 B.CO2通入CaClz溶液中 C.NH3通入AICl3溶液中 D.SO2通入NaOH溶液中 答案AC 解析NO2通入FeSO4溶液中,NO2与水反应生成的HNO3能将Fe2+氧化为Fe3+,溶液由浅绿 色变为黄色,A项正确:CaC2溶液显中性,向其中通入CO2,无明显现象,B项错误,NH通入
D.ClO-与 S 2-、H+均不能在溶液中大量共存 答案 C 解析 A 项,SO2 能使品红溶液褪色是因为 SO2 与品红结合为无色物质,Cl2 使品红溶液褪色是 因为 Cl2 与水反应生成的 HClO 能氧化漂白品红,不符合题意;B 项,NH4HCO3 晶体受热分解 变成气体,固体碘受热升华变成气体,不符合题意;C 项,S 与铁、铜反应均生成低价硫化物,是 因为 S 的氧化性较弱,符合题意;D 项,ClO-与S 2 -发生氧化还原反应,ClO-与 H+结合生成 HClO, 不符合题意。 9.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下 列各组物质:①Cu 与 HNO3 溶液、②Cu 与 FeCl3 溶液、③Zn 与 H2SO4 溶液、④Fe 与 HCl 溶液,其中由于浓度不同而能发生不同氧化还原反应的是( )。 A.①③ B.②④ C.①② D.①③④ 答案 A 解析一般而言,同种氧化剂,浓度大的氧化性强。Cu 与稀硝酸反应的还原产物是 NO,Cu 与浓 硝酸反应的还原产物是 NO2;Zn 与稀硫酸反应的还原产物是 H2,Zn 与浓硫酸反应的还原产 物是 SO2。 10.如图所示装置,烧瓶中充满干燥气体 a,将滴管中的液体 b 挤入烧瓶中,然后打开弹簧夹,不 能出现“喷泉现象”,则 a、b 对应物质正确的是( )。 选项 a(干燥气体) b(液体) 装置 A HCl H2O B Cl2 饱和 NaCl 溶液 C SO2 浓 NaOH 溶液 D NH3 1 mol·L -1 的盐 酸 答案 B 解析干燥气体 a 与液体 b 发生反应,或溶于液体 b,导致烧瓶内气体的压强小于外界大气压,即 能出现“喷泉现象”。HCl 极易溶于水,能出现“喷泉现象”,A 项不符合题意;Cl2 在饱和 NaCl 溶 液中溶解度较小,不能出现“喷泉现象”,B 项符合题意;SO2 与浓 NaOH 溶液发生反应生成 Na2SO3,能出现“喷泉现象”,C 项不符合题意;NH3 与盐酸发生反应生成 NH4Cl,能出现“喷泉现 象”,D 项不符合题意。 二、选择题(本题共 5 小题,每小题 4 分,共 20 分。每小题有一个或两个选项符合 题目要求,全部选对得 4 分,选对但不全得 2 分,有选错的得 0 分) 11.下列实验过程中,能观察到明显现象的是( )。 A.NO2 通入 FeSO4 溶液中 B.CO2 通入 CaCl2 溶液中 C.NH3 通入 AlCl3 溶液中 D.SO2 通入 NaOH 溶液中 答案 AC 解析 NO2 通入 FeSO4 溶液中,NO2 与水反应生成的 HNO3 能将 Fe2+氧化为 Fe3+ ,溶液由浅绿 色变为黄色,A 项正确;CaCl2 溶液显中性,向其中通入 CO2,无明显现象,B 项错误;NH3 通入

AICl3溶液中:AI+3NHHO一AI(OH3+3NH,产生AI(OH3沉淀,C项正确SO2通入 NaOH溶液中,发生化学反应但是无明显现象,D项错误。 12.下列说法正确的是()。 A.Fe与稀硝酸、稀硫酸反应均有气泡产生,说明Fe与两种酸均发生置换反应 B.过量的铜与浓硝酸反应没有一氧化氮生成 C.在浓硝酸中加入过量铁粉并加热:Fc+3N05+6H△Fe+3NO,t+3H0 D.用浓硝酸与Cu反应制备NO2 答案D 解析A项,铁与稀硝酸的反应不是置换反应,铁与稀硫酸的反应是置换反应,错误:B项,铜先与 浓硝酸反应生成NO2,随着反应的进行,硝酸变稀,铜再与稀硝酸反应生成NO,错误;C项,铁过 量时,应该生成F2+,错误;D项,铜与浓硝酸反应生成NO2,正确。 13.如图是M元素在高中阶段常见物质的价类二维图。其中A到D、D到E的转化都可以 加同一种物质实现,且E的相对分子质量比D的相对分子质量大16,下列说法正确的是 ()。 ---E ==-=--=--=D -----C --B 十-A 氢化物单质氧化物含氧酸正盐 物质类别 A汽油燃料中主要含有M元素,所以汽车尾气中通常含有大量D而导致环境问题 B.检验I中阳离子的方法:向其样品中加强碱,产生的气体可使湿润的蓝色石蕊试纸变红 C.物质F的浓溶液可以用铁制容器盛放 D.物质B属于共价化合物 答案cD 解析根据图像和题意可知,A为NH3,B为N2H4,C为N2,D为NO,E为NO2,F为HNO,G为硝 酸盐,I为铵盐。汽油主要含有C、H元素,A项错误;检验NH的方法:向样品中加强碱,产生 的气体使湿润的红色石蕊试纸变蓝,B项错误;物质F为硝酸,浓硝酸与铁发生钝化,可以用铁 制容器盛放,C项正确;物质B为联氨(HN一NH),属于共价化合物,D项正确。 14.如图为含硫物质的转化示意图。常温常压下,甲、乙均为气体,丙为液体,丁为固体。下列 关于甲、乙、丙、丁的判断不正确的是( )。 -H2SO: 火山喷发 H,0 硫化物氧气、水燕气,石膏、芒硝 A.甲与乙反应时,甲表现氧化性 B.乙、丙均为酸性氧化物 C.乙使品红溶液和溴水褪色的原理相同 D.丁为黄色固体 答案AC
AlCl3 溶液中:Al3++3NH3·H2O Al(OH)3↓+3NH4 +,产生 Al(OH)3 沉淀,C 项正确;SO2 通入 NaOH 溶液中,发生化学反应但是无明显现象,D 项错误。 12.下列说法正确的是( )。 A.Fe 与稀硝酸、稀硫酸反应均有气泡产生,说明 Fe 与两种酸均发生置换反应 B.过量的铜与浓硝酸反应没有一氧化氮生成 C.在浓硝酸中加入过量铁粉并加热:Fe+3NO3 - +6H+ Fe3++3NO2↑+3H2O D.用浓硝酸与 Cu 反应制备 NO2 答案 D 解析 A 项,铁与稀硝酸的反应不是置换反应,铁与稀硫酸的反应是置换反应,错误;B 项,铜先与 浓硝酸反应生成 NO2,随着反应的进行,硝酸变稀,铜再与稀硝酸反应生成 NO,错误;C 项,铁过 量时,应该生成 Fe2+ ,错误;D 项,铜与浓硝酸反应生成 NO2,正确。 13.如图是 M 元素在高中阶段常见物质的价类二维图。其中 A 到 D、D 到 E 的转化都可以 加同一种物质实现,且 E 的相对分子质量比 D 的相对分子质量大 16,下列说法正确的是 ( )。 A.汽油燃料中主要含有 M 元素,所以汽车尾气中通常含有大量 D 而导致环境问题 B.检验 I 中阳离子的方法:向其样品中加强碱,产生的气体可使湿润的蓝色石蕊试纸变红 C.物质 F 的浓溶液可以用铁制容器盛放 D.物质 B 属于共价化合物 答案 CD 解析根据图像和题意可知,A 为 NH3,B 为 N2H4,C 为 N2,D 为 NO,E 为 NO2,F 为 HNO3,G 为硝 酸盐,I 为铵盐。汽油主要含有 C、H 元素,A 项错误;检验 NH4 +的方法:向样品中加强碱,产生 的气体使湿润的红色石蕊试纸变蓝,B 项错误;物质 F 为硝酸,浓硝酸与铁发生钝化,可以用铁 制容器盛放,C 项正确;物质 B 为联氨(H2N—NH2),属于共价化合物,D 项正确。 14.如图为含硫物质的转化示意图。常温常压下,甲、乙均为气体,丙为液体,丁为固体。下列 关于甲、乙、丙、丁的判断不正确的是( )。 A.甲与乙反应时,甲表现氧化性 B.乙、丙均为酸性氧化物 C.乙使品红溶液和溴水褪色的原理相同 D.丁为黄色固体 答案 AC

解析根据题意可推知,甲、乙、丙、丁分别为HS、SO2、SO、S。HS与SO2反应生成S 和H2O,HS中硫元素化合价升高,被氧化,HS表现还原性,A项错误。SO2、SO3均能与碱反 应生成盐和水,均为酸性氧化物,B项正确。SO2有漂白性,能使品红溶液褪色;SO2有还原性, 能与溴水发生氧化还原反应而使溴水褪色,原理不同,C项错误。单质S为黄色固体,D项正 确。 15.将a mL NO、b mL NO2、xmLO2混合装于同一试管里,将试管口倒插于水中,充分反应后 试管内气体全部消失,则用a、b表示的x的代数式是()。 A学 B2a+b 3 C3atb D4a+b 4 5 答案 解桐氨的氧化物与O2和HO反应生成HNO时,只要满足氮的氧化物中的N与氨的氧化物 中的0和02中0的和的比为2:5即可全部转化,没有气体剩余。即0+ x-3atb 41 三、非选择题(本题共5小题,共60分) 16.(12分)非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题: 0E°E包 (I)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。 ①D的化学式是 ②在工业生产中大量排放的B气体被雨水吸收后形成 而污染了环境。 (2)若A在常温下为气体,C是红棕色的气体。 ①A、C的化学式分别是A C ②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程 式 。该反应 (填“属于”或“不属于”氧化还原反 应。 答案(1)①HSO4②酸雨 (2)①N2NO2②Cu+4HNO(浓)CuNO3)2+2NO2↑+2H0属于 解析1)若B是能使品红溶液褪色的有刺激性气味的无色气体,则B是SO2,A是单质S,C是 SO3,D是H2SO4;若大量排放SO2,则会形成酸雨。 (2)若C是红棕色气体,则C为NO2,B为NO,A为N2,D为HNO5,浓硝酸可与Cu反 应:4HNO(浓)+Cu一Cu(NO)2+2NO2↑+2H2O.此反应有化合价升降变化,属于氧化还原反 应。 17.(12分)(1)SiO2在自然界中广泛存在,它是制备现代通信材料 (写该 材料名称)的主要原料;以SO2为原料,在工业上制备单质硅的反应的化学方程式 为 ;在常温下,$O2可与一种酸发生反应,该反应的化学方程式 为 该反应的重要应用是 (2)向一定体积的18olL的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积 (填“大于等于”或“小于”100mL。若欲使剩余的铜片 继续溶解,可向其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式 为
解析根据题意可推知,甲、乙、丙、丁分别为 H2S、SO2、SO3、S。H2S 与 SO2 反应生成 S 和 H2O,H2S 中硫元素化合价升高,被氧化,H2S 表现还原性,A 项错误。SO2、SO3 均能与碱反 应生成盐和水,均为酸性氧化物,B 项正确。SO2 有漂白性,能使品红溶液褪色;SO2 有还原性, 能与溴水发生氧化还原反应而使溴水褪色,原理不同,C 项错误。单质 S 为黄色固体,D 项正 确。 15.将 a mL NO、b mL NO2、x mL O2 混合装于同一试管里,将试管口倒插于水中,充分反应后 试管内气体全部消失,则用 a、b 表示的 x 的代数式是( )。 A. 𝑎+𝑏 2 B. 2𝑎+𝑏 3 C. 3𝑎+𝑏 4 D. 4𝑎+𝑏 5 答案 C 解析氮的氧化物与 O2 和 H2O 反应生成 HNO3 时,只要满足氮的氧化物中的 N 与氮的氧化物 中的 O 和 O2 中 O 的和的比为 2∶5 即可全部转化,没有气体剩余。即 𝑎+𝑏 𝑎+2𝑏+2𝑥 = 2 5 ,解得 x= 3𝑎+𝑏 4 。 三、非选择题(本题共 5 小题,共 60 分) 16.(12 分)非金属单质 A 经如图所示的过程转化为含氧酸 D,已知 D 为强酸,请回答下列问题: A B C D (1)若 A 在常温下为固体,B 是能使品红溶液褪色的有刺激性气味的无色气体。 ①D 的化学式是 。 ②在工业生产中大量排放的 B 气体被雨水吸收后形成 而污染了环境。 (2)若 A 在常温下为气体,C 是红棕色的气体。 ①A、C 的化学式分别是 A ;C 。 ②D 的浓溶液在常温下可与铜反应并生成 C 气体,请写出该反应的化学方程 式: 。该反应 (填“属于”或“不属于”)氧化还原反 应。 答案(1)①H2SO4 ②酸雨 (2)①N2 NO2 ②Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O 属于 解析(1)若 B 是能使品红溶液褪色的有刺激性气味的无色气体,则 B 是 SO2,A 是单质 S,C 是 SO3,D 是 H2SO4;若大量排放 SO2,则会形成酸雨。 (2)若 C 是红棕色气体,则 C 为 NO2,B 为 NO,A 为 N2,D 为 HNO3,浓硝酸可与 Cu 反 应:4HNO3(浓)+Cu Cu(NO3)2+2NO2↑+2H2O,此反应有化合价升降变化,属于氧化还原反 应。 17.(12 分)(1)SiO2 在自然界中广泛存在,它是制备现代通信材料 (写该 材料名称)的主要原料;以 SiO2 为原料,在工业上制备单质硅的反应的化学方程式 为 ;在常温下,SiO2 可与一种酸发生反应,该反应的化学方程式 为 。该反应的重要应用是 。 (2)向一定体积的 18 mol·L -1 的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为 0.9 mol。则浓硫酸的实际体积 (填“大于”“等于”或“小于”)100 mL。若欲使剩余的铜片 继续溶解,可向其中加入硝酸盐溶液(如 KNO3 溶液),则该反应的离子方程式 为

(3)根据如图操作及现象推断酸X为 未见溶解 Fe粉溶解白色沉淀 含1)光导纤维Si0s+2C高温s1+2C01 SiO2+4HF一SiF4↑+2H0刻蚀玻璃 (2)大于3Cu+2N05+8H+一4H20+3Cu2+2NO↑ (3)浓硫酸 解析1)S02的用途非常广泛,可用于制造光导纤维,也可用于生产半导体材料硅;焦炭能与二 氧化硅反应生成生单质,化学方程式为S02+2C高温、 =Si计2CO↑;二氧化硅能与氢氟酸反应生成 四氟化硅气体,用于刻蚀玻璃,反应的化学方程式为SiO2+4H亚一SiF4↑+2H20。(2)根据反应 2HSO4(浓)+Cu一CuSO4+SO2↑+2H0可知,随着反应的进行,浓硫酸逐渐变稀,不再反应。 所以还原0.9mol的硫酸所需硫酸大于1.8mol,即体积大于100mL;铜片不与稀硫酸反应,加 入硝酸盐后,H与N03可形成HNO5,离子方程式为3Cu+2N03+8H一4HO+3Cu2+2NO↑。 (3)由图可知,加入X后铁未溶解,则X不是盐酸、稀硫酸或稀硝酸,可能为浓硫酸或浓硝酸, 当加水稀释后,铁粉溶解,加入BaC2有白色沉淀,所以推断X为浓硫酸。 18.(10分)X、Y、Z、W是中学化学中常见的四种气体。已知X、Y、Z三种气体都能对大 气造成污染,在工业上都可以用碱液吸收;X是化石燃料燃烧的产物之一,是形成酸雨的主要 物质;Y是一种单质,它的水溶液具有漂白作用:Z是硝酸工业和汽车尾气中的有害物质之一, 能与水反应,W气体的水溶液能使酚酞溶液变红。 请回答下列问题: (1)X、Y两种气体按物质的量之比为1:1在水溶液中能发生反应,离子方程式 为 (2)科学家发现,Z在催化剂条件下能与W反应,反应产物中的单质应是」 (填化学式): 该反应是氧化还原反应,则其中的氧化剂是 (填化学式)。 (3)在Z与水的反应中,氧化剂与还原剂的物质的量之比为 (4)检验W气体的方法是 答(1)C2+S02+2HC一4H+2C+S02 (2)N2NO2 (3)1:2 (4)将湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,证明该气体为NH 解析K、Y、Z、W是中学化学中常见的四种气体,X、Y、Z三种气体都能对大气造成污染, 在工业上都可以用碱液吸收,X是化石燃料燃烧的产物之一,是形成酸雨的物质,则X是二氧 化硫:Y是一种单质,它的水溶液具有漂白作用,则Y是氯气;Z是硝酸工业和汽车尾气中的有 害物质之一,能与水反应,则Z是二氧化氨:W气体的水溶液能使酚酞溶液变红色,说明W气 体为碱性气体.则为氨
(3)根据如图操作及现象推断酸 X 为 。 答案(1)光导纤维 SiO2+2C Si+2CO↑ SiO2+4HF SiF4↑+2H2O 刻蚀玻璃 (2)大于 3Cu+2NO3 - +8H+ 4H2O+3Cu2++2NO↑ (3)浓硫酸 解析(1)SiO2 的用途非常广泛,可用于制造光导纤维,也可用于生产半导体材料硅;焦炭能与二 氧化硅反应生成硅单质,化学方程式为 SiO2+2C Si+2CO↑;二氧化硅能与氢氟酸反应生成 四氟化硅气体,用于刻蚀玻璃,反应的化学方程式为 SiO2+4HF SiF4↑+2H2O。(2)根据反应 2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O 可知,随着反应的进行,浓硫酸逐渐变稀,不再反应。 所以还原 0.9 mol 的硫酸所需硫酸大于 1.8 mol,即体积大于 100 mL;铜片不与稀硫酸反应,加 入硝酸盐后,H+与 NO3 - 可形成 HNO3,离子方程式为 3Cu+2NO3 - +8H+ 4H2O+3Cu2++2NO↑。 (3)由图可知,加入 X 后铁未溶解,则 X 不是盐酸、稀硫酸或稀硝酸,可能为浓硫酸或浓硝酸, 当加水稀释后,铁粉溶解,加入 BaCl2 有白色沉淀,所以推断 X 为浓硫酸。 18.(10 分)X、Y、Z、W 是中学化学中常见的四种气体。已知:X、Y、Z 三种气体都能对大 气造成污染,在工业上都可以用碱液吸收;X 是化石燃料燃烧的产物之一,是形成酸雨的主要 物质;Y 是一种单质,它的水溶液具有漂白作用;Z 是硝酸工业和汽车尾气中的有害物质之一, 能与水反应;W 气体的水溶液能使酚酞溶液变红。 请回答下列问题: (1)X、Y 两种气体按物质的量之比为 1∶1 在水溶液中能发生反应,离子方程式 为 。 (2)科学家发现,Z 在催化剂条件下能与 W 反应,反应产物中的单质应是 (填化学式); 该反应是氧化还原反应,则其中的氧化剂是 (填化学式)。 (3)在 Z 与水的反应中,氧化剂与还原剂的物质的量之比为 。 (4)检验 W 气体的方法是 。 答案(1)Cl2+SO2+2H2O 4H++2Cl-+SO4 2- (2)N2 NO2 (3)1∶2 (4)将湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,证明该气体为 NH3 解析 X、Y、Z、W 是中学化学中常见的四种气体,X、Y、Z 三种气体都能对大气造成污染, 在工业上都可以用碱液吸收;X 是化石燃料燃烧的产物之一,是形成酸雨的物质,则 X 是二氧 化硫;Y 是一种单质,它的水溶液具有漂白作用,则 Y 是氯气;Z 是硝酸工业和汽车尾气中的有 害物质之一,能与水反应,则 Z 是二氧化氮;W 气体的水溶液能使酚酞溶液变红色,说明 W 气 体为碱性气体,则为氨
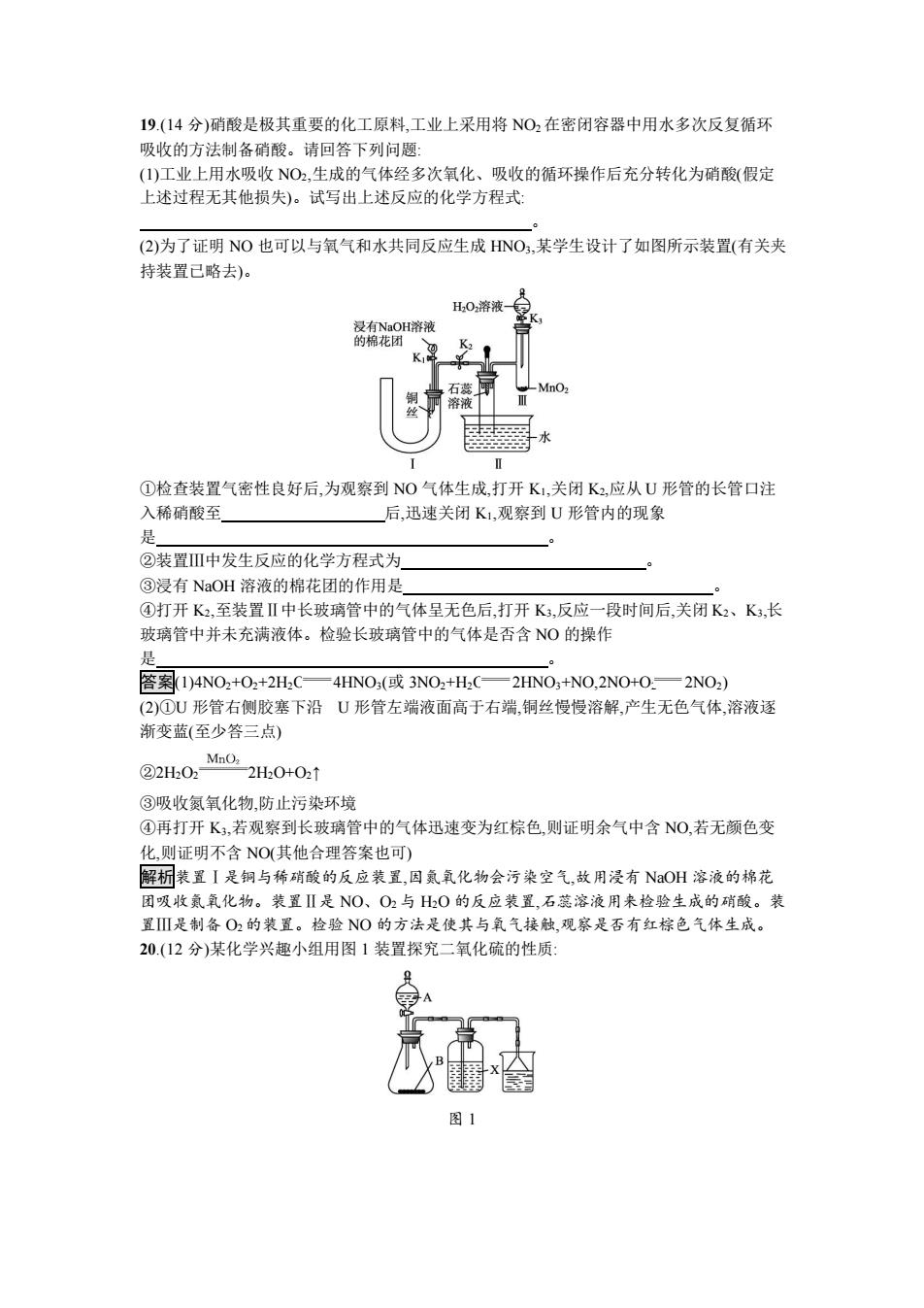
19.(14分)硝酸是极其重要的化工原料,工业上采用将NO2在密闭容器中用水多次反复循环 吸收的方法制备硝酸。请回答下列问题: (1)工业上用水吸收NO2,生成的气体经多次氧化、吸收的循环操作后充分转化为硝酸(假定 上述过程无其他损失)。试写出上述反应的化学方程式: (2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹 持装置已略去)。 H202溶液 浸有NaOH溶液 的棉花团 ①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注 入稀硝酸至 后,迅速关闭K1,观察到U形管内的现象 是 ②装置Ⅲ中发生反应的化学方程式为 ③浸有NaOH溶液的棉花团的作用是, ④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,关闭K2、K3,长 玻璃管中并未充满液体。检验长玻璃管中的气体是否含NO的操作 是 答案(1)4NO2+O2+2H2C—4HNO3(或3NO2+H,C—2HNO3+NO,2NO+O.—2NO2) (2)①形管右侧胶塞下沿U形管左端液面高于右端,铜丝慢慢溶解,产生无色气体,溶液逐 渐变蓝(至少答三点) MnO2 ②2H202 2H20+02↑ ③吸收氮氧化物,防止污染环境 ④再打开K,若观察到长玻璃管中的气体迅速变为红棕色,则证明余气中含NO,若无颜色变 化,则证明不含NO(其他合理答案也可) 解析装置I是铜与稀硝酸的反应装置,因氯氧化物会污染空气,故用浸有NOH溶液的棉花 团吸收氨氧化物。装置Ⅱ是NO、O2与H2O的反应装置,石蕊溶液用来检验生成的硝酸。装 置Ⅲ是制备O2的装置。检验NO的方法是使其与氧气接触,观察是否有红棕色气体生成。 20.(12分)某化学兴趣小组用图1装置探究二氧化硫的性质: 图1
19.(14 分)硝酸是极其重要的化工原料,工业上采用将 NO2 在密闭容器中用水多次反复循环 吸收的方法制备硝酸。请回答下列问题: (1)工业上用水吸收 NO2,生成的气体经多次氧化、吸收的循环操作后充分转化为硝酸(假定 上述过程无其他损失)。试写出上述反应的化学方程式: 。 (2)为了证明 NO 也可以与氧气和水共同反应生成 HNO3,某学生设计了如图所示装置(有关夹 持装置已略去)。 ①检查装置气密性良好后,为观察到 NO 气体生成,打开 K1,关闭 K2,应从 U 形管的长管口注 入稀硝酸至 后,迅速关闭 K1,观察到 U 形管内的现象 是 。 ②装置Ⅲ中发生反应的化学方程式为 。 ③浸有 NaOH 溶液的棉花团的作用是 。 ④打开 K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开 K3,反应一段时间后,关闭 K2、K3,长 玻璃管中并未充满液体。检验长玻璃管中的气体是否含 NO 的操作 是 。 答案(1)4NO2+O2+2H2O 4HNO3(或 3NO2+H2O 2HNO3+NO,2NO+O2 2NO2) (2)①U 形管右侧胶塞下沿 U 形管左端液面高于右端,铜丝慢慢溶解,产生无色气体,溶液逐 渐变蓝(至少答三点) ②2H2O2 2H2O+O2↑ ③吸收氮氧化物,防止污染环境 ④再打开 K3,若观察到长玻璃管中的气体迅速变为红棕色,则证明余气中含 NO,若无颜色变 化,则证明不含 NO(其他合理答案也可) 解析装置Ⅰ是铜与稀硝酸的反应装置,因氮氧化物会污染空气,故用浸有 NaOH 溶液的棉花 团吸收氮氧化物。装置Ⅱ是 NO、O2 与 H2O 的反应装置,石蕊溶液用来检验生成的硝酸。装 置Ⅲ是制备 O2 的装置。检验 NO 的方法是使其与氧气接触,观察是否有红棕色气体生成。 20.(12 分)某化学兴趣小组用图 1 装置探究二氧化硫的性质: 图 1

图2 (1)图1中倒扣漏斗的作用是 (2)将SO2气体分别通入下列X溶液中,请回答下列问题。 ①将少量SO2通入紫色石蕊溶液中,现象是 继续通入SO2气 体,现象是 ②将SO2通入酸性KMnO4溶液中,现象是 ③将SO2慢慢通入澄清石灰水中,现象 是 (3)某同学制取的$O2气体中混有CO2气体,请你设计实验证明混合气体中既有SO2气体,又 有CO2气体。可以选择图2洗气装置设计实验。洗气装置中的溶液可以是A浓硫酸、B.氢 氧化钠溶液、C硫酸铜溶液、D.品红溶液、E.澄清石灰水、F.酸性高锰酸钾溶液、G.碳酸氢 钠溶液。为达到实验目的,上述装置所装试剂的连接顺序是 (用字母表示,所给试剂 可以重复使用,有些试剂也可以不用)。 答案1)防止倒吸 (2)①紫色溶液变为红色红色不褪去(或溶液颜色无变化)②溶液的紫红色褪去③首先 有白色沉淀生成,然后白色沉淀消失 (3)DFDE 解杨1)图1中倒扣漏斗的作用是防止倒吸。 (2)①SO2溶于水生成亚硫酸,溶液显酸性,所以石蕊溶液显红色。由于SO2不能使酸碱指示剂 褪色,所以继续通入SO2,溶液的颜色不会变化。②SO2具有还原性,高锰酸钾具有氧化性,两 者发生氧化还原反应,所以溶液的紫红色会褪去。③SO2是酸性氧化物,与氢氧化钙反应生成 亚硫酸钙白色沉淀和水。继续通入SO2,白色沉淀溶解。(3)检验SO2一般用品红溶液,检验 CO2一般用澄清石灰水。由于SO2也能使澄清石灰水变浑浊,所以先检验SO2,且在气体通入 澄清石灰水之前,还应除去SO2,除去SO2用酸性高锰酸钾溶液,再用品红溶液来检验SO2是 否除尽
图 2 (1)图 1 中倒扣漏斗的作用是 。 (2)将 SO2 气体分别通入下列 X 溶液中,请回答下列问题。 ①将少量 SO2 通入紫色石蕊溶液中,现象是 ,继续通入 SO2 气 体,现象是 。 ②将 SO2 通入酸性 KMnO4 溶液中,现象是 。 ③将 SO2 慢慢通入澄清石灰水中,现象 是 。 (3)某同学制取的 SO2 气体中混有 CO2 气体,请你设计实验证明混合气体中既有 SO2 气体,又 有 CO2 气体。可以选择图 2 洗气装置设计实验。洗气装置中的溶液可以是 A.浓硫酸、B.氢 氧化钠溶液、C.硫酸铜溶液、D.品红溶液、E.澄清石灰水、F.酸性高锰酸钾溶液、G.碳酸氢 钠溶液。为达到实验目的,上述装置所装试剂的连接顺序是 (用字母表示,所给试剂 可以重复使用,有些试剂也可以不用)。 答案(1)防止倒吸 (2)①紫色溶液变为红色 红色不褪去(或溶液颜色无变化) ②溶液的紫红色褪去 ③首先 有白色沉淀生成,然后白色沉淀消失 (3)DFDE 解析(1)图 1 中倒扣漏斗的作用是防止倒吸。 (2)①SO2 溶于水生成亚硫酸,溶液显酸性,所以石蕊溶液显红色。由于 SO2 不能使酸碱指示剂 褪色,所以继续通入 SO2,溶液的颜色不会变化。②SO2 具有还原性,高锰酸钾具有氧化性,两 者发生氧化还原反应,所以溶液的紫红色会褪去。③SO2 是酸性氧化物,与氢氧化钙反应生成 亚硫酸钙白色沉淀和水。继续通入 SO2,白色沉淀溶解。(3)检验 SO2 一般用品红溶液,检验 CO2 一般用澄清石灰水。由于 SO2 也能使澄清石灰水变浑浊,所以先检验 SO2,且在气体通入 澄清石灰水之前,还应除去 SO2,除去 SO2 用酸性高锰酸钾溶液,再用品红溶液来检验 SO2 是 否除尽