
第1课时乙醇 课后·训练提升 合格考基础巩固 1.下列说法正确的是()。 A无水乙醇可用于杀菌消毒 B.乙醇属于烃的衍生物 C.常温下,1mol乙醇可与足量的Na反应生成11.2LH D.乙醇可使紫色的石蕊溶液变红 答案B 解析体积分数为75%的酒精溶液可用来杀菌消毒,A项不正确;1ol乙醇与足量的Na反应 生成0.5olH2,标准状况下的体积为11.2L,C项不正确;乙醇不具有酸性,D项不正确。 2.下列有关金属钠在水中和在乙醇中的反应情况对比正确的是( )。 A钠能置换出水中所有的氢,却只能置换出乙醇里羟基中的氢 B.钠都要浮在水面上或乙醇液体表面 C.钠无论与水反应还是与乙醇反应都要放出热量 D.钠在乙醇中反应更剧烈,是因为乙醇分子中含有的氢原子比水分子中的多 答案 解析钠与水反应生成氢氧化钠和氢气,不能置换出水中所有的氢,故A项错误;钠的密度比水 的小,比乙醇的大,因此钠在乙醇的下面,故B项错误:钠与水、乙醇的反应都为放热反应,故C 项正确:钠与水反应较为剧烈,故D项错误。 3.乙醇分子可能存在CH:CH2OH和CH3OCH两种结构。能够证明乙醇(分子式C2H6O)的结 构是CH;CH2OH的最充分的理由是()。 A.23g乙醇与足量的金属钠反应,可以放出0.25mol氢气 B.1mol乙醇充分燃烧生成2 mol CO2和3molH2O.消耗3molO2 C.乙醇的沸点高于乙烷 D.1mol乙醇氧化后生成1mol乙醛 答案A 解析23g乙醇(即0.5mol)与足量钠反应只生成0.25mol氢气,则1mol乙醇能够与足量钠反 应生成0.5ol氢气,说明1个乙醇分子中有1个氢原子与其他氢原子不同,从而证明乙醇分 子结构简式为C2H5OH.而不是CH3OCH3.故A项正确:1mol乙醇充分燃烧生成2 mol CO2和 3mol0,消耗3molO2,依据元素守恒,说明1个乙醇分子中含有2个C原子、6个H原子 和1个O原子,不能说明其结构,故B项错误;乙醇分子构成与沸点无关,故C项错误:根据质 量守恒,1mol乙醇氧化后生成1mol乙醛,与分子结构关系不密切,故D项错误。 4.下列化合物和乙醇具有相似的化学性质的是( )。 A.CH3-OCH3 B.H-C-H C.CH3-OH -Br 0 答案C 解析快定乙醇化学性质的为一OH,则由化合物的结构式或结构简式可知,C项中的化合物含 有一OH故选C。 5.向装有乙醇的烧杯中投入一小块金属钠,下列对该实验现象的描述中正确的是( )。 A钠块沉在乙醇液面的下面 B.钠块熔化成小球 C.钠块在乙醇的液面上游动 D.钠块表面剧烈放出气体
第 1 课时 乙醇 课后· 合格考基础巩固 1.下列说法正确的是( )。 A.无水乙醇可用于杀菌消毒 B.乙醇属于烃的衍生物 C.常温下,1 mol 乙醇可与足量的 Na 反应生成 11.2 L H2 D.乙醇可使紫色的石蕊溶液变红 答案 B 解析体积分数为 75%的酒精溶液可用来杀菌消毒,A 项不正确;1 mol 乙醇与足量的 Na 反应 生成 0.5 mol H2,标准状况下的体积为 11.2 L,C 项不正确;乙醇不具有酸性,D 项不正确。 2.下列有关金属钠在水中和在乙醇中的反应情况对比正确的是( )。 A.钠能置换出水中所有的氢,却只能置换出乙醇里羟基中的氢 B.钠都要浮在水面上或乙醇液体表面 C.钠无论与水反应还是与乙醇反应都要放出热量 D.钠在乙醇中反应更剧烈,是因为乙醇分子中含有的氢原子比水分子中的多 答案 C 解析钠与水反应生成氢氧化钠和氢气,不能置换出水中所有的氢,故 A 项错误;钠的密度比水 的小,比乙醇的大,因此钠在乙醇的下面,故 B 项错误;钠与水、乙醇的反应都为放热反应,故 C 项正确;钠与水反应较为剧烈,故 D 项错误。 3.乙醇分子可能存在 CH3CH2OH 和 CH3OCH3 两种结构。能够证明乙醇(分子式 C2H6O)的结 构是 CH3CH2OH 的最充分的理由是( )。 A.23 g 乙醇与足量的金属钠反应,可以放出 0.25 mol 氢气 B.1 mol 乙醇充分燃烧生成 2 mol CO2 和 3 mol H2O,消耗 3 mol O2 C.乙醇的沸点高于乙烷 D.1 mol 乙醇氧化后生成 1 mol 乙醛 答案 A 解析 23 g 乙醇(即 0.5 mol)与足量钠反应只生成 0.25 mol 氢气,则 1 mol 乙醇能够与足量钠反 应生成 0.5 mol 氢气,说明 1 个乙醇分子中有 1 个氢原子与其他氢原子不同,从而证明乙醇分 子结构简式为 C2H5OH,而不是 CH3OCH3,故 A 项正确;1 mol 乙醇充分燃烧生成 2 mol CO2 和 3 mol H2O,消耗 3 mol O2,依据元素守恒,说明 1 个乙醇分子中含有 2 个 C 原子、6 个 H 原子 和 1 个 O 原子,不能说明其结构,故 B 项错误;乙醇分子构成与沸点无关,故 C 项错误;根据质 量守恒,1 mol 乙醇氧化后生成 1 mol 乙醛,与分子结构关系不密切,故 D 项错误。 4.下列化合物和乙醇具有相似的化学性质的是( )。 A.CH3—O—CH3 B. C.CH3—OH D. 答案 C 解析决定乙醇化学性质的为—OH,则由化合物的结构式或结构简式可知,C 项中的化合物含 有—OH,故选 C。 5.向装有乙醇的烧杯中投入一小块金属钠,下列对该实验现象的描述中正确的是( )。 A.钠块沉在乙醇液面的下面 B.钠块熔化成小球 C.钠块在乙醇的液面上游动 D.钠块表面剧烈放出气体

答案A 解析钠的密度比乙醇的大,故A项正确,C项错误;钠与乙醇反应产生氢气比较缓慢,放出的热 量不足以使钠熔化,故B、D两项错误。 6.按照下图装置(夹持装置已省略)持续通入X气体或蒸气,可以看到a处有紫红色物质生成,b 处增重,c处得到液体,则X气体或蒸气可能是(假设每个反应均完全反应)()。 Cuo 碱石灰 冰水 A.CH:CH2OH B.CO或H C.NH3 D.H2 答案A 解析选项中物质均可还原CO,但本题的关键点是所得产物冷凝后得到液体,该液体不可能 是水(千燥管中盛有碱石灰),所以一定是乙醛,则X气体为乙醇。 7.下列说法中,不正确的是()。 A.乙醇与金属钠反应时,是乙醇分子中羟基中的O一H断裂 B.检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水 C.乙醇在一定条件下可氧化成CH:COOH D.甲烷、乙烯、苯、乙醇都是无色不溶于水的有机化合物 答案D 解析乙醇能与水以任意比互溶,D项不正确。 8.将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,铜片质量增加的是( )。 A.硝酸 B.稀盐酸 C.Ca(OHz溶液 D.乙醇 答案 解初铜片在酒精灯上加热,发生化学反应2Cu+0.△2Cu0,使质量增加。当适到硝酸和稀盐 酸时发生CuO+2HNO一CuNO3)2+HO,CuO+2HC一CuCh+HO,使铜片质量减少,当遇 到乙醇时发生化学反应CuO+CH3 CH2OH二→CH:CHO+HO+Cu,CuO被还原为Cu,反应前后 铜片质量不变:当遇到C(OHD2溶液时.CuO不反应,故加热后的钢片比原铜片质量增加。 9.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法中不正确的是 ()。 HH②① H- 8时H ⑤H④H A.与金属钠反应时断裂① B.在铜或银催化共热下与O2反应时断裂①和③ C.在铜或银催化共热下与O2反应时断裂①和⑤ D.在空气中完全燃烧时断裂①②③④⑤ 答案C 解析乙醇与钠反应生成乙醇钠,是羟基中的O一H断裂,A项正确;乙醇催化氧化生成乙醛时 断裂①和③,B项正确,C项错误:乙醇完全燃烧时化学键①②③④⑤全部断裂,D项正确。 10.己知下列转化关系: cH,一cH,器日尝缓慢产生气泡 ③lo: 产物有刺激性气味
答案 A 解析钠的密度比乙醇的大,故 A 项正确,C 项错误;钠与乙醇反应产生氢气比较缓慢,放出的热 量不足以使钠熔化,故 B、D 两项错误。 6.按照下图装置(夹持装置已省略)持续通入 X 气体或蒸气,可以看到 a 处有紫红色物质生成,b 处增重,c 处得到液体,则 X 气体或蒸气可能是(假设每个反应均完全反应)( )。 A.CH3CH2OH B.CO 或 H2 C.NH3 D.H2 答案 A 解析选项中物质均可还原 CuO,但本题的关键点是所得产物冷凝后得到液体,该液体不可能 是水(干燥管中盛有碱石灰),所以一定是乙醛,则 X 气体为乙醇。 7.下列说法中,不正确的是( )。 A.乙醇与金属钠反应时,是乙醇分子中羟基中的 O—H 断裂 B.检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水 C.乙醇在一定条件下可氧化成 CH3COOH D.甲烷、乙烯、苯、乙醇都是无色不溶于水的有机化合物 答案 D 解析乙醇能与水以任意比互溶,D 项不正确。 8.将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,铜片质量增加的是( )。 A.硝酸 B.稀盐酸 C.Ca(OH)2 溶液 D.乙醇 答案 C 解析铜片在酒精灯上加热,发生化学反应 2Cu+O2 2CuO,使质量增加。当遇到硝酸和稀盐 酸时发生 CuO+2HNO3 Cu(NO3)2+H2O,CuO+2HCl CuCl2+H2O,使铜片质量减少;当遇 到乙醇时发生化学反应 CuO+CH3CH2OH CH3CHO+H2O+Cu,CuO 被还原为 Cu,反应前后 铜片质量不变;当遇到 Ca(OH)2 溶液时,CuO 不反应,故加热后的铜片比原铜片质量增加。 9.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法中不正确的是 ( )。 A.与金属钠反应时断裂① B.在铜或银催化共热下与 O2 反应时断裂①和③ C.在铜或银催化共热下与 O2 反应时断裂①和⑤ D.在空气中完全燃烧时断裂①②③④⑤ 答案 C 解析乙醇与钠反应生成乙醇钠,是羟基中的 O—H 断裂,A 项正确;乙醇催化氧化生成乙醛时, 断裂①和③,B 项正确,C 项错误;乙醇完全燃烧时化学键①②③④⑤全部断裂,D 项正确。 10.已知下列转化关系:

(1)写出A的结构简式: (2)含A的体积分数为75%的水溶液可以用作 (3)写出①②③反应的化学方程式: ① ② (4)反应③说明A具有 性。 答案1)CHCH,OH或C2HsOH (2)消毒剂 催化剂 (3)①CH2一CH2+H20 CH:CH2OH ②2CH3CHOH+2Na→2CH,CH2ONa+H↑ Cu ③2CHCH2OH+O2△2 CH:CHO+2H2O (4)还原 11.通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为 52.2%,氢的质量分数为13.0%。 (1)X的分子式是 (2)X与金属钠反应放出氢气,反应的化学方程式是 (有机物用结构简式表示): (3)X与空气中的氧气在铜或银催化作用下反应生成Y,Y的结构简式是 (4)X与酸性高锰酸钾溶液反应可生成Z,Z的名称为 答案1)C2H60 (2)2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ (3)CH:CHO (4)乙酸 解析(1)由题意知氧的质量分数为1-52.2%-13.0%=34.8%, 则碳、氢、氧原子个数分别为: N(C)=46x5226-2。 12 NH46xi30%-6, O)46x348%=l,即X的分子式为C,H,0。 16 (2)由(1)知X为乙醇,乙醇与钠反应的化学方程式为2 CH:CH2OH+2N→ 2CH3CH2ONa+H2↑。 (3)乙醇能被氧化为乙醛,所以Y为乙醛。 (4)根据题意知Z为乙酸。 等级考拓展提高 1.(双选)下列叙述正确的是()。 A.乙醇能与钠反应生成氢气,但不如水与钠反应剧烈 B.乙醇因不含碳碳双键,故不能被酸性高锰酸钾溶液氧化 C.乙醇的密度比水的小,故将乙醇加入水中,充分振荡后分层,上层为乙醇 D.乙醇分子中共含有6个氢原子,但性质不完全相同 答案AD 解析乙醇能与钠反应,但比水与钠反应缓和,故A项正确;乙醇虽不含碳碳双键,但能被酸性高 锰酸钾溶液氧化,B项错误:乙醇的密度虽比水的小,但与水互溶混合物不分层C项错误:乙醇 中有6个氢原子,但羟基上的氢原子比另5个氢原子活泼,故性质不完全相同,则D项正确。 2.下列说法正确的是()。 ①检测乙醇中是否含有水可加入少量的无水疏酸铜,若变蓝则含水②除去乙醇中微量的水 可加入金属钠,使其完全反应③获得无水乙醇的方法是直接加热蒸馏④获得无水乙醇的 方法通常是先用生石灰吸水,然后再加热蒸馏
(1)写出 A 的结构简式: 。 (2)含 A 的体积分数为 75%的水溶液可以用作 。 (3)写出①②③反应的化学方程式: ① 。 ② 。 ③ 。 (4)反应③说明 A 具有 性。 答案(1)CH3CH2OH 或 C2H5OH (2)消毒剂 (3)①CH2 CH2+H2O CH3CH2OH ②2CH3CH2OH+2Na 2CH3CH2ONa+H2↑ ③2CH3CH2OH+O2 2CH3CHO+2H2O (4)还原 11.通过粮食发酵可获得某含氧有机化合物 X,其相对分子质量为 46,其中碳的质量分数为 52.2%,氢的质量分数为 13.0%。 (1)X 的分子式是 ; (2)X 与金属钠反应放出氢气,反应的化学方程式是 (有机物用结构简式表示); (3)X 与空气中的氧气在铜或银催化作用下反应生成 Y,Y 的结构简式是 ; (4)X 与酸性高锰酸钾溶液反应可生成 Z,Z 的名称为 。 答案(1)C2H6O (2)2CH3CH2OH+2Na 2CH3CH2ONa+H2↑ (3)CH3CHO (4)乙酸 解析(1)由题意知氧的质量分数为 1-52.2%-13.0%=34.8%, 则碳、氢、氧原子个数分别为: N(C)=46×52.2% 12 =2, N(H)=46×13.0% 1 =6, N(O)=46×34.8% 16 =1,即 X 的分子式为 C2H6O。 (2)由(1)知 X 为乙醇,乙醇与钠反应的化学方程式为 2CH3CH2OH+2Na 2CH3CH2ONa+H2↑。 (3)乙醇能被氧化为乙醛,所以 Y 为乙醛。 (4)根据题意知 Z 为乙酸。 等级考拓展提高 1.(双选)下列叙述正确的是( )。 A.乙醇能与钠反应生成氢气,但不如水与钠反应剧烈 B.乙醇因不含碳碳双键,故不能被酸性高锰酸钾溶液氧化 C.乙醇的密度比水的小,故将乙醇加入水中,充分振荡后分层,上层为乙醇 D.乙醇分子中共含有 6 个氢原子,但性质不完全相同 答案 AD 解析乙醇能与钠反应,但比水与钠反应缓和,故 A 项正确;乙醇虽不含碳碳双键,但能被酸性高 锰酸钾溶液氧化,B 项错误;乙醇的密度虽比水的小,但与水互溶,混合物不分层,C 项错误;乙醇 中有 6 个氢原子,但羟基上的氢原子比另 5 个氢原子活泼,故性质不完全相同,则 D 项正确。 2.下列说法正确的是( )。 ①检测乙醇中是否含有水可加入少量的无水硫酸铜,若变蓝则含水 ②除去乙醇中微量的水 可加入金属钠,使其完全反应 ③获得无水乙醇的方法是直接加热蒸馏 ④获得无水乙醇的 方法通常是先用生石灰吸水,然后再加热蒸馏

A.①③ B.②④ C.①④ D.③④ 靥案 解析用无水CuSO4可检验乙醇中是否有水存在,因为无水CuSO4遇水变蓝,故①正确;乙醇和 水均与金属钠反应生成H2,故②错误;,将含水的乙醇直接加热蒸馏,水也会蒸出,所得乙醇不纯 故③错误.④正确。 OH 3.(双选)香叶醇是合成玫瑰香油的主要原料,其结构简式为 。下列关于香叶醇的 叙述正确的是 () A.香叶醇的分子式为C1oH18O B.能使溴的四氯化碳溶液褪色 C.不能使酸性高锰酸钾溶液褪色 D.不能与金属钠发生反应 答案AB C-C 解杨香叶醇中含/ 、和一OH碳碳双键能使溴的四氯化碳溶液、酸性高锰酸钾溶液褪 色;一O能使酸性高锰酸钾溶液褪色,能与金属钠发生反应,C、D两项均不正确。 4.下列四种有机化合物的分子式都是C4H1O,其中不能被氧化为同碳原子数的醛的是 ()。 CH,CH,CHCH ① OH CH,CH2CH2CH2 ② OH CH CHCH ③ CH,OH CH, CH,-C-CH, ④ OH A.①② B.②③ c.③④ D.①④ 答案D 解析①醇分子结构中与一OH相连的碳原子上至少要有一个氢原子才能发生催化氧化反应: ②一OH连在链端碳原子上的醇,即R一CHOH结构的醇,可被催化氧化为醛。 5.(双选)将W1g光亮的铜丝在空气中加热一段时间后,迅速伸入下列物质中,取出干燥,如此反 复几次,最后取出铜丝用蒸馏水洗涤、干燥,称得其质量为W2g。实验时由于所伸入的物质 不同,铜丝的质量前后变化可能不同,下列所插物质与铜丝的质量关系正确的是()。 A.NaOH溶液,W1=W2 B.无水乙醇,W1=W2 C.NaHSO4溶液,W1m1,故错误B项,乙醇与Cu0发生反应:CH,CH,OH+Cu(△ CH;CHO+Cu+H2O,铜丝质量不变,故正确:C项,CuO+2H一Cu2+HO,铜转变成Cu2+,质量减 少,W>W2,故错误:D项,C0+CuC二Cu+CO2,铜丝质量不变,W=W2,故正确。 6.己知C4H1o的同分异构体有两种:
A.①③ B.②④ C.①④ D.③④ 答案 C 解析用无水 CuSO4 可检验乙醇中是否有水存在,因为无水 CuSO4 遇水变蓝,故①正确;乙醇和 水均与金属钠反应生成 H2,故②错误;将含水的乙醇直接加热蒸馏,水也会蒸出,所得乙醇不纯, 故③错误,④正确。 3.(双选)香叶醇是合成玫瑰香油的主要原料,其结构简式为 。下列关于香叶醇的 叙述正确的是 ( )。 A.香叶醇的分子式为 C10H18O B.能使溴的四氯化碳溶液褪色 C.不能使酸性高锰酸钾溶液褪色 D.不能与金属钠发生反应 答案 AB 解析香叶醇中含 和—OH,碳碳双键能使溴的四氯化碳溶液、酸性高锰酸钾溶液褪 色;—OH 能使酸性高锰酸钾溶液褪色,能与金属钠发生反应,C、D 两项均不正确。 4.下列四种有机化合物的分子式都是 C4H10O,其中不能被氧化为同碳原子数的醛的是 ( )。 ① ② ③ ④ A.①② B.②③ C.③④ D.①④ 答案 D 解析①醇分子结构中与—OH 相连的碳原子上至少要有一个氢原子才能发生催化氧化反应; ②—OH 连在链端碳原子上的醇,即 R—CH2OH 结构的醇,可被催化氧化为醛。 5.(双选)将 W1 g 光亮的铜丝在空气中加热一段时间后,迅速伸入下列物质中,取出干燥,如此反 复几次,最后取出铜丝用蒸馏水洗涤、干燥,称得其质量为 W2 g。实验时由于所伸入的物质 不同,铜丝的质量前后变化可能不同,下列所插物质与铜丝的质量关系正确的是( )。 A.NaOH 溶液,W1=W2 B.无水乙醇,W1=W2 C.NaHSO4 溶液,W1W1,故错误;B 项,乙醇与 CuO 发生反应:CH3CH2OH+CuO CH3CHO+Cu+H2O,铜丝质量不变,故正确;C 项,CuO+2H+ Cu2++H2O,铜转变成 Cu2+ ,质量减 少,W1>W2,故错误;D 项,CO+CuO Cu+CO2,铜丝质量不变,W1=W2,故正确。 6.已知 C4H10 的同分异构体有两种:

CH-CH-CH, CH;CH2CH2CH、 CH ,则C4H10属于醇类的同分异构体共有()。 A.1种 B.2种 C.3种 D.4种 答案D 解标考查等效氢原子,在两种异构体中各含有两种不同性质的氢原子,知CH2一C函CH一 1 2 CH-CH-CH CH3 CH ,所以羟基取代上面的氢原子共有4种同分异构体。 7.一定量的乙醇在氧气不足的情况下燃烧,得C0、C02和水的总质量为27.6g。若其中水的 质量为10.8g,则C0的质量为( )。 A.4.4g B.2.2g C.1.4g D.在2.2g与4.4g之间 答案c 解桐由H0的物质的量可求出C2H5OH的物质的量为0.2mol,则nCO)十nCO2)0.4mol,而 mC0)+m(C02)=27.6g-10.8g,联立可解得n(C0)=0.05mol,m(CO)=1.4g。 8.A、B、C三种醇分别与等量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这 三种醇的物质的量之比为3:6:2,则A、B、C三种醇分子里羟基数之比是 ()。 A3:2:1 B.2:6:2 C.3:1:2 D.2:1:3 答案D 解析三种醇分别与等量的N反应,相同条件下产生相同体积的H,说明这三种醇各自所提供 的一OH数目相同,为方便计算,设所提供一OH的数目为α,由于三种醇物质的量之比为3: 6:2,所以各醇分子中-0州数之比为号:管:号2:1:3。 9.乙醇汽油作为一种新型清洁燃料,是用乙醇和汽油混合而成的能源,具有较好的经济效益和 社会效益,是目前世界上可再生能源的发展重点。 (1)写出乙醇完全燃烧的化学方程式: (2)乙醇燃烧时如果氧气不足,可能还有C0生成。用如图装置验证乙醇的燃烧产物中有 CO、CO2、HO,应将乙醇的燃烧产物依次通过(按气流从左到右的顺序填装置序 号)】 ① ④ Cuo 水接接 氢氧化钠 溶液 (3)实验时可观察到装置②中A瓶澄清石灰水变浑浊。A瓶澄清石灰水的作用 是 B瓶氢氧化钠溶液的作用是 C瓶澄清 石灰水的作用是 (4)装置③的作用是 装置①中所盛的是 作用 是 (⑤)装置④中所盛的固体试剂是 它可以验证的产物是 (6)尾气应如何处理?
CH3CH2CH2CH3、 ,则 C4H10O 属于醇类的同分异构体共有( )。 A.1 种 B.2 种 C.3 种 D.4 种 答案 D 解析考查等效氢原子,在两种异构体中各含有两种不同性质的氢原子,如CH3 1 —CH2 2 —CH2— CH3、 ,所以羟基取代上面的氢原子共有 4 种同分异构体。 7.一定量的乙醇在氧气不足的情况下燃烧,得 CO、CO2 和水的总质量为 27.6 g。若其中水的 质量为 10.8 g,则 CO 的质量为( )。 A.4.4 g B.2.2 g C.1.4 g D.在 2.2 g 与 4.4 g 之间 答案 C 解析由 H2O 的物质的量可求出 C2H5OH 的物质的量为 0.2 mol,则 n(CO)+n(CO2)=0.4 mol,而 m(CO)+m(CO2)=27.6 g-10.8 g,联立可解得 n(CO)=0.05 mol,m(CO)=1.4 g。 8.A、B、C 三种醇分别与等量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这 三种醇的物质的量之比为 3∶6∶2,则 A、B、C 三种醇分子里羟基数之比是 ( )。 A.3∶2∶1 B.2∶6∶2 C.3∶1∶2 D.2∶1∶3 答案 D 解析三种醇分别与等量的 Na 反应,相同条件下产生相同体积的 H2,说明这三种醇各自所提供 的—OH 数目相同,为方便计算,设所提供—OH 的数目为 a,由于三种醇物质的量之比为 3∶ 6∶2,所以各醇分子中—OH 数之比为𝑎 3 ∶ 𝑎 6 ∶ 𝑎 2 =2∶1∶3。 9.乙醇汽油作为一种新型清洁燃料,是用乙醇和汽油混合而成的能源,具有较好的经济效益和 社会效益,是目前世界上可再生能源的发展重点。 (1)写出乙醇完全燃烧的化学方程式: 。 (2)乙醇燃烧时如果氧气不足,可能还有 CO 生成。用如图装置验证乙醇的燃烧产物中有 CO、CO2、H2O,应将乙醇的燃烧产物依次通过(按气流从左到右的顺序填装置序 号) 。 (3)实验时可观察到装置②中 A 瓶澄清石灰水变浑浊。A 瓶澄清石灰水的作用 是 ;B 瓶氢氧化钠溶液的作用是 ;C 瓶澄清 石灰水的作用是 。 (4)装置③的作用是 ;装置①中所盛的是 ,作用 是 。 (5)装置④中所盛的固体试剂是 ,它可以验证的产物是 。 (6)尾气应如何处理?
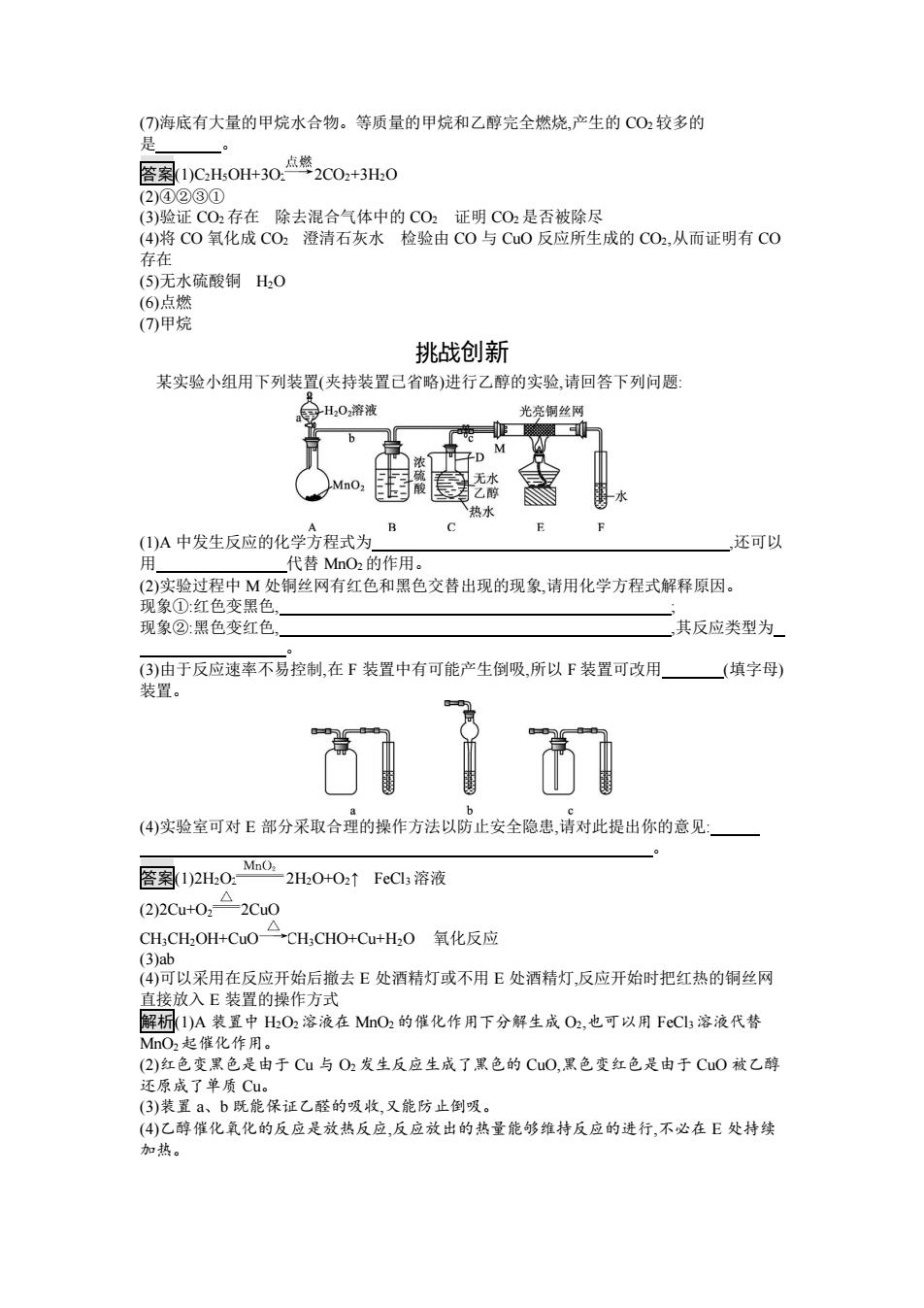
(7)海底有大量的甲烷水合物。等质量的甲烷和乙醇完全燃烧,产生的CO2较多的 是 累1)C,H0H+30.点整2C02+3H:0 (2)④②③① (3)验证CO2存在除去混合气体中的CO2证明CO2是否被除尽 (4)将CO氧化成CO2澄清石灰水检验由C0与CuO反应所生成的CO2,从而证明有C0 存在 (5)无水硫酸铜H2O (6)点燃 (7)甲烷 挑战创新 某实验小组用下列装置(夹持装置己省略)进行乙醇的实验,请回答下列问题: 号H202溶液 光亮铜丝网 热水 (1)A中发生反应的化学方程式为 还可以 用 代替MnO2的作用。 (2)实验过程中M处铜丝网有红色和黑色交替出现的现象,请用化学方程式解释原因。 现象①:红色变黑色 现象②:黑色变红色 其反应类型为_ (3)由于反应速率不易控制,在F装置中有可能产生倒吸,所以F装置可改用 (填字母) 装置。 (4)实验室可对E部分采取合理的操作方法以防止安全隐患,请对此提出你的意见: MnO2 答案1)2H0: 2H2O+O2↑FeCI3溶液 (2)CutO:2C △ CHCH2OH+CuO二→CH;CHO+Cu+H2O氧化反应 (3)ab (4)可以采用在反应开始后撤去E处酒精灯或不用E处酒精灯,反应开始时把红热的铜丝网 直接放入E装置的操作方式 解析1)A装置中HO2溶液在MnO2的催化作用下分解生成O2,也可以用FcCl3溶液代替 MnO2起催化作用。 (2)红色变黑色是由于Cu与O2发生反应生成了黑色的CuO,黑色变红色是由于CuO被乙醇 还原成了单质Cu。 (3)装置a、b既能保证乙醛的吸收,又能防止倒吸。 (4)乙醇催化氧化的反应是放热反应,反应放出的热量能够维持反应的进行,不必在E处持续 加热
(7)海底有大量的甲烷水合物。等质量的甲烷和乙醇完全燃烧,产生的 CO2 较多的 是 。 答案(1)C2H5OH+3O2 2CO2+3H2O (2)④②③① (3)验证 CO2 存在 除去混合气体中的 CO2 证明 CO2 是否被除尽 (4)将 CO 氧化成 CO2 澄清石灰水 检验由 CO 与 CuO 反应所生成的 CO2,从而证明有 CO 存在 (5)无水硫酸铜 H2O (6)点燃 (7)甲烷 挑战创新 某实验小组用下列装置(夹持装置已省略)进行乙醇的实验,请回答下列问题: (1)A 中发生反应的化学方程式为 ,还可以 用 代替 MnO2 的作用。 (2)实验过程中 M 处铜丝网有红色和黑色交替出现的现象,请用化学方程式解释原因。 现象①:红色变黑色, ; 现象②:黑色变红色, ,其反应类型为 。 (3)由于反应速率不易控制,在 F 装置中有可能产生倒吸,所以 F 装置可改用 (填字母) 装置。 (4)实验室可对 E 部分采取合理的操作方法以防止安全隐患,请对此提出你的意见: 。 答案(1)2H2O2 2H2O+O2↑ FeCl3 溶液 (2)2Cu+O2 2CuO CH3CH2OH+CuO CH3CHO+Cu+H2O 氧化反应 (3)ab (4)可以采用在反应开始后撤去 E 处酒精灯或不用 E 处酒精灯,反应开始时把红热的铜丝网 直接放入 E 装置的操作方式 解析(1)A 装置中 H2O2 溶液在 MnO2 的催化作用下分解生成 O2,也可以用 FeCl3 溶液代替 MnO2 起催化作用。 (2)红色变黑色是由于 Cu 与 O2 发生反应生成了黑色的 CuO,黑色变红色是由于 CuO 被乙醇 还原成了单质 Cu。 (3)装置 a、b 既能保证乙醛的吸收,又能防止倒吸。 (4)乙醇催化氧化的反应是放热反应,反应放出的热量能够维持反应的进行,不必在 E 处持续 加热