
第3课时 硝酸 酸雨及防治 课后·训练提升 合格考基础巩固 1如图表示酸雨的形成,下列关于酸雨的说法正确的是 NO2→HNO3 S02+H2S04 NOs、SO2 A.酸雨的pH为5.6 B.酸雨的形成过程发生了氧化还原反应 C酸雨的主要成分为氮、硫元素的氧化物 D形成酸雨的主要原因是雷雨天气 答案B 解析酸雨的pH小于5.6,A项错误;酸雨的形成过程发生了氧化还原反应,B项正确;酸雨的主 要成分为氮、硫元素的含氧酸,C项错误:形成酸雨的主要原因是氮、硫元素氧化物的排放,D 项错误。 2.汽车尾气装置中,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是 ()。 NO、O2 CO2、N NO 催化剂 A.反应中NO为氧化剂,N2为氧化产物 B.汽车尾气的主要污染成分包括CO、NO和N2 C.NO与O2必须在催化剂表面才能反应 D催化转化总化学方程式为2N0+O+4CC催化 -4CO2+N2 答案D 解析反应过程中NO、O2为氧化剂,N2为还原产物;汽车尾气中的N2不是污染物;NO与O2 的反应不需要催化剂:根据题中的图示,可将反应的过程分成如下两步写:2NO+O: 催化剂 2NO2,2NO2+4CO一N2+4CO2.将两步反应合并可得总化学方程式为2NO+O2+4CC一 4CO2+N2. 3.下列反应中,硝酸既表现酸性,又表现氧化性的是()。 A使石蕊溶液变红 B.与铜反应放出NO气体,生成CuNO3)2 C.与NaCO,反应放出CO2气体,生成NaNO: D.与S单质混合共热时生成HSO4和NO2 答案B 解析A项,HNO;只表现酸性;B项,Cu与稀硝酸反应时,部分起酸的作用生成Cu(NO)2,部分 做氧化剂被还原为NO,C项,2HNO+NaCO:一CO2↑+HO+2NaNO3,HNO3只表现强酸性;D 项,HNO3将S氧化为HSO4,自身被还原为NO2,在该反应中HNO3只表现强氧化性。 4.下列离子方程式正确的是()。 A.Zn与稀硝酸反应:Zn+2HZn2++H2↑ B.Fe与过量稀硝酸反应:3Fe+8H+2N03一3Fe2+2NO↑+4HO
第 3 课时 硝酸 酸雨及防治 课后· 合格考基础巩固 1.如图表示酸雨的形成,下列关于酸雨的说法正确的是 ( )。 A.酸雨的 pH 为 5.6 B.酸雨的形成过程发生了氧化还原反应 C.酸雨的主要成分为氮、硫元素的氧化物 D.形成酸雨的主要原因是雷雨天气 答案 B 解析酸雨的 pH 小于 5.6,A 项错误;酸雨的形成过程发生了氧化还原反应,B 项正确;酸雨的主 要成分为氮、硫元素的含氧酸,C 项错误;形成酸雨的主要原因是氮、硫元素氧化物的排放,D 项错误。 2.汽车尾气装置中,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是 ( )。 A.反应中 NO 为氧化剂,N2 为氧化产物 B.汽车尾气的主要污染成分包括 CO、NO 和 N2 C.NO 与 O2 必须在催化剂表面才能反应 D.催化转化总化学方程式为 2NO+O2+4CO 4CO2+N2 答案 D 解析反应过程中 NO、O2 为氧化剂,N2 为还原产物;汽车尾气中的 N2 不是污染物;NO 与 O2 的反应不需要催化剂;根据题中的图示,可将反应的过程分成如下两步写:2NO+O2 2NO2,2NO2+4CO N2+4CO2,将两步反应合并可得总化学方程式为 2NO+O2+4CO 4CO2+N2。 3.下列反应中,硝酸既表现酸性,又表现氧化性的是( )。 A.使石蕊溶液变红 B.与铜反应放出 NO 气体,生成 Cu(NO3)2 C.与 Na2CO3 反应放出 CO2 气体,生成 NaNO3 D.与 S 单质混合共热时生成 H2SO4 和 NO2 答案 B 解析 A 项,HNO3 只表现酸性;B 项,Cu 与稀硝酸反应时,部分起酸的作用生成 Cu(NO3)2,部分 做氧化剂被还原为 NO;C 项,2HNO3+Na2CO3 CO2↑+H2O+2NaNO3,HNO3 只表现强酸性;D 项,HNO3 将 S 氧化为 H2SO4,自身被还原为 NO2,在该反应中 HNO3 只表现强氧化性。 4.下列离子方程式正确的是( )。 A.Zn 与稀硝酸反应:Zn+2H+ Zn2++H2↑ B.Fe 与过量稀硝酸反应:3Fe+8H++2NO3 - 3Fe2++2NO↑+4H2O
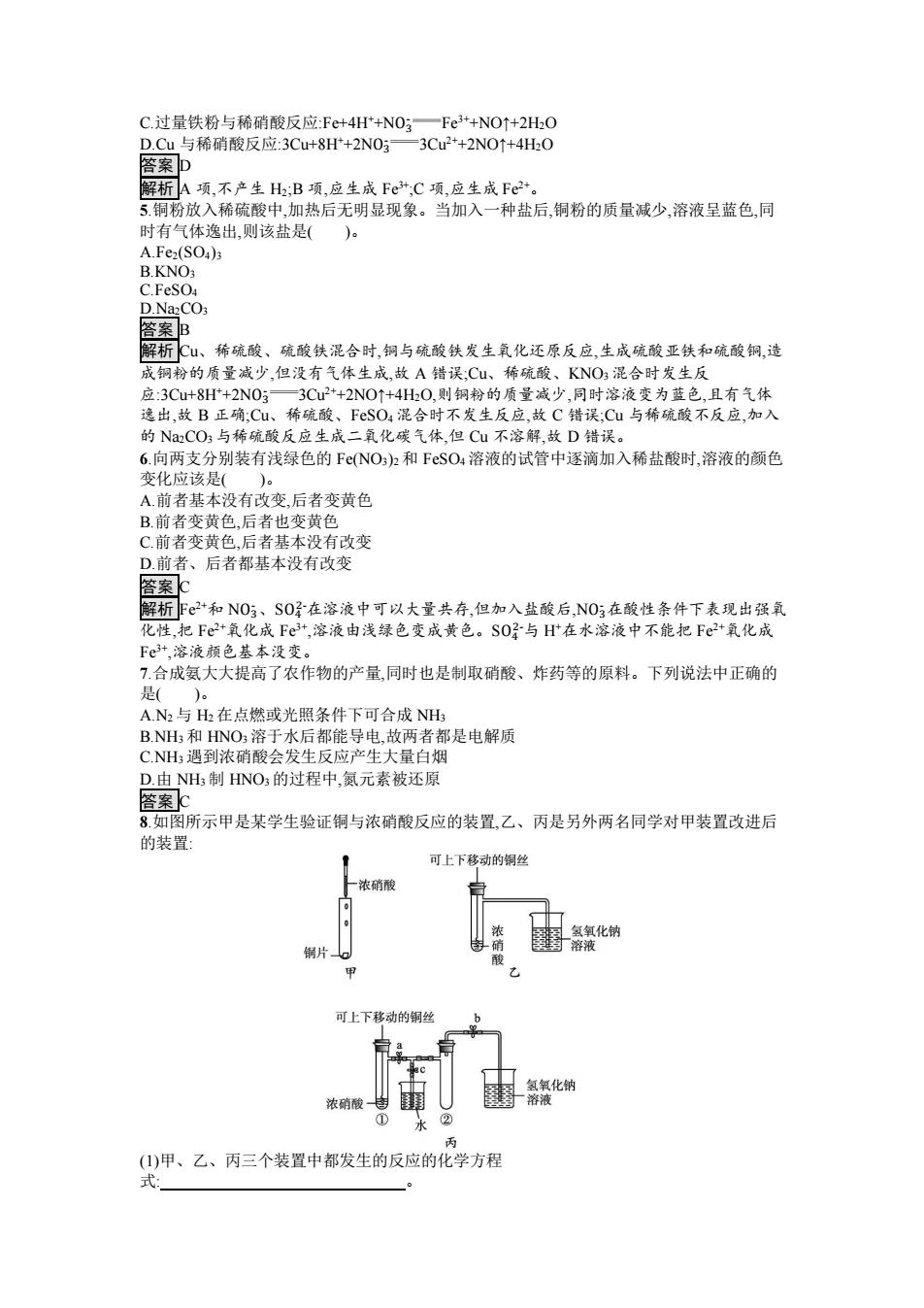
C.过量铁粉与稀硝酸反应:Fe+4H*+NO;一Fe3+NO↑+2HO D.Cu与稀硝酸反应:3Cu+8H+2N03一3Cu2+2NO↑+4HO 答案p 解析A项,不产生H2;B项,应生成Fe+;C项,应生成Fc2+。 5.铜粉放入稀硫酸中,加热后无明显现象。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同 时有气体逸出,则该盐是( )。 A.Fe2(SO4)3 B.KNO C.FeSO4 D.NazCO3 答案B 解析C、稀硫酸、硫酸铁混合时,铜与硫酸铁发生氧化还原反应,生成硫酸亚铁和硫酸铜,造 成铜粉的质量减少,但没有气体生成,故A错误:Cu、稀硫酸、KNO3混合时发生反 应:3Cu+8H*+2N03一3Cu2+2NO↑+4H0,则铜粉的质量减少,同时溶液变为蓝色,且有气体 逸出,故B正确:Cu、稀硫酸、FSO4混合时不发生反应,故C错误;Cu与稀硫酸不反应,加入 的N2CO3与稀硫酸反应生成二氧化碳气体,但Cu不溶解,故D错误。 6.向两支分别装有浅绿色的FeNO,)2和FSO4溶液的试管中逐滴加入稀盐酸时,溶液的颜色 变化应该是()。 A前者基本没有改变,后者变黄色 B.前者变黄色,后者也变黄色 C.前者变黄色.后者基本没有改变 D.前者、后者都基本没有改变 答案C 解析F2+和NO3、S0子在溶液中可以大量共存,但加入盐酸后,N03在酸性条件下表现出强氧 化性,把Fe2+氧化成Fe3+,溶液由浅绿色变成黄色。S0子与H在水溶液中不能把Fe2+氧化成 Fe3+,溶液颜色基本没变。 7.合成氨大大提高了农作物的产量,同时也是制取硝酸、炸药等的原料。下列说法中正确的 是()。 A.N2与H2在点燃或光照条件下可合成NH B.NH3和HNO3溶于水后都能导电,故两者都是电解质 C.NH遇到浓硝酸会发生反应产生大量白烟 D.由NH制HNO3的过程中,氮元素被还原 答案c 8如图所示甲是某学生验证铜与浓硝酸反应的装置,乙、丙是另外两名同学对甲装置改进后 的装置: 可上下移动的铜丝 浓硝酸 氢氧化钠 铜片 硝 溶液 甲 可上下移动的铜丝 氢氧化钠 浓硝酸 溶液 ① 丙 (1)甲、乙、丙三个装置中都发生的反应的化学方程 式:
C.过量铁粉与稀硝酸反应:Fe+4H++NO3 - Fe3++NO↑+2H2O D.Cu 与稀硝酸反应:3Cu+8H++2NO3 - 3Cu2++2NO↑+4H2O 答案 D 解析 A 项,不产生 H2;B 项,应生成 Fe3+;C 项,应生成 Fe2+。 5.铜粉放入稀硫酸中,加热后无明显现象。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同 时有气体逸出,则该盐是( )。 A.Fe2(SO4)3 B.KNO3 C.FeSO4 D.Na2CO3 答案 B 解析 Cu、稀硫酸、硫酸铁混合时,铜与硫酸铁发生氧化还原反应,生成硫酸亚铁和硫酸铜,造 成铜粉的质量减少,但没有气体生成,故 A 错误;Cu、稀硫酸、KNO3 混合时发生反 应:3Cu+8H++2NO3 - 3Cu2++2NO↑+4H2O,则铜粉的质量减少,同时溶液变为蓝色,且有气体 逸出,故 B 正确;Cu、稀硫酸、FeSO4 混合时不发生反应,故 C 错误;Cu 与稀硫酸不反应,加入 的 Na2CO3 与稀硫酸反应生成二氧化碳气体,但 Cu 不溶解,故 D 错误。 6.向两支分别装有浅绿色的 Fe(NO3)2 和 FeSO4 溶液的试管中逐滴加入稀盐酸时,溶液的颜色 变化应该是( )。 A.前者基本没有改变,后者变黄色 B.前者变黄色,后者也变黄色 C.前者变黄色,后者基本没有改变 D.前者、后者都基本没有改变 答案 C 解析 Fe2+和 NO3 - 、SO4 2-在溶液中可以大量共存,但加入盐酸后,NO3 - 在酸性条件下表现出强氧 化性,把 Fe2+氧化成 Fe3+ ,溶液由浅绿色变成黄色。SO4 2-与 H+在水溶液中不能把 Fe2+氧化成 Fe3+ ,溶液颜色基本没变。 7.合成氨大大提高了农作物的产量,同时也是制取硝酸、炸药等的原料。下列说法中正确的 是( )。 A.N2 与 H2 在点燃或光照条件下可合成 NH3 B.NH3 和 HNO3 溶于水后都能导电,故两者都是电解质 C.NH3 遇到浓硝酸会发生反应产生大量白烟 D.由 NH3 制 HNO3 的过程中,氮元素被还原 答案 C 8.如图所示甲是某学生验证铜与浓硝酸反应的装置,乙、丙是另外两名同学对甲装置改进后 的装置: (1)甲、乙、丙三个装置中都发生的反应的化学方程 式:

(2)和甲装置相比,乙装置的优点是① ② (3)为了进一步验证NO2与水的反应,某学生设计了丙装置。实验时先关闭弹簧夹 再打开弹簧夹 ,才能使NO2气体充满②试管,当气体充满②试管后,将铜丝提起与溶 液脱离。欲使烧杯中的水进入②试管,应该 答案1)Cu+4HNOs(浓,一CuNO3)2+2NO2t+2H2O (2)①可以控制反应②吸收NO2气体,防止污染环境 (3)cab先关闭b,再关闭a,然后打开c,用手焐住试管② 解析铜与浓硝酸反应的化学方程式是Cu+4HNO5(浓,一CuNO3)2+2NO2↑+2HO。根据题 目给定的装置图可知,乙装置有尾气处理装置,同时可以通过移动铜丝来控制反应的发生与停 止。实验丙中,实验时先关闭弹簧夹c,再打开弹簧夹a、b,才能使NO2气体充满②试管;当气 体充满②试管后,将铜丝提起与溶液脱离停止反应。欲使烧杯中的水进入②试管应该先关闭 b,再关闭a,然后打开c,用手焐住试管②。 9.按要求回答下列问题: (1)有时在实验室看到的硝酸显黄色,理由是 实验室保存硝酸的方法是」 (2)铜与足量浓硝酸反应时,表现酸性的硝酸与做氧化剂的HNO,物质的量之比为 (3)一定量的浓硝酸与足量的铜充分反应,生成气体的成分有」 ,写出反应的离子方程 式 。 向反应后的溶液中加入稀硫酸,如果反应,写出反应的离子方 程式: (4)从某金属粉末(含有Au、Cu、Ag)中分离出Au,加入的试剂是 ,写出Ag参与反应的 化学方程式: 答案1)久置的硝酸显黄色是硝酸见光或受热发生了分解,生成的NO2溶于浓硝酸所致应 保存在棕色试剂瓶中,并置于阴凉处 (2)1:1 (3)NO2、NOCu+4H+2N052NO2↑+2HO+Cu2+,3Cu+8H+2N033Cu2+2NO↑+4H2O 3Cu+8Ht+2N05—3Cu2*+2NO↑+4H20 (4)稀硝酸3Ag+4HNO3(稀)一3AgNO3+NO↑+2HO 等级考拓展提高 1.下列关于铜与浓硝酸反应的说法中错误的是( )。 AHNO3是氧化剂,NO2是还原产物 B.若2 mol HNO3被还原,则反应中一定生成22.4LNO2气体 C.参加反应的硝酸中,被还原和未被还原的硝酸的物质的量之比是1:1 D.硝酸在反应中,既表现强氧化性,又表现酸性 答案B 解析题目没有指明温度和压强,故无法确定气体的摩尔体积,无法计算气体的体积,B项错 误。 2.(双选)某学习小组为研究铜与浓硝酸、稀硝酸反应的差异,设计了如图所示的实验装置(夹 持装置己省略)。 浓硝酸 C02+ 尾气处理 弹簧 -水 铜片 铜粉 A B C 下列说法不正确的是()。 A.反应开始前通入过量的CO2气体,目的是排除装置内的空气 B.A中的离子方程式为3Cu+2N05+8H一3Cu2+2NO↑+4HO C.当B中0.03mol铜粉被氧化时,B中产生的NO气体大于0.02mol
(2)和甲装置相比,乙装置的优点是① ; ② 。 (3)为了进一步验证 NO2 与水的反应,某学生设计了丙装置。实验时先关闭弹簧夹 , 再打开弹簧夹 ,才能使 NO2 气体充满②试管;当气体充满②试管后,将铜丝提起与溶 液脱离。欲使烧杯中的水进入②试管,应该 。 答案(1)Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O (2)①可以控制反应 ②吸收 NO2 气体,防止污染环境 (3)c ab 先关闭 b,再关闭 a,然后打开 c,用手焐住试管② 解析铜与浓硝酸反应的化学方程式是 Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O。根据题 目给定的装置图可知,乙装置有尾气处理装置,同时可以通过移动铜丝来控制反应的发生与停 止。实验丙中,实验时先关闭弹簧夹 c,再打开弹簧夹 a、b,才能使 NO2 气体充满②试管;当气 体充满②试管后,将铜丝提起与溶液脱离停止反应。欲使烧杯中的水进入②试管应该先关闭 b,再关闭 a,然后打开 c,用手焐住试管②。 9.按要求回答下列问题: (1)有时在实验室看到的硝酸显黄色,理由是 。 实验室保存硝酸的方法是 。 (2)铜与足量浓硝酸反应时,表现酸性的硝酸与做氧化剂的 HNO3 物质的量之比为 。 (3)一定量的浓硝酸与足量的铜充分反应,生成气体的成分有 ,写出反应的离子方程 式: 。向反应后的溶液中加入稀硫酸,如果反应,写出反应的离子方 程式: 。 (4)从某金属粉末(含有 Au、Cu、Ag)中分离出 Au,加入的试剂是 ,写出 Ag 参与反应的 化学方程式: 。 答案(1)久置的硝酸显黄色是硝酸见光或受热发生了分解,生成的 NO2 溶于浓硝酸所致 应 保存在棕色试剂瓶中,并置于阴凉处 (2)1∶1 (3)NO2、NO Cu+4H++2NO3 - 2NO2↑+2H2O+Cu2+,3Cu+8H++2NO3 - 3Cu2++2NO↑+4H2O 3Cu+8H++2NO3 - 3Cu2++2NO↑+4H2O (4)稀硝酸 3Ag+4HNO3(稀) 3AgNO3+NO↑+2H2O 等级考拓展提高 1.下列关于铜与浓硝酸反应的说法中错误的是( )。 A.HNO3 是氧化剂,NO2 是还原产物 B.若 2 mol HNO3 被还原,则反应中一定生成 22.4 L NO2 气体 C.参加反应的硝酸中,被还原和未被还原的硝酸的物质的量之比是 1∶1 D.硝酸在反应中,既表现强氧化性,又表现酸性 答案 B 解析题目没有指明温度和压强,故无法确定气体的摩尔体积,无法计算气体的体积,B 项错 误。 2.(双选)某学习小组为研究铜与浓硝酸、稀硝酸反应的差异,设计了如图所示的实验装置(夹 持装置已省略)。 下列说法不正确的是( )。 A.反应开始前通入过量的 CO2 气体,目的是排除装置内的空气 B.A 中的离子方程式为 3Cu+2NO3 - +8H+ 3Cu2++2NO↑+4H2O C.当 B 中 0.03 mol 铜粉被氧化时,B 中产生的 NO 气体大于 0.02 mol

D.C装置中装入一定量的水进行尾气处理 答案BD 解析反应开始前通入过量的CO2气体,目的是排除装置内的空气,A项正确;A中铜与浓硝酸 反应的离子方程式为Cu+2N03+4H一Cu2+2NO2↑+2HO,B项错误;B中发生反应 3NO2+HO一2HNO3+NO,3Cu+8HNO3一3CuNO3)2+2NO↑+4HO,因此当B中0.03mol钢 粉被氧化时B中产生的NO气体大于0.02mol,C项正确:NO不溶于水,C装置中装入一定量 的水不能进行尾气处理,D项错误。 3.下述实验中均有红棕色气体产生,对比分析下列所得结论不正确的是( )o 灼热碎玻璃 ,红热木炭 十红热木炭 浓硝酸 予浓硝酸 多浓硝酸 ② ③ A.由①中的红棕色气体,推断产生的气体一定是混合气体 B.红棕色气体不能表明②中木炭与浓硝酸发生了反应 C.由③说明浓硝酸具有挥发性生成的红棕色气体为还原产物 D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 答案D 解析①中灼热碎玻璃起加热作用,浓硝酸受热分解生成红棕色NO2,硝酸中氮元素化合价降 低,必有元素化合价升高,只能为氧元素,因此,还有O2生成,产生的气体为混合气体,A项正确 由①可知,浓硝酸受热分解可生成红棕色气体,所以②中产生的“红棕色气体”不一定是木炭与 浓硝酸发生反应产生的,B项正确:③中浓硝酸挥发才能与红热木炭接触,产生的NO2是还原 产物,C项正确:红热的木炭还可与空气中的O2反应生成CO2,不一定是木炭与浓硝酸发生反 应生成了CO2,D项错误。 4.现有稀硫酸和稀硝酸的混合溶液.已知其中稀硫酸浓度为4molL1,稀硝酸的浓度为2 molL。取10mL混合酸,向其中加入过量铁粉,反应结束后,在标准状况下可收集到气体的 体积为(假设HNO,只被还原为NO) A.0.224L B.0.448L C.0.672L D.0.896L 答案c 解析该题解题的关键是运用离子方程式计算并考虑过量的H继续反应的情况。混合溶液中 nH)=(2×4molL1+2mol-L)×0.01L=0.1mol,nN0)=2 mol-L-!×0.01L=0.02mol,根据题意, 发生反应的离子方程式为3Fe+2N03+8H一3Fe2+2NO↑+4HO,N03完全反 应,nNO)=nN03)=0.02mol,剩余n(H)=0.02mol,与过量的铁粉发生反应Fe+2H Fe2+Ht,H)-02mol0.01mol,因此收集到的气体是N0和H,的混合物,标准状况 2 下气体体积为(0.02mol+0.01mol)×22.4Lmol1=0.672L。 5.如图是用浓硝酸、铜片、蒸馏水等试剂探究浓硝酸、稀硝酸的强氧化性并观察还原产物 的实验装置。 I.浓硝酸的强氧化性实验。 将铜片置于具支试管的底部,在分液漏斗中加入约5mL浓硝酸,向具支试管中放入约2L 浓硝酸,用排水法收集产生的气体
D.C 装置中装入一定量的水进行尾气处理 答案 BD 解析反应开始前通入过量的 CO2 气体,目的是排除装置内的空气,A 项正确;A 中铜与浓硝酸 反应的离子方程式为 Cu+2NO3 - +4H+ Cu2++2NO2↑+2H2O,B 项错误;B 中发生反应 3NO2+H2O 2HNO3+NO,3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O,因此当 B 中 0.03 mol 铜 粉被氧化时,B 中产生的 NO 气体大于 0.02 mol,C 项正确;NO 不溶于水,C 装置中装入一定量 的水不能进行尾气处理,D 项错误。 3.下述实验中均有红棕色气体产生,对比分析下列所得结论不正确的是( )。 ① ② ③ A.由①中的红棕色气体,推断产生的气体一定是混合气体 B.红棕色气体不能表明②中木炭与浓硝酸发生了反应 C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 D.③的气体产物中检测出 CO2,由此说明木炭一定与浓硝酸发生了反应 答案 D 解析①中灼热碎玻璃起加热作用,浓硝酸受热分解生成红棕色 NO2,硝酸中氮元素化合价降 低,必有元素化合价升高,只能为氧元素,因此,还有 O2 生成,产生的气体为混合气体,A 项正确; 由①可知,浓硝酸受热分解可生成红棕色气体,所以②中产生的“红棕色气体”不一定是木炭与 浓硝酸发生反应产生的,B 项正确;③中浓硝酸挥发才能与红热木炭接触,产生的 NO2 是还原 产物,C 项正确;红热的木炭还可与空气中的 O2 反应生成 CO2,不一定是木炭与浓硝酸发生反 应生成了 CO2,D 项错误。 4.现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸浓度为 4 mol·L -1 ,稀硝酸的浓度为 2 mol·L -1。取 10 mL 混合酸,向其中加入过量铁粉,反应结束后,在标准状况下可收集到气体的 体积为(假设 HNO3 只被还原为 NO) ( )。 A.0.224 L B.0.448 L C.0.672 L D.0.896 L 答案 C 解析该题解题的关键是运用离子方程式计算并考虑过量的 H+继续反应的情况。混合溶液中 n(H+ )=(2×4 mol·L -1+2 mol·L -1 )×0.01 L=0.1 mol,n(NO3 - )=2 mol·L -1×0.01 L=0.02 mol,根据题意, 发生反应的离子方程式为 3Fe+2NO3 - +8H+ 3Fe2++2NO↑+4H2O,NO3 - 完全反 应,n(NO)=n(NO3 - )=0.02 mol;剩余 n(H+ )=0.02 mol,与过量的铁粉发生反应 Fe+2H+ Fe2++H2↑,n(H2)=𝑛(H +) 2 = 0.02mol 2 =0.01 mol,因此收集到的气体是 NO 和 H2 的混合物,标准状况 下气体体积为(0.02 mol+0.01 mol)×22.4 L·mol-1=0.672 L。 5.如图是用浓硝酸、铜片、蒸馏水等试剂探究浓硝酸、稀硝酸的强氧化性并观察还原产物 的实验装置。 Ⅰ.浓硝酸的强氧化性实验。 将铜片置于具支试管的底部,在分液漏斗中加入约 5 mL 浓硝酸,向具支试管中放入约 2 mL 浓硝酸,用排水法收集产生的气体

管 (1)具支试管中发生反应的化学方程式: (2)实验中观察到能证明浓硝酸具有强氧化性的现象是 Ⅱ.稀硝酸的强氧化性实验。 (3)上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,需紧接进行的简便、合理的实验 操作是 (4)能证明稀硝酸与铜反应产生NO的实验现象是 (填字母)。 A.c中收集到无色气体 B.c中收集到的无色气体接触空气后变为红棕色 C.b中产生的无色气体接触空气后变为红棕色 Ⅲ实验反思。 (5)利用该装置先进行铜与浓硝酸反应,再进行铜与稀硝酸反应的实验,其好处是 V问题讨论。 用等质量的铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者 呈绿色后者呈蓝色。对此有两种说法: ①两者颜色不同的原因是Cu+浓度差异引起的。 ②前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。 (6)你认为上述说法 (填“①”或“②合理。若是①合理,说明理由;若是②合理,设计一 个简单实验证明: 答案I.(I)Cu+4HNO3(浓,一CuNO3)2+2NO2↑+2HO (2)铜片逐渐溶解,溶液变蓝,放出红棕色气体 Ⅱ.(3)向分液漏斗中加蒸馏水稀释浓硝酸,打开活塞,滴入稀硝酸 (4)C Ⅲ.(⑤)利用Cu与浓硝酸反应生成的NO2将具支试管中的空气排出,有利于观察Cu与稀硝酸 的反应产物 V.(6)②向蓝色溶液中通入NO2,溶液变成绿色(或加热绿色溶液,有红棕色气体产生,溶液变 成蓝色) 解析I.钢与浓硝酸反应的化学方程式为Cu+4HNO3(浓,一Cu(NO)2+2NO2↑+2HO,实验中 具支试管中溶液变蓝.且有红棕色气体产生。 川~Ⅱ向分液漏斗中加蒸馏水将浓硝酸稀释后,可以继续进行铜与稀硝酸反应的实验,这样可 以利用Cu与浓硝酸反应产生的NO2将具支试管中的空气排出,有利于观察铜与稀硝酸反应 的产物。 Ⅳ.由于硝酸均过量,铜的质量相同,溶液的体积相同,所以钢无论是与稀硝酸反应,还是与浓硝 酸反应,生成的Cu+的浓度是相同的,说法①是不合理的。可通过向蓝色溶液中通入NO2看 溶液是否变绿,或加热绿色溶液看是否有红棕色气体产生来证明。 挑战创新 己知木炭在一定条件下与浓硝酸反应生成两种+4价的氧化物,为了探究一氧化氮NO)能 否与过氧化钠反应,以及反应后的产物中是否有亚硝酸钠NNO2),某小组同学设计了如图所 示装置(夹持装置和连接用的胶管己略去)
(1)具支试管中发生反应的化学方程式: 。 (2)实验中观察到能证明浓硝酸具有强氧化性的现象是 。 Ⅱ.稀硝酸的强氧化性实验。 (3)上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,需紧接进行的简便、合理的实验 操作是 。 (4)能证明稀硝酸与铜反应产生 NO 的实验现象是 (填字母)。 A.c 中收集到无色气体 B.c 中收集到的无色气体接触空气后变为红棕色 C.b 中产生的无色气体接触空气后变为红棕色 Ⅲ.实验反思。 (5)利用该装置先进行铜与浓硝酸反应,再进行铜与稀硝酸反应的实验,其好处是 。 Ⅳ.问题讨论。 用等质量的铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者 呈绿色,后者呈蓝色。对此有两种说法: ①两者颜色不同的原因是 Cu2+浓度差异引起的。 ②前者溶液呈绿色,是因为生成的红棕色 NO2 溶解于溶液中引起的。 (6)你认为上述说法 (填“①”或“②”)合理。若是①合理,说明理由;若是②合理,设计一 个简单实验证明: 。 答案Ⅰ.(1)Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O (2)铜片逐渐溶解,溶液变蓝,放出红棕色气体 Ⅱ.(3)向分液漏斗中加蒸馏水稀释浓硝酸,打开活塞,滴入稀硝酸 (4)C Ⅲ.(5)利用 Cu 与浓硝酸反应生成的 NO2 将具支试管中的空气排出,有利于观察 Cu 与稀硝酸 的反应产物 Ⅳ.(6)② 向蓝色溶液中通入 NO2,溶液变成绿色(或加热绿色溶液,有红棕色气体产生,溶液变 成蓝色) 解析Ⅰ.铜与浓硝酸反应的化学方程式为 Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O,实验中 具支试管中溶液变蓝,且有红棕色气体产生。 Ⅱ~Ⅲ.向分液漏斗中加蒸馏水将浓硝酸稀释后,可以继续进行铜与稀硝酸反应的实验,这样可 以利用 Cu 与浓硝酸反应产生的 NO2 将具支试管中的空气排出,有利于观察铜与稀硝酸反应 的产物。 Ⅳ.由于硝酸均过量,铜的质量相同,溶液的体积相同,所以铜无论是与稀硝酸反应,还是与浓硝 酸反应,生成的 Cu2+的浓度是相同的,说法①是不合理的。可通过向蓝色溶液中通入 NO2 看 溶液是否变绿,或加热绿色溶液看是否有红棕色气体产生来证明。 挑战创新 已知木炭在一定条件下与浓硝酸反应生成两种+4 价的氧化物,为了探究一氧化氮(NO)能 否与过氧化钠反应,以及反应后的产物中是否有亚硝酸钠(NaNO2),某小组同学设计了如图所 示装置(夹持装置和连接用的胶管已略去)

浓硝酸 氮气 接尾气处理装置 石棉绒上铺 有过氧化钠 b fg 铜片 D E (1)为了完成该实验,虚线框内还需要连接B~E四套装置,按气流方向连接的顺序为 a→()()→()()→()()→( )()(填仪器接口的字母编号)。连接 好仪器(装置气密性良好),装入试剂后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯。 通入氮气的主要目的是 (2)装置E中观察到的主要实验现象有」 (3)装置C的作用是 (4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮和二氧化 氮。装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生 成 (写出实验步骤及现象)。 窨1)h i d e b c f g(或h i d e b c g)排尽装置中的空气,防止一氧化氮被空气中的氧气氧化为二氧化氮 (2)溶液由无色变为蓝色,有无色气体逸出 (3)除去一氧化氮中的二氧化碳 (4)取少量D中的固体放入试管中,加入稀硫酸,若溶液中有气泡产生,且在试管液面上方出现 红棕色气体,则证明D中有亚硝酸钠生成(或其他合理答案) 解标1)由题意可知A中发生的反应为C+4HNO:(浓△CO2t+4NO2t+2H0,故a处出来的 气体有CO2、NO2和少量水蒸气。要得到NO,则要在装置E中发生反应3NO2+( 2HNO3+NO,3Cu+8HNOs(稀)一3CuNO3)2+2NO↑+4HO,为了防止NO被氧化为NO2,装置 中要保持无氧的条件,则装入试剂后,要先通入一段时间氮气,再滴加浓硝酸,最后点燃酒精 灯。从装置E中出来的气体是CO2、NO和少量的水蒸气。要得到千燥的NO,要先用装置 C除去CO2,后用装置B除去水蒸气。在装置D中探究一氧化氮(NO)能否与过氧化钠反应, 因此按气流方向连接的顺序为a→h→i→d→e→b→c→f→g(或 a→h→i→d→e→b→c→g一→f)。(2)装置E中溶液由无色变成蓝色,有无色气体逸出。(3)装置 C的作用是除去一氧化氨中的二氧化碳。(4)根据题给信息,可以利用HNO2的不稳定性,证明 D中是否有亚硝酸钠生成,其原理为取少量D中的固体放入试管中,加入稀硫酸,若溶液中有 气泡产生,且在试管液面上方出现红棕色气体,则证明D中有亚硝酸钠生成
(1)为了完成该实验,虚线框内还需要连接 B~E 四套装置,按气流方向连接的顺序为 a→( )( )→( )( )→( )( )→( )( )(填仪器接口的字母编号)。连接 好仪器(装置气密性良好),装入试剂后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯。 通入氮气的主要目的是 。 (2)装置 E 中观察到的主要实验现象有 。 (3)装置 C 的作用是 。 (4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮和二氧化 氮。装置 D 中充分反应后,设计实验证明 D 中是否有亚硝酸钠生 成:___________________(写出实验步骤及现象)。 答案(1)h i d e b c f g(或 h i d e b c g f) 排尽装置中的空气,防止一氧化氮被空气中的氧气氧化为二氧化氮 (2)溶液由无色变为蓝色,有无色气体逸出 (3)除去一氧化氮中的二氧化碳 (4)取少量 D 中的固体放入试管中,加入稀硫酸,若溶液中有气泡产生,且在试管液面上方出现 红棕色气体,则证明 D 中有亚硝酸钠生成(或其他合理答案) 解析(1)由题意可知 A 中发生的反应为 C+4HNO3(浓) CO2↑+4NO2↑+2H2O,故 a 处出来的 气体有 CO2、NO2 和少量水蒸气。要得到 NO,则要在装置 E 中发生反应 3NO2+H2O 2HNO3+NO,3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O,为了防止 NO 被氧化为 NO2,装置 中要保持无氧的条件,则装入试剂后,要先通入一段时间氮气,再滴加浓硝酸,最后点燃酒精 灯。从装置 E 中出来的气体是 CO2、NO 和少量的水蒸气。要得到干燥的 NO,要先用装置 C 除去 CO2,后用装置 B 除去水蒸气。在装置 D 中探究一氧化氮(NO)能否与过氧化钠反应, 因此按气流方向连接的顺序为 a→h→i→d→e→b→c→f→g(或 a→h→i→d→e→b→c→g→f)。(2)装置 E 中溶液由无色变成蓝色,有无色气体逸出。(3)装置 C 的作用是除去一氧化氮中的二氧化碳。(4)根据题给信息,可以利用 HNO2 的不稳定性,证明 D 中是否有亚硝酸钠生成,其原理为取少量 D 中的固体放入试管中,加入稀硫酸,若溶液中有 气泡产生,且在试管液面上方出现红棕色气体,则证明 D 中有亚硝酸钠生成