
第2课时 氨和铵盐 课后·训练提升 合格考基础巩固 1.下列说法中正确的是( )o A氨水的密度比水的密度小,且浓度越大,密度越大 B.氨是无色无臭的气体 C.可用向上排空气法收集氨 D氨溶于水所得的溶液可使酚酞溶液变为红色 答案D 2.下列关于氨的喷泉实验形成的原理解释正确的是( )。 A氨呈碱性 B.氨极易溶于水,烧瓶内外形成压强差 C.氨易液化 D.NH溶于水后形成的溶液易挥发 窨案B 解析氨之所以能做喷泉实验,是由于胶头滴管挤入的少量水可使烧瓶内的氨迅速溶于水,烧 瓶内外产生了压强差。 3.将湿润的红色石蕊试纸放在进行下列实验的试管口,试纸不变蓝的有()。 A.加热浓氨水 B.加热NH4CI和浓NaOH的混合溶液 C.加热NH4CI和Ca(OH2的混合物 D.加热饱和NH4CI溶液 含案D 4.现欲分离氯化钠和氯化铵的混合物,可采用的方法是 A.加入NaOH溶液 B.加入AgNO3溶液 C加热并冷却 D加入水 答案c 解析NaCI受热没有明显变化,NH,CI加热分解,同时生成的NH和HCI气体导出后又能迅速 化合生成NH4C。 5.下列关于氨的叙述中,正确的是()。 A氨因为有刺激性气味,因此不用来作制冷剂 B.氨具有还原性,可以被氧化为NO C.氨极易溶于水,因此氨水比较稳定(不容易分解) D.氨溶于水显弱碱性,因此可使石蕊溶液变为红色 答案B 解析液氨汽化需要吸收大量的热,所以氨具有制冷作用,液氨常用作制冷剂,A项错误;氨中氨 元素为最低负化合价-3价,氨能够被氧化生成一氧化氮,B项正确;一水合氨不稳定,受热易分 解,C项错误;氨溶于水显弱碱性,因此可使石蕊溶液变为蓝色,D项错误。 6.下列装置用于进行指定实验时,能达到实验目的的是 ()
第 2 课时 氨和铵盐 课后· 合格考基础巩固 1.下列说法中正确的是( )。 A.氨水的密度比水的密度小,且浓度越大,密度越大 B.氨是无色无臭的气体 C.可用向上排空气法收集氨 D.氨溶于水所得的溶液可使酚酞溶液变为红色 答案 D 2.下列关于氨的喷泉实验形成的原理解释正确的是( )。 A.氨呈碱性 B.氨极易溶于水,烧瓶内外形成压强差 C.氨易液化 D.NH3 溶于水后形成的溶液易挥发 答案 B 解析氨之所以能做喷泉实验,是由于胶头滴管挤入的少量水可使烧瓶内的氨迅速溶于水,烧 瓶内外产生了压强差。 3.将湿润的红色石蕊试纸放在进行下列实验的试管口,试纸不变蓝的有( )。 A.加热浓氨水 B.加热 NH4Cl 和浓 NaOH 的混合溶液 C.加热 NH4Cl 和 Ca(OH)2 的混合物 D.加热饱和 NH4Cl 溶液 答案 D 4.现欲分离氯化钠和氯化铵的混合物,可采用的方法是 ( )。 A.加入 NaOH 溶液 B.加入 AgNO3 溶液 C.加热并冷却 D.加入水 答案 C 解析 NaCl 受热没有明显变化,NH4Cl 加热分解,同时生成的 NH3 和 HCl 气体导出后又能迅速 化合生成 NH4Cl。 5.下列关于氨的叙述中,正确的是( )。 A.氨因为有刺激性气味,因此不用来作制冷剂 B.氨具有还原性,可以被氧化为 NO C.氨极易溶于水,因此氨水比较稳定(不容易分解) D.氨溶于水显弱碱性,因此可使石蕊溶液变为红色 答案 B 解析液氨汽化需要吸收大量的热,所以氨具有制冷作用,液氨常用作制冷剂,A 项错误;氨中氮 元素为最低负化合价-3 价,氨能够被氧化生成一氧化氮,B 项正确;一水合氨不稳定,受热易分 解,C 项错误;氨溶于水显弱碱性,因此可使石蕊溶液变为蓝色,D 项错误。 6.下列装置用于进行指定实验时,能达到实验目的的是 ( )
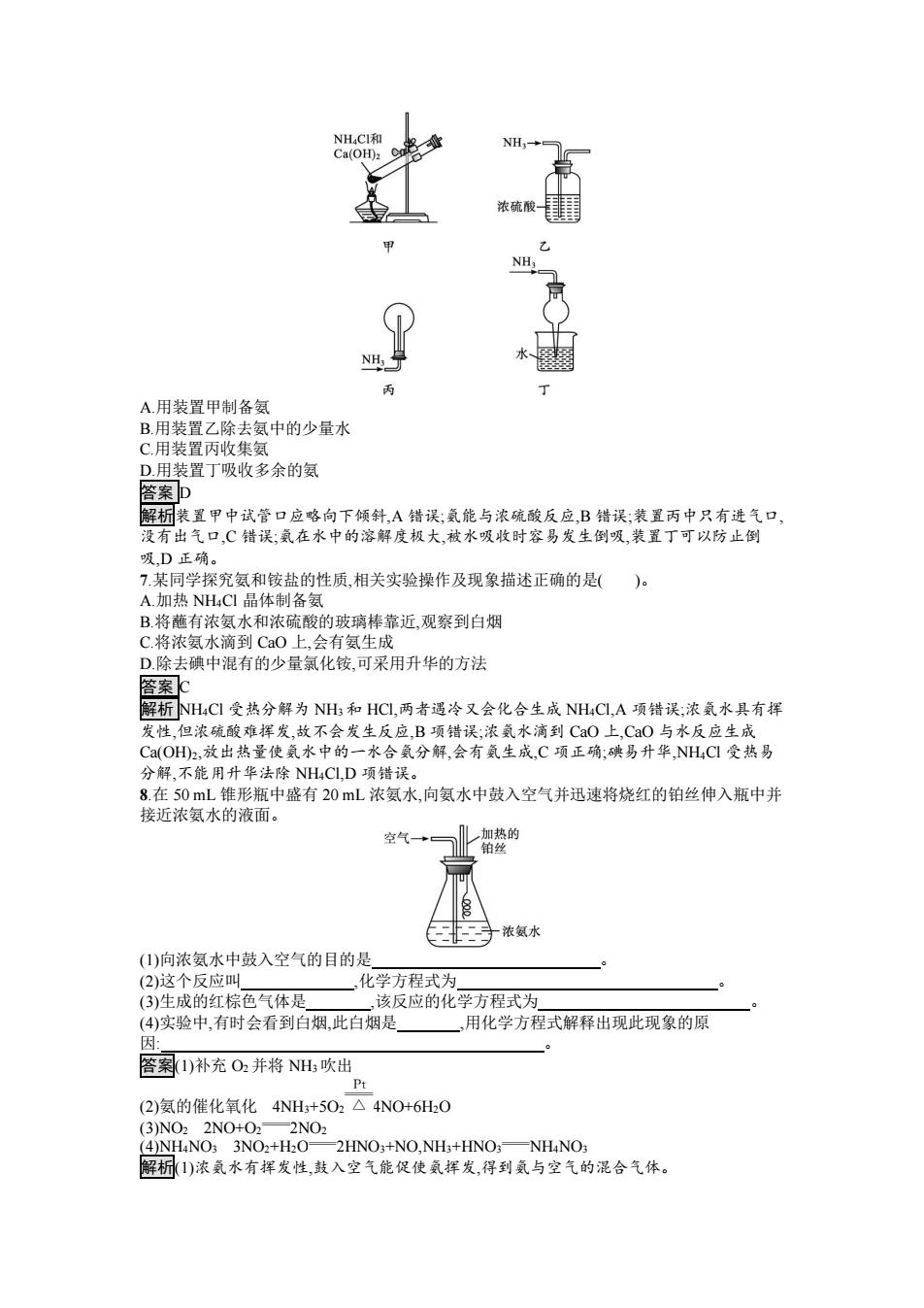
NH4CI和 NH- Ca(OH)2 Co 浓硫酸 NHa 分 A用装置甲制备氨 B.用装置乙除去氨中的少量水 C.用装置丙收集氨 D.用装置丁吸收多余的氨 答案D 解析装置甲中试管口应略向下倾斜,A错误;氨能与浓硫酸反应,B错误;装置丙中只有进气口, 没有出气口,C错误:氨在水中的溶解度极大,被水吸收时容易发生倒吸,装置丁可以防止倒 吸D正确。 7.某同学探究氨和铵盐的性质,相关实验操作及现象描述正确的是()。 A.加热NH4C1晶体制备氨 B.将蘸有浓氨水和浓硫酸的玻璃棒靠近,观察到白烟 C.将浓氨水滴到CaO上,会有氨生成 D.除去碘中混有的少量氯化铵,可采用升华的方法 答案c 解析NH4CI受热分解为NH和HC,两者遇冷又会化合生成NH4CL,A项错误;浓氨水具有挥 发性,但浓硫酸难挥发,故不会发生反应,B项错误;浓氨水滴到CaO上,CaO与水反应生成 C(OH2,放出热量使氨水中的一水合氨分解,会有氨生成,C项正确:碘易升华,NH4Cl受热易 分解,不能用升华法除NH4CLD项错误。 8.在50mL锥形瓶中盛有20L浓氨水,向氨水中鼓入空气并迅速将烧红的铂丝伸入瓶中并 接近浓氨水的液面。 空气+ 加热的 铂丝 浓氨水 (1)向浓氨水中鼓入空气的目的是 (2)这个反应叫 化学方程式为 (3)生成的红棕色气体是, ,该反应的化学方程式为 (4)实验中,有时会看到白烟,此白烟是 ,用化学方程式解释出现此现象的原 因 答案1)补充O2并将NH吹出 Pt (2)氨的催化氧化4NH+5O2△4NO+6HO (3)NO22NO+O2一2NO2 (4)NH4NO3 3NO2+H2O-2HNO3+NO,NH3+HNO;-NH4NO3 解析1)浓氨水有挥发性,鼓入空气能促使氨挥发,得到氨与空气的混合气体
A.用装置甲制备氨 B.用装置乙除去氨中的少量水 C.用装置丙收集氨 D.用装置丁吸收多余的氨 答案 D 解析装置甲中试管口应略向下倾斜,A 错误;氨能与浓硫酸反应,B 错误;装置丙中只有进气口, 没有出气口,C 错误;氨在水中的溶解度极大,被水吸收时容易发生倒吸,装置丁可以防止倒 吸,D 正确。 7.某同学探究氨和铵盐的性质,相关实验操作及现象描述正确的是( )。 A.加热 NH4Cl 晶体制备氨 B.将蘸有浓氨水和浓硫酸的玻璃棒靠近,观察到白烟 C.将浓氨水滴到 CaO 上,会有氨生成 D.除去碘中混有的少量氯化铵,可采用升华的方法 答案 C 解析 NH4Cl 受热分解为 NH3 和 HCl,两者遇冷又会化合生成 NH4Cl,A 项错误;浓氨水具有挥 发性,但浓硫酸难挥发,故不会发生反应,B 项错误;浓氨水滴到 CaO 上,CaO 与水反应生成 Ca(OH)2,放出热量使氨水中的一水合氨分解,会有氨生成,C 项正确;碘易升华,NH4Cl 受热易 分解,不能用升华法除 NH4Cl,D 项错误。 8.在 50 mL 锥形瓶中盛有 20 mL 浓氨水,向氨水中鼓入空气并迅速将烧红的铂丝伸入瓶中并 接近浓氨水的液面。 (1)向浓氨水中鼓入空气的目的是 。 (2)这个反应叫 ,化学方程式为 。 (3)生成的红棕色气体是 ,该反应的化学方程式为 。 (4)实验中,有时会看到白烟,此白烟是 ,用化学方程式解释出现此现象的原 因: 。 答案(1)补充 O2 并将 NH3 吹出 (2)氨的催化氧化 4NH3+5O2 4NO+6H2O (3)NO2 2NO+O2 2NO2 (4)NH4NO3 3NO2+H2O 2HNO3+NO,NH3+HNO3 NH4NO3 解析(1)浓氨水有挥发性,鼓入空气能促使氨挥发,得到氨与空气的混合气体

(2)在加热及铂丝的催化作用下,氨被氧气氧化。 (3)反应生成的NO与氧气继续反应,得到红棕色的二氧化氮气体。 (4)二氧化氮与水反应生成硝酸,挥发出的硝酸可继续与氨反应,得到硝酸铵白色固体小颗粒 出现白烟现象。 9.某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。 探头 数据采 集器 水 图1氨喷泉实验图 (1)制取氨。烧瓶中用浓氨水和某固体反应制取氨,该固体可以是 A.CaO B.NaOH C.CaCl2 D.P2Os 检验三颈烧瓶集满NH的方法是 (填操 作和现象)。 (2)喷泉实验。关闭a将单孔塞(插有吸入水的胶头滴管)塞紧瓶口c,打开b,完成喷泉实验,电 脑绘制三颈烧瓶内压强变化曲线(图2)。图2中 点时喷泉最剧烈。 压强kPa 0 051015202530354045 时间/s 图2喷泉实验中瓶内压强变化曲线 (3)引发喷泉实验的方法有多种,下列操作能引发喷泉的是 A用热毛巾焐烧瓶底部 B.通入HCI气体 C.加CH3COOH溶液 D.加煤油 答案(1)AB将湿润的红色石蕊试纸靠近瓶口c,试纸变为蓝色,证明NH己收集满(或将蘸有 浓盐酸的玻璃棒靠近瓶口c,有白烟生成,证明NH己收集满) (2)D (3)ABC 懈析I)CaO能与水反应同时放出大量的热,有利于氨的逸出;NaOH溶于水放出大量的热,有 利于氨的逸出,A、B项符合题意。(2)外界大气压与三颈烧瓶内压强之差越大,喷泉越剧烈,大 气压不变,D点压强最小,所以大气压和D点压强之差最大,则D点时喷泉最剧烈。(3)能够产 生压强差就能引发喷泉,氨不溶于煤油,两者也不反应,不能产生压强差,不能引发喷泉,A、 B、C项操作均能引发喷泉。 等级考拓展提高 1.(双选)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良 好),等温度恢复到原来温度。下列说法正确的是()
(2)在加热及铂丝的催化作用下,氨被氧气氧化。 (3)反应生成的 NO 与氧气继续反应,得到红棕色的二氧化氮气体。 (4)二氧化氮与水反应生成硝酸,挥发出的硝酸可继续与氨反应,得到硝酸铵白色固体小颗粒, 出现白烟现象。 9.某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图 1)。 图 1 氨喷泉实验图 (1)制取氨。烧瓶中用浓氨水和某固体反应制取氨,该固体可以是 。 A.CaO B.NaOH C.CaCl2 D.P2O5 检验三颈烧瓶集满 NH3 的方法是 (填操 作和现象)。 (2)喷泉实验。关闭 a,将单孔塞(插有吸入水的胶头滴管)塞紧瓶口 c,打开 b,完成喷泉实验,电 脑绘制三颈烧瓶内压强变化曲线(图 2)。图 2 中 点时喷泉最剧烈。 图 2 喷泉实验中瓶内压强变化曲线 (3)引发喷泉实验的方法有多种,下列操作能引发喷泉的是 。 A.用热毛巾焐烧瓶底部 B.通入 HCl 气体 C.加 CH3COOH 溶液 D.加煤油 答案(1)AB 将湿润的红色石蕊试纸靠近瓶口 c,试纸变为蓝色,证明 NH3 已收集满(或将蘸有 浓盐酸的玻璃棒靠近瓶口 c,有白烟生成,证明 NH3 已收集满) (2)D (3)ABC 解析(1)CaO 能与水反应同时放出大量的热,有利于氨的逸出;NaOH 溶于水放出大量的热,有 利于氨的逸出,A、B 项符合题意。(2)外界大气压与三颈烧瓶内压强之差越大,喷泉越剧烈,大 气压不变,D 点压强最小,所以大气压和 D 点压强之差最大,则 D 点时喷泉最剧烈。(3)能够产 生压强差就能引发喷泉,氨不溶于煤油,两者也不反应,不能产生压强差,不能引发喷泉,A、 B、C 项操作均能引发喷泉。 等级考拓展提高 1.(双选)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良 好),等温度恢复到原来温度。下列说法正确的是( )

0.12 mol HCI 玻璃片 0.1 mol NH3 A反应后瓶内压强是反应前的品 B.装置中氢元素的总质量为0.42g C.生成物的分子数目为0.1Na(Na是阿伏加德罗常数) D.反应结束后,两个集气瓶不易分开 答案BD 解析氨与HCI反应的化学方程式为HCI+NH:一NH4CL,两者反应生成0.1mol氯化铵固体, 0.02mol 1 剩余0.02 mol HCl。反应后两瓶内压强为反应前的。12m0+01ma=元A项错误;根据质量守 恒可知,装置中含有H原子的总物质的量为0.12mol+0.1mol×3=0.42mol,质量为1gmol 1×0.42mol=0.42g,B项正确,生成物为离子化合物,不存在氯化铵分子,C项错误:该反应中气 体体积减小,容器中的压强减小,反应结束后,两个集气瓶不容易分开,D项正确。 2.(双选)氢化铵NH4田与氯化铵结构相似,且NH4H与水反应有氢气产生,下列叙述中不正确 的是()。 A.NH4H是由NHt和什构成的 B.NH4H固体投入少量水中,有两种气体产生 C.NHH中的H半径比锂离子半径小 D.NH4H溶于水后,形成的溶液显酸性 答案CD 解析NH4H是离子化合物,由NH和H构成,A项正确;NH4H固体投入少量水中,可生成NH 和H2,B项正确:什与锂离子电子层结构相同,核电荷数越大,离子半径越小,所以H半径比锂 离子半径大,C项错误,NH4H溶于水后,生成NHHO,溶液显碱性,D项错误。 3.一种盐X与烧碱混合共热,可放出无色气体Y,Y经一系列氧化后再溶于水可得Z溶液,Y 和Z反应又生成X,则X是()。 A.(NH4)2S04 B.NHNO C.NH4CI D.NH4HCO3 答案B 。H20 。NH, 解祠铁盐与烧威共热产生NH,Y为NH,NH.ONC O NO..,9 HNO NH.NO.,Z为 HNO3,X为NH4NO3a 4.某化学兴趣小组为了制取并探究氨性质,按下列装置(部分夹持装置已略去)进行实验。制 取氨的反应原理:2NHCI+Ca(OH2一CaCl2+2NH↑+2H2O。 ,浓盐酸 发 干燥剂 置 干燥的红色湿润的红色 石蕊试纸 石蕊试纸 B D E F [实验探究] (1)利用上述原理,实验室制取氨应选用下图中 (填序号)发生装置进行实验
A.反应后瓶内压强是反应前的 1 10 B.装置中氢元素的总质量为 0.42 g C.生成物的分子数目为 0.1NA(NA 是阿伏加德罗常数) D.反应结束后,两个集气瓶不易分开 答案 BD 解析氨与 HCl 反应的化学方程式为 HCl+NH3 NH4Cl,两者反应生成 0.1 mol 氯化铵固体, 剩余 0.02 mol HCl。反应后两瓶内压强为反应前的 0.02mol 0.12mol+0.1mol = 1 11,A 项错误;根据质量守 恒可知,装置中含有 H 原子的总物质的量为 0.12 mol+0.1 mol×3=0.42 mol,质量为 1 g·mol- 1×0.42 mol=0.42 g,B 项正确;生成物为离子化合物,不存在氯化铵分子,C 项错误;该反应中气 体体积减小,容器中的压强减小,反应结束后,两个集气瓶不容易分开,D 项正确。 2.(双选)氢化铵(NH4H)与氯化铵结构相似,且 NH4H 与水反应有氢气产生,下列叙述中不正确 的是( )。 A.NH4H 是由 NH4 +和 H-构成的 B.NH4H 固体投入少量水中,有两种气体产生 C.NH4H 中的 H-半径比锂离子半径小 D.NH4H 溶于水后,形成的溶液显酸性 答案 CD 解析 NH4H 是离子化合物,由 NH4 +和 H-构成,A 项正确;NH4H 固体投入少量水中,可生成 NH3 和 H2,B 项正确;H-与锂离子电子层结构相同,核电荷数越大,离子半径越小,所以 H-半径比锂 离子半径大,C 项错误;NH4H 溶于水后,生成 NH3·H2O,溶液显碱性,D 项错误。 3.一种盐 X 与烧碱混合共热,可放出无色气体 Y,Y 经一系列氧化后再溶于水可得 Z 溶液,Y 和 Z 反应又生成 X,则 X 是( )。 A.(NH4)2SO4 B.NH4NO3 C.NH4Cl D.NH4HCO3 答案 B 解析铵盐与烧碱共热产生 NH3,Y 为 NH3,NH3 NO NO2 HNO3 NH4NO3,Z 为 HNO3,X 为 NH4NO3。 4.某化学兴趣小组为了制取并探究氨性质,按下列装置(部分夹持装置已略去)进行实验。制 取氨的反应原理:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。 [实验探究] (1)利用上述原理,实验室制取氨应选用下图中 (填序号)发生装置进行实验

① ⑨ (2)B装置中的干燥剂可选用 (填碱石灰”或“浓硫酸)。 (3)用5.35gNHC1固体与足量Ca(OH2反应,最多可制得标准状况下氨的体积为 L。NH4C1的摩尔质量为53.5gmo) (4)气体通过C、D装置时,试纸颜色会发生变化的是 (填“℃或D)。 (5)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象 是 (6)F装置中倒置漏斗的作用是 (7)某同学用氨和滴加酚酞的水做喷泉实验,根据烧瓶内产生红色喷泉的现象,说明氨 (填字母)。 A具有还原性 B.极易溶于水 C.能与水反应生成碱性物质 (8)氨的用途很广。如可用氨处理二氧化氮:8NH+6NO2一7N2+12H2O,该反应中氨体现 (填“氧化性”或“还原性”)。请你列举出氨的另一种用 途 答案1)① (2)碱石灰 (3)2.24 (4)D (⑤)产生白烟 (6)防止倒吸 (7)BC (8)还原性制冷剂、氮肥(或化肥)的原料、硝酸的原料、化工原料合理即可) 解析()由反应原理知,采用固体混合加热制取气体,可选择①发生装置进行实验。 (2)千燥管内盛放的是固体千燥剂,则千燥氨可选用碱石灰。 MNHC3SBo01nolL根据化学方程式可知,mNH西FmNH,CO1moL,所以 NH3)=n-Vm=0.1mol×22.4Lmo1=2.24L。 (4)氨能使湿润的红色石蕊试纸变蓝,所以D中试纸颜色发生变化。 (5)氨与挥发的HCI会生成氯化铵晶体,所以有白烟产生。 (6)氨极易溶于水,利用F装置中倒置漏斗可防倒吸。 (7)利用氨和滴加酚酞的水做喷泉实验,烧瓶内产生红色喷泉,说明氨极易溶于水且氨与水反 应生成碱性物质。 (8)在反应8NH+6NO一7N2+12HO中,NH中氨元素化合价升高,被氧化,体现还原性;氨常 见用途有作制冷剂、氨肥(或化肥)的原料、硝酸的原料、化工原料等。 5.某化学小组模拟工业生产制取HNO,设计了下图所示装置,其中a为一个可持续鼓入空气 的橡皮球
(2)B 装置中的干燥剂可选用 (填“碱石灰”或“浓硫酸”)。 (3)用 5.35 g NH4Cl 固体与足量 Ca(OH)2 反应,最多可制得标准状况下氨的体积为 L。(NH4Cl 的摩尔质量为 53.5 g·mol-1 ) (4)气体通过 C、D 装置时,试纸颜色会发生变化的是 (填“C”或“D”)。 (5)当实验进行一段时间后,挤压 E 装置中的胶头滴管,滴入 1~2 滴浓盐酸,可观察到的现象 是 。 (6)F 装置中倒置漏斗的作用是 。 (7)某同学用氨和滴加酚酞的水做喷泉实验,根据烧瓶内产生红色喷泉的现象,说明氨 (填字母)。 A.具有还原性 B.极易溶于水 C.能与水反应生成碱性物质 (8)氨的用途很广。如可用氨处理二氧化氮:8NH3+6NO2 7N2+12H2O,该反应中氨体现 (填“氧化性”或“还原性”)。请你列举出氨的另一种用 途: 。 答案(1)① (2)碱石灰 (3)2.24 (4)D (5)产生白烟 (6)防止倒吸 (7)BC (8)还原性 制冷剂、氮肥(或化肥)的原料、硝酸的原料、化工原料(合理即可) 解析(1)由反应原理知,采用固体混合加热制取气体,可选择①发生装置进行实验。 (2)干燥管内盛放的是固体干燥剂,则干燥氨可选用碱石灰。 (3)n(NH4Cl)= 5.35 g 53.5 g·mol -1=0.1 mol,根据化学方程式可知,n(NH3)=n(NH4Cl)=0.1 mol,所以 V(NH3)=n·Vm=0.1 mol×22.4 L·mol-1=2.24 L。 (4)氨能使湿润的红色石蕊试纸变蓝,所以 D 中试纸颜色发生变化。 (5)氨与挥发的 HCl 会生成氯化铵晶体,所以有白烟产生。 (6)氨极易溶于水,利用 F 装置中倒置漏斗可防倒吸。 (7)利用氨和滴加酚酞的水做喷泉实验,烧瓶内产生红色喷泉,说明氨极易溶于水且氨与水反 应生成碱性物质。 (8)在反应 8NH3+6NO2 7N2+12H2O 中,NH3 中氮元素化合价升高,被氧化,体现还原性;氨常 见用途有作制冷剂、氮肥(或化肥)的原料、硝酸的原料、化工原料等。 5.某化学小组模拟工业生产制取 HNO3,设计了下图所示装置,其中 a 为一个可持续鼓入空气 的橡皮球
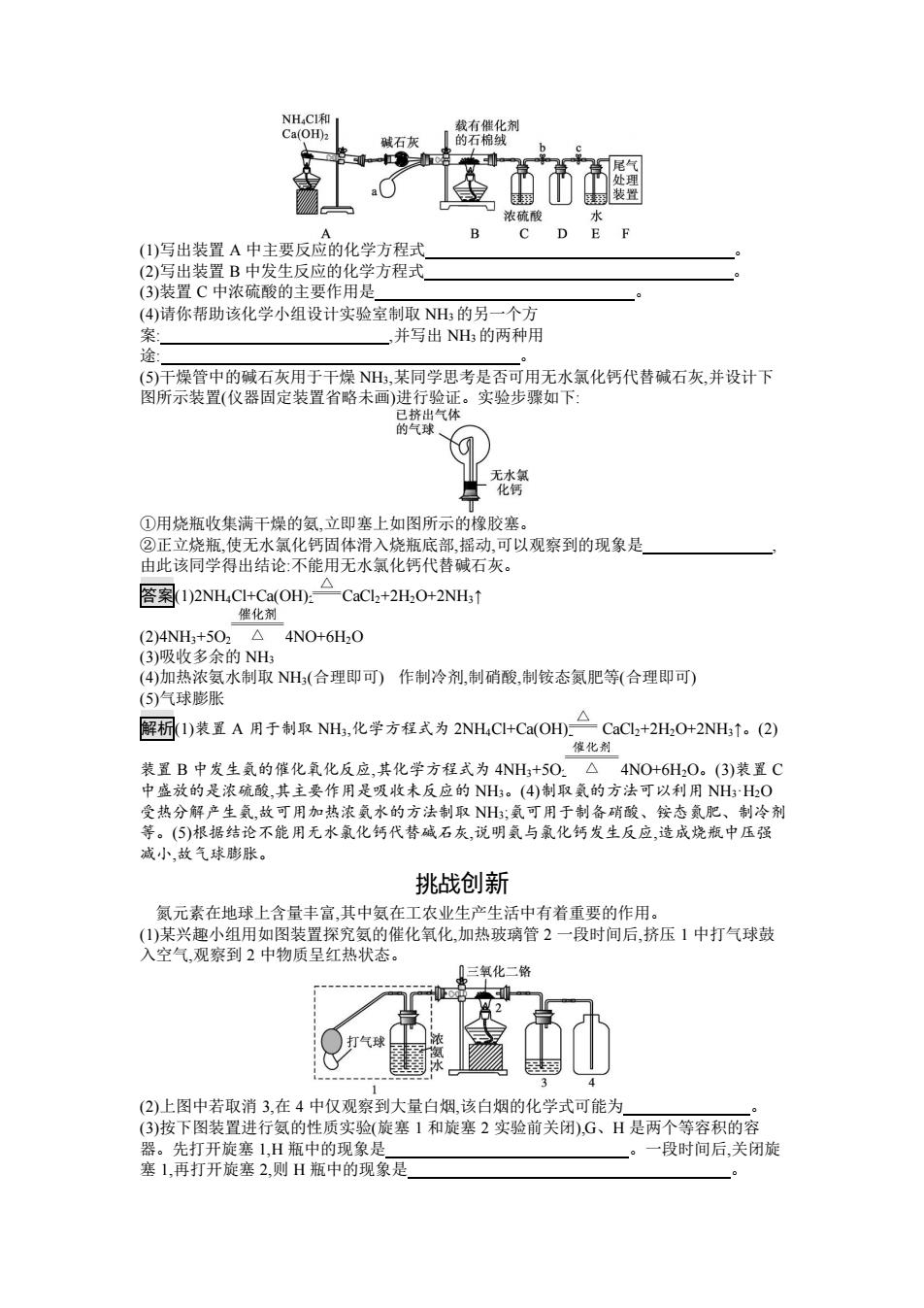
NH,CI和 载有催化剂 Ca(OH)2 碱石灰 的石棉绒 处理 装 浓硫酸 水 A D E (1)写出装置A中主要反应的化学方程式 (2)写出装置B中发生反应的化学方程式 (3)装置C中浓硫酸的主要作用是 (4)请你帮助该化学小组设计实验室制取NH:的另一个方 案 ,并写出NH的两种用 途 (⑤)干燥管中的碱石灰用于干燥NH,某同学思考是否可用无水氯化钙代替碱石灰,并设计下 图所示装置(仪器固定装置省略未画)进行验证。实验步骤如下: 已挤出气体 的气球 无水氯 化钙 ①用烧瓶收集满干燥的氨,立即塞上如图所示的橡胶塞。 ②正立烧瓶,使无水氯化钙固体滑入烧瓶底部摇动,可以观察到的现象是 由此该同学得出结论:不能用无水氯化钙代替碱石灰。 答(1)2NH4CI+Ca(OH.二CaCl+-2H,O+2NHt 催化剂 (2)4NH3+5O2△4NO+6H2O (3)吸收多余的NH (4)加热浓氨水制取NH(合理即可)作制冷剂,制硝酸,制铵态氮肥等(合理即可) (5)气球膨胀 解析1)装置A用于制取NH,化学方程式为2NH,CI+Ca(OH.二CaCL+2HO+2NH↑。(2) 催化剂 装置B中发生氨的催化氧化反应,其化学方程式为4NH+5O:△4NO+6H2O。(3)装置C 中盛放的是浓硫酸,其主要作用是吸收未反应的NH。(4)制取氨的方法可以利用NHH2O 受热分解产生氨,故可用加热浓氨水的方法制取N;氨可用于制备硝酸、铵态氮肥、制冷剂 等。(⑤)根据结论不能用无水氯化钙代替碱石灰,说明氨与氯化钙发生反应,造成烧瓶中压强 减小,故气球膨胀。 挑战创新 氮元素在地球上含量丰富,其中氨在工农业生产生活中有着重要的作用。 (1)某兴趣小组用如图装置探究氨的催化氧化,加热玻璃管2一段时间后,挤压1中打气球鼓 入空气,观察到2中物质呈红热状态。 ①三氧化二馅 打气球 (2)上图中若取消3,在4中仅观察到大量白烟,该白烟的化学式可能为 (3)按下图装置进行氨的性质实验(旋塞1和旋塞2实验前关闭),G、H是两个等容积的容 器。先打开旋塞1,H瓶中的现象是 。一段时间后,关闭旋 塞1,再打开旋塞2,则H瓶中的现象是
(1)写出装置 A 中主要反应的化学方程式 。 (2)写出装置 B 中发生反应的化学方程式 。 (3)装置 C 中浓硫酸的主要作用是 。 (4)请你帮助该化学小组设计实验室制取 NH3 的另一个方 案: ,并写出 NH3 的两种用 途: 。 (5)干燥管中的碱石灰用于干燥 NH3,某同学思考是否可用无水氯化钙代替碱石灰,并设计下 图所示装置(仪器固定装置省略未画)进行验证。实验步骤如下: ①用烧瓶收集满干燥的氨,立即塞上如图所示的橡胶塞。 ②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是 , 由此该同学得出结论:不能用无水氯化钙代替碱石灰。 答案(1)2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑ (2)4NH3+5O2 4NO+6H2O (3)吸收多余的 NH3 (4)加热浓氨水制取 NH3(合理即可) 作制冷剂,制硝酸,制铵态氮肥等(合理即可) (5)气球膨胀 解析(1)装置 A 用于制取 NH3,化学方程式为 2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑。(2) 装置 B 中发生氨的催化氧化反应,其化学方程式为 4NH3+5O2 4NO+6H2O。(3)装置 C 中盛放的是浓硫酸,其主要作用是吸收未反应的 NH3。(4)制取氨的方法可以利用 NH3·H2O 受热分解产生氨,故可用加热浓氨水的方法制取 NH3;氨可用于制备硝酸、铵态氮肥、制冷剂 等。(5)根据结论不能用无水氯化钙代替碱石灰,说明氨与氯化钙发生反应,造成烧瓶中压强 减小,故气球膨胀。 挑战创新 氮元素在地球上含量丰富,其中氨在工农业生产生活中有着重要的作用。 (1)某兴趣小组用如图装置探究氨的催化氧化,加热玻璃管 2 一段时间后,挤压 1 中打气球鼓 入空气,观察到 2 中物质呈红热状态。 (2)上图中若取消 3,在 4 中仅观察到大量白烟,该白烟的化学式可能为 。 (3)按下图装置进行氨的性质实验(旋塞 1 和旋塞 2 实验前关闭),G、H 是两个等容积的容 器。先打开旋塞 1,H 瓶中的现象是 。一段时间后,关闭旋 塞 1,再打开旋塞 2,则 H 瓶中的现象是

☑ 旋塞1 旋塞2 150kPa 100kPa 石蕊溶液 HCI NH: 答案2)NHNO, (3)有白烟生成石蕊溶液倒吸入H瓶,石蕊溶液变红色 解析(2)根据实验装置,装置2导入的NH与O2部分反应生成NO、HO,原装置3用来除去 没有反应的NH5,如果取消装置3,由于2NO+O.一2NO2,3NO2+HC一 2HNO+NO,HNO+NH一NH4NO3,所以生成的白烟是NH4NO3。(3)装置图中旋塞1打开 后,HCI将与NH3混合生成NHCI晶体,所以能够看到有白烟产生。一段时间后,氨完全反应 有剩余的HCL,关闭旋塞1,再打开旋塞2,HC1极易溶于水,所以烧杯中石蕊溶液会被倒吸进入 H瓶,石蕊遇酸变红,因此溶液颜色变红
答案(2)NH4NO3 (3)有白烟生成 石蕊溶液倒吸入 H 瓶,石蕊溶液变红色 解析(2)根据实验装置,装置 2 导入的 NH3 与 O2 部分反应生成 NO、H2O,原装置 3 用来除去 没有反应的 NH3,如果取消装置 3,由于 2NO+O2 2NO2,3NO2+H2O 2HNO3+NO,HNO3+NH3 NH4NO3,所以生成的白烟是 NH4NO3。(3)装置图中旋塞 1 打开 后,HCl 将与 NH3 混合生成 NH4Cl 晶体,所以能够看到有白烟产生。一段时间后,氨完全反应, 有剩余的 HCl,关闭旋塞 1,再打开旋塞 2,HCl 极易溶于水,所以烧杯中石蕊溶液会被倒吸进入 H 瓶,石蕊遇酸变红,因此溶液颜色变红