
第1课时化学反应与热能 课后·训练提升 合格考基础巩固 1.下列有关能量的说法不正确的是()。 A化石能源物质内部贮存着大量的能量 B.植物的光合作用使太阳能转化为化学能 C.由石墨制金刚石是吸热反应,故石墨的能量比金刚石的能量低 D.燃料燃烧时只是将化学能转化为热能 答案D 解析化石能源物质内部贮存着大量的能量,燃烧时放热,A项正确:植物的光合作用是太阳能 转化为化学能的过程,B项正确:吸热反应中反应物的总能量小于生成物的总能量,C项正确; 燃料燃烧时,化学能主要转化为热能,还有一部分转化为光能等其他形式的能量,D项错误。 2.己知反应X+Y一M什N为放热反应,下列有关说法正确的是()。 AX的能量一定高于M的能量 B.Y的能量一定高于N的能量 C.X和Y的总能量一定高于M和N的总能量 D.因该反应为放热反应,所以一定不必加热就可以发生 答案 解析反应X+Y一M什N为放热反应,说明X和Y的总能量高于M和N的总能量,C项正 确;X的能量不一定高于M的能量,Y的能量也不一定高于N的能量;放热反应有时也需要加 热才能发生。 3.将盛有NH4HCO,粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐 酸,反应剧烈,醋酸逐渐凝固。下列说法正确的是()。 A.NH4HCO3与盐酸的反应是放热反应 B.该反应中,热能转化为产物内部的能量 C.反应物的总能量高于生成物的总能量 D.每消耗0.1 mol NH4HCO3放出2.24LCO2 答案B 解析醋酸逐渐凝固说明反应吸收热量导致醋酸溶液温度降低,即NH4HCO,与HCI的反应为 吸热反应,A错误:因反应为吸热反应,即吸收的热量转化为产物内部的能量B正确:因反应为 吸热反应,则反应后生成物的总能量高于反应物的总能量,C错误,没有明确反应状态,不能计 算二氧化碳的体积,D错误。 4.下列说法正确的是()。 A.任何化学反应都伴随着能量的变化 B.HO(g)→HO)该过程放出大量的热,所以该过程是化学变化 C.化学反应中能量的变化都表现为热能的变化 D对于如图所示的过程,是吸收能量的过程 「发应物 生成物 0 反应过程 答案A 解析任何化学反应都有能量的变化,但有能量变化的过程不一定是化学变化,如物质的三态 变化,虽然存在能量变化,但不存在旧化学键的断裂与新化学镀的形成.故不是化学变化,A正 确,B错误;化学反应中能量变化的形式有多种,除热能的变化外,还有光能、电能的变化等,C
第 1 课时 化学反应与热能 课后· 合格考基础巩固 1.下列有关能量的说法不正确的是( )。 A.化石能源物质内部贮存着大量的能量 B.植物的光合作用使太阳能转化为化学能 C.由石墨制金刚石是吸热反应,故石墨的能量比金刚石的能量低 D.燃料燃烧时只是将化学能转化为热能 答案 D 解析化石能源物质内部贮存着大量的能量,燃烧时放热,A 项正确;植物的光合作用是太阳能 转化为化学能的过程,B 项正确;吸热反应中反应物的总能量小于生成物的总能量,C 项正确; 燃料燃烧时,化学能主要转化为热能,还有一部分转化为光能等其他形式的能量,D 项错误。 2.已知反应 X+Y M+N 为放热反应,下列有关说法正确的是( )。 A.X 的能量一定高于 M 的能量 B.Y 的能量一定高于 N 的能量 C.X 和 Y 的总能量一定高于 M 和 N 的总能量 D.因该反应为放热反应,所以一定不必加热就可以发生 答案 C 解析反应 X+Y M+N 为放热反应,说明 X 和 Y 的总能量高于 M 和 N 的总能量,C 项正 确;X 的能量不一定高于 M 的能量,Y 的能量也不一定高于 N 的能量;放热反应有时也需要加 热才能发生。 3.将盛有 NH4HCO3 粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐 酸,反应剧烈,醋酸逐渐凝固。下列说法正确的是( )。 A.NH4HCO3 与盐酸的反应是放热反应 B.该反应中,热能转化为产物内部的能量 C.反应物的总能量高于生成物的总能量 D.每消耗 0.1 mol NH4HCO3 放出 2.24 L CO2 答案 B 解析醋酸逐渐凝固说明反应吸收热量导致醋酸溶液温度降低,即 NH4HCO3 与 HCl 的反应为 吸热反应,A 错误;因反应为吸热反应,即吸收的热量转化为产物内部的能量,B 正确;因反应为 吸热反应,则反应后生成物的总能量高于反应物的总能量,C 错误;没有明确反应状态,不能计 算二氧化碳的体积,D 错误。 4.下列说法正确的是( )。 A.任何化学反应都伴随着能量的变化 B.H2O(g) H2O(l)该过程放出大量的热,所以该过程是化学变化 C.化学反应中能量的变化都表现为热能的变化 D.对于如图所示的过程,是吸收能量的过程 答案 A 解析任何化学反应都有能量的变化,但有能量变化的过程不一定是化学变化,如物质的三态 变化,虽然存在能量变化,但不存在旧化学键的断裂与新化学键的形成,故不是化学变化,A 正 确,B 错误;化学反应中能量变化的形式有多种,除热能的变化外,还有光能、电能的变化等,C

错误;由图像知,该过程中反应物的总能量大于生成物的总能量,故该过程中放出了能量,D错 误。 5.肼(HNNH)是一种高能燃料,有关化学反应的能量变化如图所示,己知断裂1mol化学键所 需的能量:N≡N为942kJ、OO为498kJ、N一N为154kJ,则断裂1molN一H所需的能量 是()。 能量: 假想中间物 2N(g)+4H(g)+2O(g) 质的总能量 0=2752kJ 反应物的 总能量 N,H (g)+O,(g) 2=534kJ 生成物的 总能量 N:(g)+2H.O(g) A.194kJ B.391.5kJ C.516 kJ D.658 kJ 答案B 解析利用图示可知1mol肼和氧气变成原子时断键需要的能量为2752kJ-534kJ=2218kJ。 1mol肼和1mol氧气断键变为原子时要断裂1molN一N、4molN一H、1molO一0,所以 1×154kJ+4×EN一H+1×498kJ=2218kJ,解得断裂1molN一H所需的能量为391.5kJ。 6.石墨和金刚石都是碳的单质,石墨在一定条件下可以转化为金刚石。已知12g石墨完全转 化为金刚石时,要吸收akJ的能量。下列说法中正确的是()。 ①石墨不如金刚石稳定②金刚石不如石墨稳定③等质量的石墨和金刚石完全燃烧,金刚 石放出的能量多④等质量的石墨和金刚石完全燃烧,石墨放出的能量多 A.①② B.②③ C.①④ D.③④ 含案B 解析由石墨完全转化为金刚石时吸热,说明等质量的石墨的能量比金刚石的能量低石墨比 金刚石更稳定;等质量的石墨和金刚石完全燃烧时,消耗氧气的量相同,生成同样多的二氧化 碳,由于金刚石的能量高,所以金刚石燃烧后放出的能量要多。 7.(1)下列过程中不一定释放能量的是 A化合反应 B.分解反应 C.形成化学键 D.燃料燃烧 E.中和反应 F炸药爆炸 (2)等质量的下列物质分别完全燃烧,放出热量较多的是 A.硫蒸气 B.硫固体 (3)己知:通常条件下,酸、碱的稀溶液发生中和反应生成1mol水放出的热量为中和热。稀溶 液中1 mol H2SO4与NaOH恰好反应时放出QkJ热量,则其中和热为一kJ-mol-。 答案1)AB(2)A(3)号 解析1)化学镀的形成过程中一定会放出能量,燃料的燃烧、中和反应都是放热反应,炸药爆 炸过程中会放出热量,而化合反应、分解反应不一定是放热反应。(2)硫固体变为硫蒸气需要 吸收热量,所以等质量的硫蒸气燃烧放出的热量较多。(3)稀溶液中,1 mol H2SO4与NaOH完 全反应生成2mol水,中和热是指酸、碱的稀溶液发生中和反应生成1mol水时放出的热量, 所以对应的中和热为2 kJ-mol-1。 8.某同学做如下实验,以检验反应中的能量变化
错误;由图像知,该过程中反应物的总能量大于生成物的总能量,故该过程中放出了能量,D 错 误。 5.肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂 1 mol 化学键所 需的能量:N≡N 为 942 kJ、O O 为 498 kJ、N—N 为 154 kJ,则断裂 1 mol N—H 所需的能量 是( )。 A.194 kJ B.391.5 kJ C.516 kJ D.658 kJ 答案 B 解析利用图示可知 1 mol 肼和氧气变成原子时断键需要的能量为 2 752 kJ-534 kJ=2 218 kJ。 1 mol 肼和 1 mol 氧气断键变为原子时要断裂 1 mol N—N、4 mol N—H、1 mol O O,所以 1×154 kJ+4×E(N—H)+1×498 kJ=2 218 kJ,解得断裂 1 mol N—H 所需的能量为 391.5 kJ。 6.石墨和金刚石都是碳的单质,石墨在一定条件下可以转化为金刚石。已知 12 g 石墨完全转 化为金刚石时,要吸收 a kJ 的能量。下列说法中正确的是( )。 ①石墨不如金刚石稳定 ②金刚石不如石墨稳定 ③等质量的石墨和金刚石完全燃烧,金刚 石放出的能量多 ④等质量的石墨和金刚石完全燃烧,石墨放出的能量多 A.①② B.②③ C.①④ D.③④ 答案 B 解析由石墨完全转化为金刚石时吸热,说明等质量的石墨的能量比金刚石的能量低,石墨比 金刚石更稳定;等质量的石墨和金刚石完全燃烧时,消耗氧气的量相同,生成同样多的二氧化 碳,由于金刚石的能量高,所以金刚石燃烧后放出的能量要多。 7.(1)下列过程中不一定释放能量的是 。 A.化合反应 B.分解反应 C.形成化学键 D.燃料燃烧 E.中和反应 F.炸药爆炸 (2)等质量的下列物质分别完全燃烧,放出热量较多的是 。 A.硫蒸气 B.硫固体 (3)已知:通常条件下,酸、碱的稀溶液发生中和反应生成 1 mol 水放出的热量为中和热。稀溶 液中 1 mol H2SO4 与 NaOH 恰好反应时放出 Q kJ 热量,则其中和热为 kJ·mol-1。 答案(1)AB (2)A (3)𝑄 2 解析(1)化学键的形成过程中一定会放出能量,燃料的燃烧、中和反应都是放热反应,炸药爆 炸过程中会放出热量,而化合反应、分解反应不一定是放热反应。(2)硫固体变为硫蒸气需要 吸收热量,所以等质量的硫蒸气燃烧放出的热量较多。(3)稀溶液中,1 mol H2SO4 与 NaOH 完 全反应生成 2 mol 水,中和热是指酸、碱的稀溶液发生中和反应生成 1 mol 水时放出的热量, 所以对应的中和热为𝑄 2 kJ·mol-1。 8.某同学做如下实验,以检验反应中的能量变化
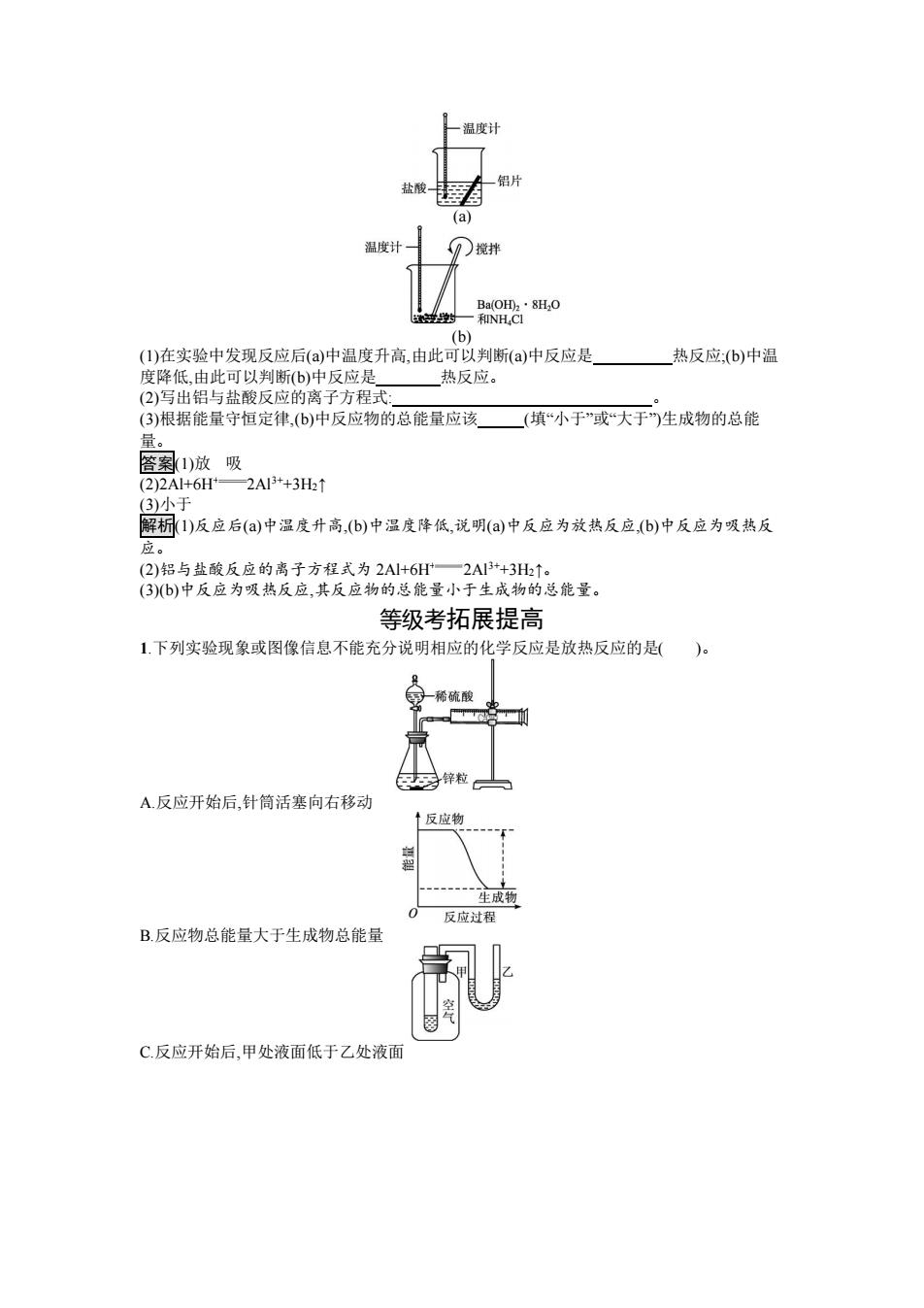
温度计 盐酸 铝片 (a) 温度计 ()搅拌 Ba(OH田2·8H2O 学 和NHCI (b) (1)在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是 热反应:(b)中温 度降低,由此可以判断(b)中反应是 热反应。 (2)写出铝与盐酸反应的离子方程式: (3)根据能量守恒定律,(b)中反应物的总能量应该 (填“小于”或“大于生成物的总能 量。 答案1)放吸 (2)2A+6H—2AI3+3H2↑ 3)小于 解析1)反应后(a)中温度升高,(b)中温度降低,说明(a)中反应为放热反应,(b)中反应为吸热反 应。 (2)铝与盐酸反应的离子方程式为2A1+6H一2A3+3H↑。 (3)b)中反应为吸热反应,其反应物的总能量小于生成物的总能量。 等级考拓展提高 1下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( 稀硫酸 园锌粒】 A.反应开始后,针筒活塞向右移动 ↑反应物 封 生成物 0 反应过程 B.反应物总能量大于生成物总能量 C.反应开始后,甲处液面低于乙处液面
(a) (b) (1)在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是 热反应;(b)中温 度降低,由此可以判断(b)中反应是 热反应。 (2)写出铝与盐酸反应的离子方程式: 。 (3)根据能量守恒定律,(b)中反应物的总能量应该 (填“小于”或“大于”)生成物的总能 量。 答案(1)放 吸 (2)2Al+6H+ 2Al3++3H2↑ (3)小于 解析(1)反应后(a)中温度升高,(b)中温度降低,说明(a)中反应为放热反应,(b)中反应为吸热反 应。 (2)铝与盐酸反应的离子方程式为 2Al+6H+ 2Al3++3H2↑。 (3)(b)中反应为吸热反应,其反应物的总能量小于生成物的总能量。 等级考拓展提高 1.下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )。 A.反应开始后,针筒活塞向右移动 B.反应物总能量大于生成物总能量 C.反应开始后,甲处液面低于乙处液面

温度计 稀盐酸 氢氧化钠 溶液 D.温度计的水银柱 不断上升 答案A 解析稀硫酸与Z反应生成,容器内气体压强增大,使针简活塞向右移动,所以活塞向右移 动不能说明该反应放热:反应物总能量大于生成物总能量,则反应放热:反应开始后,甲处液面 低于乙处液面,说明气体受热膨胀,证明反应放热:温度计的水银柱不断上升,说明温度升高,证 明反应放热。 2.(双选)已知断裂1mol共价键所需要吸收的能量分别为H一H:436kJ一1:151kJ:H一1:299 kJ。下列对反应H(g)+L(g,一2HⅢ(g)的判断中,错误的是()。 A该反应是放出能量的反应 B该反应是吸收能量的反应 C该反应是氧化还原反应 D.I2与H具有的总能量小于HⅢ具有的总能量 答案BD 解析依题意,断裂1molH一H和1mol一I吸收的能量为436k+151kJ=587kJ,生成2mol H一I放出的能量为299kJ×2=598kJ,因为598kJ>587kJ,所以该反应的正反应是放出能量的 反应,A项正确,B项错误;该反应为+H一2HⅢ,反应前后元素的化合价发生改变,是氧化还 原反应,C项正确;该反应为放热反应,I2与H具有的总能量大于HⅢ具有的总能量,D项错 误。 3.己知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,并放出XkJ热量。已知1mol单质碳完全 燃烧放出热量为YkJ,则1molC与O2反应生成CO的能量变化为()。 A.放出能量YkJ B.放出能量(5X-0.5)kJ C.放出能量(10X-)kJ D.吸收能量(10X-)kJ 答案B 解析碳在氧气中燃烧,氧气不足发生反应:2C+O2 2C0,氧气足量发生反应:C+0,点 =C02。 36g度的物质的量为mC2203m0l64g袁气的物质的量为m0,知02 mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生。假设生成的C0为x mol,C02为ymol,根据碳元素原子守恒有x+=0.3,根据氧元素原子守恒有x+2=0.2×2,解得 =0.2=0.1.1mol单质碳完全燃烧放出的热量为Yk,所以生成0.1mol二氧化碳放出的热 量为0.1mol×YkJ-mol-1=0.1YkJ,所以生成0.2molC0放出的热量为XkJ-0.1YkJ。由于碳燃 烧为放热反应,故1molC与02反应生成C0的能量变化为放出能量1molX-01y)(5X 0.2mol 0.5)kJ.选项B正确。 4.(双选)化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成 时放出的能量不同引起的。如图为N2(g)与O2(g)反应生成NO(g)过程中的能量变化,下列说 法正确的是( 吸收能量 946kJ·mo1 放出能量 2×632kJ·mol 吸收能量 498kJ·mol
D.温度计的水银柱 不断上升 答案 A 解析稀硫酸与 Zn 反应生成 H2,容器内气体压强增大,使针筒活塞向右移动,所以活塞向右移 动不能说明该反应放热;反应物总能量大于生成物总能量,则反应放热;反应开始后,甲处液面 低于乙处液面,说明气体受热膨胀,证明反应放热;温度计的水银柱不断上升,说明温度升高,证 明反应放热。 2.(双选)已知断裂 1 mol 共价键所需要吸收的能量分别为 H—H:436 kJ;I—I:151 kJ;H—I:299 kJ。下列对反应 H2(g)+I2(g) 2HI(g)的判断中,错误的是( )。 A.该反应是放出能量的反应 B.该反应是吸收能量的反应 C.该反应是氧化还原反应 D.I2 与 H2 具有的总能量小于 HI 具有的总能量 答案 BD 解析依题意,断裂 1 mol H—H 和 1 mol I—I 吸收的能量为 436 kJ+151 kJ=587 kJ,生成 2 mol H—I 放出的能量为 299 kJ×2=598 kJ,因为 598 kJ>587 kJ,所以该反应的正反应是放出能量的 反应,A 项正确,B 项错误;该反应为 H2+I2 2HI,反应前后元素的化合价发生改变,是氧化还 原反应,C 项正确;该反应为放热反应,I2 与 H2 具有的总能量大于 HI 具有的总能量,D 项错 误。 3.已知 3.6 g 碳在 6.4 g 氧气中燃烧,至反应物耗尽,并放出 X kJ 热量。已知 1 mol 单质碳完全 燃烧放出热量为 Y kJ,则 1 mol C 与 O2 反应生成 CO 的能量变化为( )。 A.放出能量 Y kJ B.放出能量(5X-0.5Y) kJ C.放出能量(10X-Y) kJ D.吸收能量(10X-Y) kJ 答案 B 解析碳在氧气中燃烧,氧气不足发生反应:2C+O2 2CO;氧气足量发生反应:C+O2 CO2。 3.6 g 碳的物质的量为 n(C)= 3.6 g 12 g·mol -1=0.3 mol,6.4 g 氧气的物质的量为 n(O2)= 6.4 g 32 g·mol -1=0.2 mol,n(C)∶n(O2)=3∶2,介于 2∶1 与 1∶1 之间,所以上述反应都发生。假设生成的 CO 为 x mol,CO2 为 y mol,根据碳元素原子守恒有 x+y=0.3,根据氧元素原子守恒有 x+2y=0.2×2,解得 x=0.2,y=0.1。1 mol 单质碳完全燃烧放出的热量为 Y kJ,所以生成 0.1 mol 二氧化碳放出的热 量为 0.1 mol×Y kJ·mol-1=0.1Y kJ,所以生成 0.2 mol CO 放出的热量为 X kJ-0.1Y kJ。由于碳燃 烧为放热反应,故 1 mol C 与 O2 反应生成 CO 的能量变化为放出能量1mol×(𝑋-0.1𝑌) kJ 0.2mol =(5X- 0.5Y) kJ,选项 B 正确。 4.(双选)化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成 时放出的能量不同引起的。如图为 N2(g)与 O2(g)反应生成 NO(g)过程中的能量变化,下列说 法正确的是( )

A.1molN2(g)与1molO2(g)反应放出的能量为180kJ B.1molN2(g)和1molO2(g)具有的总能量小于2 mol NO(g)具有的总能量 C.通常情况下,N2(g)与O2(g)混合能直接生成NO(g) D.吸热反应不一定需要加热才能发生 答案BD 解析反应过程变化的能量为反应物断裂化学键吸收的能量生成物形成化学键放出的能 量,N2+O2一2NO,能量变化为946 kJ-mol-1+498kJmo1-2×632 kJ-mol-=180kJmo1,故该反 应是吸热反应,A项错误;依据A计算可知反应是吸热反应,故1molN2(g)和1molO2(g)具有 的总能量小于2 mol NO(g)具有的总能量,B项正确;通常情况下,N2(g)与O2(g)混合不能直接 生成NO,在放电或高温条件才能反应,C项错误;吸热反应不一定需要加热,如氢氧化钡晶体 与氯化铵固体的反应,在常温下就能进行,但该反应为吸热反应,D项正确。 挑战创新 如图是某同学设计的放热反应的观察装置。其实验操作步骤如下: 红墨水 或品红 溶液 氧化钙与水的反应 ①按图所示将实验装置连接好; ②在U形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于 同一水平面,再关闭T形管活塞, ③在盛有1.0g氧化钙的小试管里滴入2mL左右的蒸馏水,观察现象。 请回答下列问题: (1)实验前必须进行的一步实验操作是 (2)实验中观察到的现象是 (3)说明CaO、H0的能量与Ca(OHD2的能量之间的关系: (4)若将该实验中CaO换成NaCL,实验还能否观察到相同现象? (填“能”或“否。 答案(1)检查装置气密性 (2)U形管里的液面左边下降,右边上升 (3)1 mol Ca0和1 mol H2O的能量和大于1 mol Ca(OH2的能量 (4)否 解析1)该实验是观察气压差导致的实验现象,所以实验之前一定要检查装置气密性。 (2)CO与水反应放出热量,使大试管中的空气膨胀,内部压强增大,导致U形管里的液面左边 下降,右边上升。 (3)CaO+H0Ca(OH2,根据实验现象知道:氧化钙与水的反应是放热的,所以1 mol CaO和 1molH0的能量和大于1 mol Ca(OH2的能量。 (4)氯化钠和水混合后,能量的变化很不明显,试管内气体压强几乎不变,不会出现任何现象,故 答案为否
A.1 mol N2(g)与 1 mol O2(g)反应放出的能量为 180 kJ B.1 mol N2(g)和 1 mol O2(g)具有的总能量小于 2 mol NO(g)具有的总能量 C.通常情况下,N2(g)与 O2(g)混合能直接生成 NO(g) D.吸热反应不一定需要加热才能发生 答案 BD 解析反应过程变化的能量为反应物断裂化学键吸收的能量-生成物形成化学键放出的能 量,N2+O2 2NO,能量变化为 946 kJ·mol-1+498 kJ·mol-1 -2×632 kJ·mol-1=180 kJ·mol-1 ,故该反 应是吸热反应,A 项错误;依据 A 计算可知反应是吸热反应,故 1 mol N2(g)和 1 mol O2(g)具有 的总能量小于 2 mol NO(g)具有的总能量,B 项正确;通常情况下,N2(g)与 O2(g)混合不能直接 生成 NO,在放电或高温条件才能反应,C 项错误;吸热反应不一定需要加热,如氢氧化钡晶体 与氯化铵固体的反应,在常温下就能进行,但该反应为吸热反应,D 项正确。 挑战创新 如图是某同学设计的放热反应的观察装置。其实验操作步骤如下: 氧化钙与水的反应 ①按图所示将实验装置连接好; ②在 U 形管内加入少量红墨水(或品红溶液),打开 T 形管活塞,使 U 形管内两边的液面处于 同一水平面,再关闭 T 形管活塞; ③在盛有 1.0 g 氧化钙的小试管里滴入 2 mL 左右的蒸馏水,观察现象。 请回答下列问题: (1)实验前必须进行的一步实验操作是 。 (2)实验中观察到的现象是 。 (3)说明 CaO、H2O 的能量与 Ca(OH)2 的能量之间的关系: 。 (4)若将该实验中 CaO 换成 NaCl,实验还能否观察到相同现象? (填“能”或“否”)。 答案(1)检查装置气密性 (2)U 形管里的液面左边下降,右边上升 (3)1 mol CaO 和 1 mol H2O 的能量和大于 1 mol Ca(OH)2 的能量 (4)否 解析(1)该实验是观察气压差导致的实验现象,所以实验之前一定要检查装置气密性。 (2)CaO 与水反应放出热量,使大试管中的空气膨胀,内部压强增大,导致 U 形管里的液面左边 下降,右边上升。 (3)CaO+H2O Ca(OH)2,根据实验现象知道:氧化钙与水的反应是放热的,所以 1 mol CaO 和 1 mol H2O 的能量和大于 1 mol Ca(OH)2 的能量。 (4)氯化钠和水混合后,能量的变化很不明显,试管内气体压强几乎不变,不会出现任何现象,故 答案为否