
第2课时 硫酸 不同价态含硫物质的转化 课后·训练提升 合格考基础巩固 1硫在自然界的循环过程如图所示。下列说法中不正确的是( 大气中 S0S0 SO. 森林火灾 研 植物、动物和微生物残体岩石 植物、 动物和微生物残体 A火山喷发、森林火灾会产生SO2 B.氢、氧两种元素没有参与硫的循环 C.工厂产生的烟气应经脱硫处理后再排放 D.硫在自然界的循环过程中,涉及了氧化还原反应 答案B 解析由图分析可知火山喷发、森林火灾都会产生SO2,A项正确:动植物和微生物残体的腐败 会产生HS,HS燃烧产生SO2,所以氢、氧两种元素参与硫的循环,B项错误;工厂产生的烟气 应经脱硫处理后再排放,可以减少二氧化硫的生成,降低酸雨的形成,C项正确;由图可知:H$ →SO2,有化合价变化,属于氧化还原反应,所以硫在自然界的循环过程中,涉及了氧化还原反 应,D项正确。 2.硫化氢的转化是资源利用和环境保护的重要研究课题。下列关于硫化氢的说法错误的是 ()。 AHS中硫元素为-2价,具有还原性 B.可用石灰乳吸收HS气体 C.根据下图可知FeCl3、CuC2均能氧化HS Fe Cu2 Fe3 CuS D.HS在空气中燃烧可以生成SO2 答案 解析HS中硫元素为-2价,是硫元素的最低价态,具有还原性,A项正确:HS溶于水形成氢硫 酸,能用石灰乳(碱性)吸收,B项正确:Cu+与HS生成CuS,不能氧化HS,C项错误;HS在空 气中充分燃烧可生成S022HS+30.≤S0+2H0若不充分燃烧可生成S2HS+0点燃 点燃 2HO+S),D项正确。 3.在如图所示的实验装置中,实验开始一段时间后,对看到的现象叙述不正确的是( )
第 2 课时 硫酸 不同价态含硫物质的转化 课后· 合格考基础巩固 1.硫在自然界的循环过程如图所示。下列说法中不正确的是( )。 A.火山喷发、森林火灾会产生 SO2 B.氢、氧两种元素没有参与硫的循环 C.工厂产生的烟气应经脱硫处理后再排放 D.硫在自然界的循环过程中,涉及了氧化还原反应 答案 B 解析由图分析可知火山喷发、森林火灾都会产生 SO2,A 项正确;动植物和微生物残体的腐败 会产生 H2S,H2S 燃烧产生 SO2,所以氢、氧两种元素参与硫的循环,B 项错误;工厂产生的烟气 应经脱硫处理后再排放,可以减少二氧化硫的生成,降低酸雨的形成,C 项正确;由图可知:H2S SO2,有化合价变化,属于氧化还原反应,所以硫在自然界的循环过程中,涉及了氧化还原反 应,D 项正确。 2.硫化氢的转化是资源利用和环境保护的重要研究课题。下列关于硫化氢的说法错误的是 ( )。 A.H2S 中硫元素为-2 价,具有还原性 B.可用石灰乳吸收 H2S 气体 C.根据下图可知 FeCl3、CuCl2 均能氧化 H2S D.H2S 在空气中燃烧可以生成 SO2 答案 C 解析 H2S 中硫元素为-2 价,是硫元素的最低价态,具有还原性,A 项正确;H2S 溶于水形成氢硫 酸,能用石灰乳(碱性)吸收,B 项正确;Cu2+与 H2S 生成 CuS,不能氧化 H2S,C 项错误;H2S 在空 气中充分燃烧可生成 SO2:2H2S+3O2 SO2+2H2O(若不充分燃烧可生成 S:2H2S+O2 2H2O+S),D 项正确。 3.在如图所示的实验装置中,实验开始一段时间后,对看到的现象叙述不正确的是( )

胆 饱和 硝酸钾 pH 溶液 试纸 浓硫酸 浓硫酸 浓硫酸 浓硫酸 ① ③ ④ A.①中苹果块变干瘪 B.②中胆矾晶体表面有“白斑” C.③中小试管内有晶体析出 D.④中pH试纸变红 含案D 解析浓硫酸具有吸水性,苹果块中的水分、胆矾晶体中的水分、饱和KNO溶液中的水分都 能被浓硫酸吸收,从而导致苹果块变干瘪、胆矾晶体表面失水而出现不带结晶水的白色 CuSO4、饱和KNO3溶液失水而有晶体析出。浓硫酸不能电离出H,因此pH试纸不会变红, 但会被炭化而变黑。 4.下列物质的转化中,浓疏酸既表现氧化性,又表现酸性的是()。 A.Cu→CuSO4 B.C→CO2 C.CuO→CuSO D.Fe2O3→Fe2(SO4)3 答案A 解桐浓硫酸在反应中表现酸性时硫元素化合价不变,硫元素仍以S0?形式存在:表现氧化性 时硫元素化合价降低。反应C+2HS04(浓,一CO2↑+2S02↑+2H0中硫元素化合价降低;反 应Fe2O+3HSO一Fe2(SO4)+3H0及反应CuO+HSO.一CuS04+H0中硫元素化合价 均不变:而反应Cu+2H,S0.(浓,△CuS0,+S02+2H,0中疏元素化合价一部分不变,一部分 降低。所以浓硫酸在A项反应中既表现酸性,又表现氧化性。 5.比较下述实验方案,能够确定一种溶液中一定含有S0?的事实是( A取少量试样溶液,加入用盐酸酸化的BaC2溶液,有白色沉淀生成。 B.取少量试样溶液,加入BaCl2溶液,有白色沉淀生成,再加稀盐酸,沉淀不溶解 C.取少量试样溶液,加入BaC12溶液,有白色沉淀生成 D.取少量试样溶液,加入足量盐酸,无沉淀生成,加入BaC2溶液,有白色沉淀生成 答案D 解析遇盐酸酸化的BCl,溶液,有白色沉淀生成时,原溶液可能含有Ag或S0?,A项错误;加 入BaC2溶液有白色沉淀生成,再加稀盐酸,沉淀不溶解,原溶液中可能含有Ag,B项错误;加 入BaCl溶液,能产生白色沉淀,原溶液中可能含有C0?、Ag等,C项错误;当加入足量的盐 酸时,无沉淀生成,加入BC12生成了白色沉淀,原溶液一定含有S0子,D项正确。 6.下列关于浓硫酸和稀硫酸的叙述中正确的是()。 A浓硫酸可作干燥剂 B.都具有脱水性 C加热时都能与铜发生反应 D.都能与木炭反应 答案A 解析A中浓硫酸具有吸水性,可作干燥剂:C中浓硫酸在加热时可与铜发生反应,稀疏酸与铜 不反应;B中浓硫酸具有脱水性,稀硫酸不具有脱水性:D中稀硫酸不与木炭反应。 7.按下图装置进行实验,可证明碳与浓硫酸反应放出的气体是SO2和CO2
A.①中苹果块变干瘪 B.②中胆矾晶体表面有“白斑” C.③中小试管内有晶体析出 D.④中 pH 试纸变红 答案 D 解析浓硫酸具有吸水性,苹果块中的水分、胆矾晶体中的水分、饱和 KNO3 溶液中的水分都 能被浓硫酸吸收,从而导致苹果块变干瘪、胆矾晶体表面失水而出现不带结晶水的白色 CuSO4、饱和 KNO3 溶液失水而有晶体析出。浓硫酸不能电离出 H+ ,因此 pH 试纸不会变红, 但会被炭化而变黑。 4.下列物质的转化中,浓硫酸既表现氧化性,又表现酸性的是( )。 A.Cu→CuSO4 B.C→CO2 C.CuO→CuSO4 D.Fe2O3→Fe2(SO4)3 答案 A 解析浓硫酸在反应中表现酸性时硫元素化合价不变,硫元素仍以 SO4 2-形式存在;表现氧化性 时硫元素化合价降低。反应 C+2H2SO4(浓) CO2↑+2SO2↑+2H2O 中硫元素化合价降低;反 应 Fe2O3+3H2SO4 Fe2(SO4)3+3H2O 及反应 CuO+H2SO4 CuSO4+H2O 中硫元素化合价 均不变;而反应 Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O 中硫元素化合价一部分不变,一部分 降低。所以浓硫酸在 A 项反应中既表现酸性,又表现氧化性。 5.比较下述实验方案,能够确定一种溶液中一定含有 SO4 2-的事实是( )。 A.取少量试样溶液,加入用盐酸酸化的 BaCl2 溶液,有白色沉淀生成。 B.取少量试样溶液,加入 BaCl2 溶液,有白色沉淀生成,再加稀盐酸,沉淀不溶解 C.取少量试样溶液,加入 BaCl2 溶液,有白色沉淀生成 D.取少量试样溶液,加入足量盐酸,无沉淀生成,加入 BaCl2 溶液,有白色沉淀生成 答案 D 解析遇盐酸酸化的 BaCl2 溶液,有白色沉淀生成时,原溶液可能含有 Ag+或 SO4 2- ,A 项错误;加 入 BaCl2 溶液有白色沉淀生成,再加稀盐酸,沉淀不溶解,原溶液中可能含有 Ag+ ,B 项错误;加 入 BaCl2 溶液,能产生白色沉淀,原溶液中可能含有 CO3 2-、Ag+等,C 项错误;当加入足量的盐 酸时,无沉淀生成,加入 BaCl2 生成了白色沉淀,原溶液一定含有 SO4 2- ,D 项正确。 6.下列关于浓硫酸和稀硫酸的叙述中正确的是( )。 A.浓硫酸可作干燥剂 B.都具有脱水性 C.加热时都能与铜发生反应 D.都能与木炭反应 答案 A 解析 A 中浓硫酸具有吸水性,可作干燥剂;C 中浓硫酸在加热时可与铜发生反应,稀硫酸与铜 不反应;B 中浓硫酸具有脱水性,稀硫酸不具有脱水性;D 中稀硫酸不与木炭反应。 7.按下图装置进行实验,可证明碳与浓硫酸反应放出的气体是 SO2 和 CO2

浓硫酸 木炭 品红 酸性高锰 品红 澄清 溶液 酸钾溶液溶液 石灰水 ① ② ③ (1)木炭与浓硫酸反应的化学方程式是 该反应 的氧化剂为 (填化学式),当转移2mol电子时,生成标准状况下的SO2和CO2共 Lo (2)洗气瓶①②中溶液褪色,体现的二氧化硫的性质依次为 (填字母)。 A氧化性、还原性 B.漂白性、还原性 C.漂白性、氧化性 D.还原性、漂白性 (3)证明二氧化碳存在的现象为 答桑1)C+2HS0(浓,△c0,+2S0t+2H0 HS0433.6 (2)B (3)洗气瓶③中品红溶液不褪色,澄清石灰水变浑浊 解韧1)木炭与浓硫酸反应生成C02、S02和出0,化学方程式为C+2HS0,(浓△ CO2↑+2SO2↑+2H20,在该反应中,C元素的化合价升高,S元素的化合价降低,所以氧化剂是 H2S04,由化学方程式可知,每消耗1molC,转移4mol电子,生成1 mol CO2和2 mol SO2,所以 转移2mol电子时,生成0.5 mol CO2和1 mol SO2,在标准状况下的体积为(0.5mol+1 mol)×22.4Lmol=33.6L。 (2)洗气瓶①中品红溶液褪色,体现了二氧化硫的漂白性,洗气瓶②中酸性高锰酸钾溶液褪色, 体现了二氧化硫的还原性,故选B。 (3)当洗气瓶③中品红溶液不褪色,证明SO2已被除尽,澄清石灰水变浑浊,即可证明有二氧化 碳存在。 等级考拓展提高 1.(双选)下列反应中,调节反应物用量或浓度会改变反应产物的是( A.铁在硫蒸气中燃烧 B.HSO4与Cu反应 C氢气在氯气中燃烧 D.硫酸中加入镁条 答案BD 解A项,无论疏蒸气的用量如何,只发生反应F+(△FeS,B项,当反应物是浓硫酸时产生 SO2,当反应物是稀硫酸时不反应;C项,氢气与氯气反应生成HCL,与反应物的用量无关;D项」 △ 若为稀疏酸,发生反应:Mg+H2SO4一MgSO4+↑,若为浓硫酸,发生反应:Mg+2HSO4(浓, MgSO4+SO2↑+2H2O。 2.已知①Zn+HSO4(稀)一ZnSO4+H2↑,②Zn+2H2SO4(浓,一ZnSO4+SO2↑+2H20,下列说法不 正确的是()。 A.浓硫酸和稀硫酸均有氧化性,所以稀硫酸是氧化性酸 B.过量的Zn在浓硫酸中反应可得SO2和H2 C.Zn与稀疏酸反应的氧化产物是ZnSO4
(1)木炭与浓硫酸反应的化学方程式是 ,该反应 的氧化剂为 (填化学式),当转移 2 mol 电子时,生成标准状况下的 SO2 和 CO2 共 L。 (2)洗气瓶①②中溶液褪色,体现的二氧化硫的性质依次为 (填字母)。 A.氧化性、还原性 B.漂白性、还原性 C.漂白性、氧化性 D.还原性、漂白性 (3)证明二氧化碳存在的现象为 。 答案(1)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O H2SO4 33.6 (2)B (3)洗气瓶③中品红溶液不褪色,澄清石灰水变浑浊 解析(1)木炭与浓硫酸反应生成 CO2、SO2 和 H2O,化学方程式为 C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,在该反应中,C 元素的化合价升高,S 元素的化合价降低,所以氧化剂是 H2SO4,由化学方程式可知,每消耗 1 mol C,转移 4 mol 电子,生成 1 mol CO2 和 2 mol SO2,所以 转移 2 mol 电子时,生成 0.5 mol CO2 和 1 mol SO2,在标准状况下的体积为(0.5 mol+1 mol)×22.4 L·mol-1=33.6 L。 (2)洗气瓶①中品红溶液褪色,体现了二氧化硫的漂白性,洗气瓶②中酸性高锰酸钾溶液褪色, 体现了二氧化硫的还原性,故选 B。 (3)当洗气瓶③中品红溶液不褪色,证明 SO2 已被除尽,澄清石灰水变浑浊,即可证明有二氧化 碳存在。 等级考拓展提高 1.(双选)下列反应中,调节反应物用量或浓度会改变反应产物的是( )。 A.铁在硫蒸气中燃烧 B.H2SO4 与 Cu 反应 C.氢气在氯气中燃烧 D.硫酸中加入镁条 答案 BD 解析 A 项,无论硫蒸气的用量如何,只发生反应:Fe+S FeS;B 项,当反应物是浓硫酸时产生 SO2,当反应物是稀硫酸时不反应;C 项,氢气与氯气反应生成 HCl,与反应物的用量无关;D 项, 若为稀硫酸,发生反应:Mg+H2SO4 MgSO4+H2↑,若为浓硫酸,发生反应:Mg+2H2SO4(浓) MgSO4+SO2↑+2H2O。 2.已知①Zn+H2SO4(稀) ZnSO4+H2↑,②Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O,下列说法不 正确的是( )。 A.浓硫酸和稀硫酸均有氧化性,所以稀硫酸是氧化性酸 B.过量的 Zn 在浓硫酸中反应可得 SO2 和 H2 C.Zn 与稀硫酸反应的氧化产物是 ZnSO4

D.不管是浓硫酸还是稀硫酸,若反应过程中被还原的H$O4的物质的量相等,则生成气体的物 质的量相等 答案A 解析从化学方程式知浓硫酸和稀硫酸均有氧化性,但稀硫酸不是氧化性酸,A项错误;过量的 Zn在浓硫酸中反应先生成SO2,硫酸变稀后生成,B项正确;Zn与稀硫酸反应的氧化产物是 ZnSO4,C项正确;在Zn分别与浓硫酸和稀硫酸的反应中,有1 mol H2SO4被还原时分别生成1 mol SO2和1mol2,D项正确。 高温 3.(双选)已知2FSO.一Fe2O+SO2↑+SO↑。下列有关操作、装置、原理及对现象的表述正 确的是( FeSO 饱和 NaH3● 等液 丙 T A.用装置甲高温分解FSO4,点燃酒精喷灯前应先向装置内通一段时间N2 B.用装置乙可检验分解产生的SO2,现象是石蕊溶液先变红后褪色 C.用装置丙可检验分解产生的$O3,现象是产生白色沉淀 D.装置丁内的溶液不应选用饱和NHSO,溶液,可选用碱液或小苏打溶液吸收尾气 答案AD 解析点燃酒精喷灯前应先向装置内通一段时间2,排除装置中的空气,避免空气中氧气的干 扰,A项正确:装置乙不能检验分解产生的SO2,产物中的SO3会对SO2的检验造成千扰,且 SO2只能使石蕊溶液变红,B项错误;SO3易溶于水,当混合气体经过乙时,SO3会被吸收,所以要 想检验SO3,应该把乙和丙的位置互换,C项错误:饱和NaHSO3溶液不能吸收尾气SO2,所以应 选用碱液或小苏打溶液吸收D项正确。 4.(双选)如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的 是()。 K1O,淀粉溶液先变蓝后褪色 ① S02 NaSO,合NaS+NaSO ③1 NaOH溶液 ② A-S02+Na2SO3 NaHSO3 号NaS,0+zaOn: A反应①说明SO2具有漂白性,反应②说明SO2具有酸性 B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH=23 C.反应③④⑤均属于氧化还原反应 D.工业上可利用反应②和反应④回收利用SO2 答案BD 解析反应①中先变蓝后褪色是因为KIO;的还原产物先是2后是上,说明SO2具有还原性,反 应②属于酸性氧化物与碱的反应,说明SO2具有酸性氧化物的通性,A项错误:根据元素守恒 当n(NaSO3):n(NaHSO3)=1:1时,n(SO2):n(NaOH=2:3,B项正确;反应④不是氧化还原 反应,C项错误,反应②吸收了二氧化硫,反应④放出了$O2,可以通过反应②和反应④回收利 用二氧化硫,D项正确。 挑战创新 某兴趣小组为探究铜与浓硫酸反应时疏酸的最低浓度,设计了如下方案。 方案一、实验装置如图1所示
D.不管是浓硫酸还是稀硫酸,若反应过程中被还原的 H2SO4 的物质的量相等,则生成气体的物 质的量相等 答案 A 解析从化学方程式知浓硫酸和稀硫酸均有氧化性,但稀硫酸不是氧化性酸,A 项错误;过量的 Zn 在浓硫酸中反应先生成 SO2,硫酸变稀后生成 H2,B 项正确;Zn 与稀硫酸反应的氧化产物是 ZnSO4,C 项正确;在 Zn 分别与浓硫酸和稀硫酸的反应中,有 1 mol H2SO4 被还原时分别生成 1 mol SO2 和 1 mol H2,D 项正确。 3.(双选)已知 2FeSO4 Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正 确的是( )。 A.用装置甲高温分解 FeSO4,点燃酒精喷灯前应先向装置内通一段时间 N2 B.用装置乙可检验分解产生的 SO2,现象是石蕊溶液先变红后褪色 C.用装置丙可检验分解产生的 SO3,现象是产生白色沉淀 D.装置丁内的溶液不应选用饱和 NaHSO3 溶液,可选用碱液或小苏打溶液吸收尾气 答案 AD 解析点燃酒精喷灯前应先向装置内通一段时间 N2,排除装置中的空气,避免空气中氧气的干 扰,A 项正确;装置乙不能检验分解产生的 SO2,产物中的 SO3 会对 SO2 的检验造成干扰,且 SO2 只能使石蕊溶液变红,B 项错误;SO3 易溶于水,当混合气体经过乙时,SO3 会被吸收,所以要 想检验 SO3,应该把乙和丙的位置互换,C 项错误;饱和 NaHSO3 溶液不能吸收尾气 SO2,所以应 选用碱液或小苏打溶液吸收,D 项正确。 4.(双选)如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的 是( )。 A.反应①说明 SO2 具有漂白性,反应②说明 SO2 具有酸性 B.反应②中生成物 n(Na2SO3)∶n(NaHSO3)=1∶1 时,则反应物 n(SO2)∶n(NaOH)=2∶3 C.反应③④⑤均属于氧化还原反应 D.工业上可利用反应②和反应④回收利用 SO2 答案 BD 解析反应①中先变蓝后褪色是因为 KIO3 的还原产物先是 I2 后是 I - ,说明 SO2 具有还原性,反 应②属于酸性氧化物与碱的反应,说明 SO2 具有酸性氧化物的通性,A 项错误;根据元素守恒, 当 n(Na2SO3)∶n(NaHSO3)=1∶1 时,n(SO2)∶n(NaOH)=2∶3,B 项正确;反应④不是氧化还原 反应,C 项错误;反应②吸收了二氧化硫,反应④放出了 SO2,可以通过反应②和反应④回收利 用二氧化硫,D 项正确。 挑战创新 某兴趣小组为探究铜与浓硫酸反应时硫酸的最低浓度,设计了如下方案。 方案一、实验装置如图 1 所示
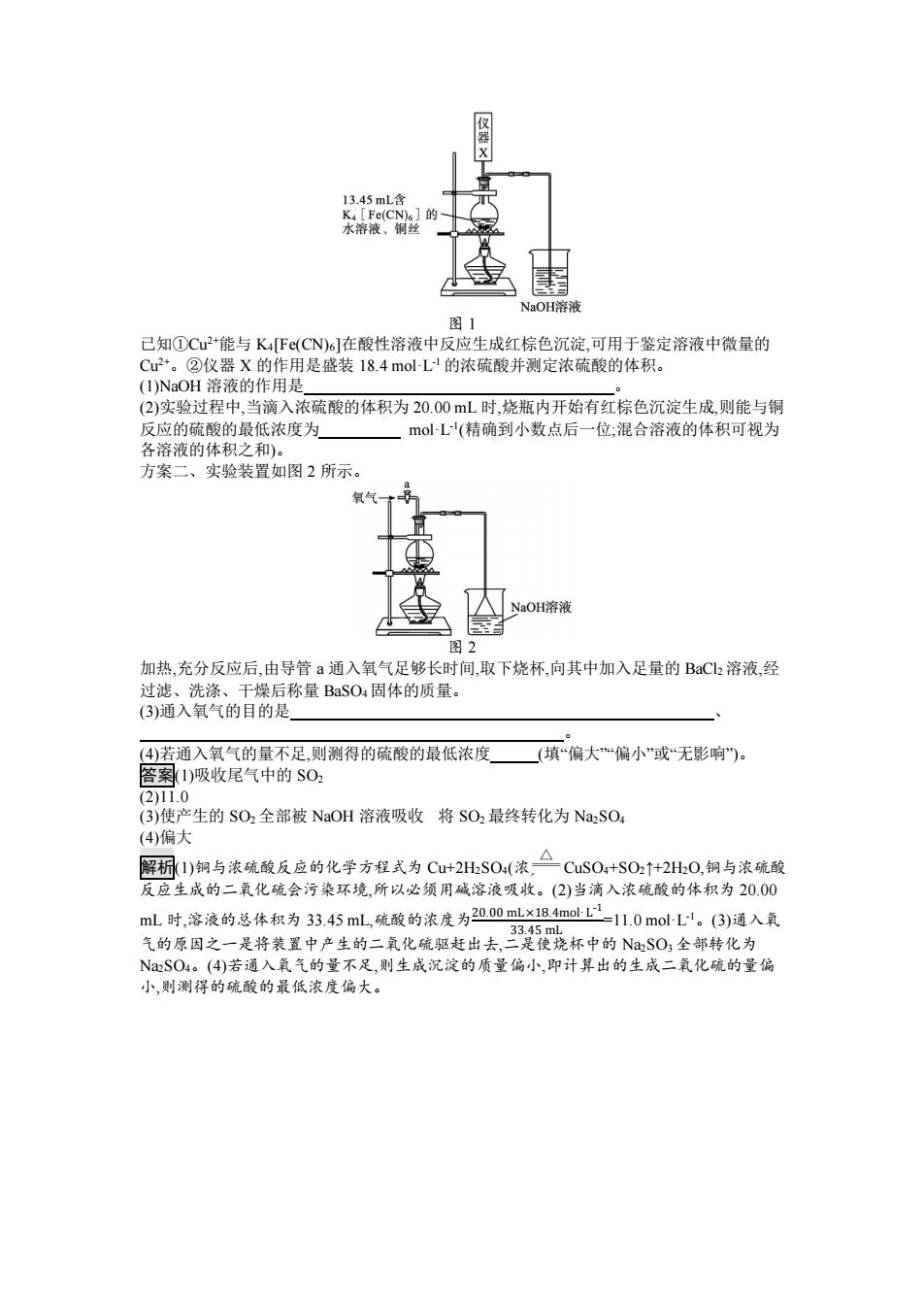
13.45mL含 K4[Fe(CN)s]的 水溶液、铜丝 NaOH溶液 图1 已知①Cu+能与K4F(CN)6]在酸性溶液中反应生成红棕色沉淀,可用于鉴定溶液中微量的 Cu2+。②仪器X的作用是盛装18.4mol-L1的浓硫酸并测定浓硫酸的体积。 (I)NaOH溶液的作用是 (2)实验过程中,当滴入浓硫酸的体积为20.00mL时,烧瓶内开始有红棕色沉淀生成,则能与铜 反应的硫酸的最低浓度为 molL'(精确到小数点后一位,混合溶液的体积可视为 各溶液的体积之和)。 方案二、实验装置如图2所示。 氧气 NaOH溶液 图2 加热,充分反应后,由导管a通入氧气足够长时间,取下烧杯,向其中加入足量的BaC2溶液,经 过滤、洗涤、干燥后称量BaSO4固体的质量。 (3)通入氧气的目的是 (4)若通入氧气的量不足,则测得的硫酸的最低浓度(填“偏大偏小”或“无影响。 答案1)吸收尾气中的$02 (2)11.0 (3)使产生的SO2全部被NaOH溶液吸收将SO2最终转化为Na2SO4 (4)偏大 △ 解标(1)铜与浓硫酸反应的化学方程式为Cu+2HS04(浓,二CuS04+S02↑+2H0,铜与浓硫酸 反应生成的二氧化硫会污染环境,所以必须用碱溶液吸收。(2)当滴入浓硫酸的体积为20.00 mL时,溶液的,总体积为33.45mL,疏酸的浓度为2000mx184mlL11.0mol-L'。(③)通入氧 气的原因之是将装置中产生的二乳化晚胆起出去很先杯中的S0,全部转化为 NSO4。(4)若通入氧气的量不足,则生成沉淀的质量偏小,即计算出的生成二氧化硫的量偏 小,则测得的硫酸的最低浓度偏大
图 1 已知①Cu2+能与 K4[Fe(CN)6]在酸性溶液中反应生成红棕色沉淀,可用于鉴定溶液中微量的 Cu2+。②仪器 X 的作用是盛装 18.4 mol·L -1 的浓硫酸并测定浓硫酸的体积。 (1)NaOH 溶液的作用是 。 (2)实验过程中,当滴入浓硫酸的体积为 20.00 mL 时,烧瓶内开始有红棕色沉淀生成,则能与铜 反应的硫酸的最低浓度为 mol·L -1 (精确到小数点后一位;混合溶液的体积可视为 各溶液的体积之和)。 方案二、实验装置如图 2 所示。 图 2 加热,充分反应后,由导管 a 通入氧气足够长时间,取下烧杯,向其中加入足量的 BaCl2 溶液,经 过滤、洗涤、干燥后称量 BaSO4 固体的质量。 (3)通入氧气的目的是 、 。 (4)若通入氧气的量不足,则测得的硫酸的最低浓度 (填“偏大”“偏小”或“无影响”)。 答案(1)吸收尾气中的 SO2 (2)11.0 (3)使产生的 SO2 全部被 NaOH 溶液吸收 将 SO2 最终转化为 Na2SO4 (4)偏大 解析(1)铜与浓硫酸反应的化学方程式为 Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,铜与浓硫酸 反应生成的二氧化硫会污染环境,所以必须用碱溶液吸收。(2)当滴入浓硫酸的体积为 20.00 mL 时,溶液的总体积为 33.45 mL,硫酸的浓度为20.00 mL×18.4mol·L -1 33.45 mL =11.0 mol·L -1。(3)通入氧 气的原因之一是将装置中产生的二氧化硫驱赶出去,二是使烧杯中的 Na2SO3 全部转化为 Na2SO4。(4)若通入氧气的量不足,则生成沉淀的质量偏小,即计算出的生成二氧化硫的量偏 小,则测得的硫酸的最低浓度偏大