
第2课时化学反应的限度 化学反应条件的 控制 课后·训练提升 合格考基础巩固 1.煤本身是可燃物质,但是块状的煤用明火靠近都不燃烧,而当煤变为粉末状态时,在空气中达 到一定的浓度遇明火即迅速爆炸,其原因是()。 A粉末状态的煤比块状煤的着火点低 B.粉末状态的煤比块状煤放出的热量多 C粉末状态的煤比块状煤的总表面积大 D.粉末状态的煤呈气态,属于可燃性气体 答案C 解析煤变为粉末状态时,总表面积大,与空气中的氧气密切接触时,一旦遇见火源,便发生剧烈 的氧化还原反应。 2.密闭容器中进行反应A(g)+B(g一C(g)+D(g),判断反应是否达到平衡的依据为()。 A压强不随时间改变 B.气体的密度不随时间改变 C.c(A)不随时间改变 D.单位时间里生成C(g)和D(g)的物质的量相等 答案C 解析由于反应物和生成物均为气体,且反应前后气体的总物质的量不变,故气体的压强和密 度在反应过程中始终保持不变,A、B项均不能作为反应达到平衡的标志;C(g)、D(g)均为生 成物,反应的任何时刻,生成C(g)、D(g)的物质的量总是相等,D项错误。当c(A)不变时,反应 处于平衡状态。 3.在一定温度下,向密闭容器中充入一定量的NO2和SO2,发生反应:NO2(g)+SO2(g,一 NO(g)+SO3(g),当化学反应达到平衡时,下列叙述正确的是()。 A.SO2和SO3的物质的量一定相等 B.NO2和SO3的物质的量一定相等 C.反应混合物的总物质的量一定等于反应开始时NO2和SO2的总物质的量 D.SO2、NO2、NO、SO3的物质的量一定相等 答案C 解析题中没有给出各物质的投料情况,NO2、SO2和SO3的量之间没有必然的关系,可能相等, 也可能不等,A、B、D错误;该反应反应前后气体分子数不变,故反应混合物的总物质的量一 定等于反应开始时NO2和SO2的总物质的量,C正确。 4.在一密闭容器中进行反应:2SO2(g)十O2(g,一2SO3(g,已知反应过程中某一时刻S02、O2、 SO3的浓度分别为0.2molL、0.1molL、0.2molL1,当反应达到平衡时,可能存在的数据 是()。 A.S02为0.4molL1.O2为0.2molL-1 B.S02为0.25 mol L- C.S02、S03均为0.15molL D.S03为0.4molL 答案B 解析首先采用极限法分析。若反应向右进行到底,则有:c(S02)=0,c(O2)=0,c(S03)=0.4molL; 若反应向左进行到底,则有:c(S02)=0.4molL1,c(O2)=0.2 mol-L-,c(S0=0。化学反应的限度 决定了可逆反应中的各种成分是不可能完全转化的,所以平衡时各物质的浓度范围为 0<c(S02)<0.4molL,0<c(O2K0.2molL1,0<c(S03)<0.4molL,A、D错误;若S02为0.15
第 2 课时 化学反应的限度 化学反应条件的 控制 课后· 合格考基础巩固 1.煤本身是可燃物质,但是块状的煤用明火靠近都不燃烧,而当煤变为粉末状态时,在空气中达 到一定的浓度遇明火即迅速爆炸,其原因是( )。 A.粉末状态的煤比块状煤的着火点低 B.粉末状态的煤比块状煤放出的热量多 C.粉末状态的煤比块状煤的总表面积大 D.粉末状态的煤呈气态,属于可燃性气体 答案 C 解析煤变为粉末状态时,总表面积大,与空气中的氧气密切接触时,一旦遇见火源,便发生剧烈 的氧化还原反应。 2.密闭容器中进行反应 A(g)+B(g) C(g)+D(g),判断反应是否达到平衡的依据为( )。 A.压强不随时间改变 B.气体的密度不随时间改变 C.c(A)不随时间改变 D.单位时间里生成 C(g)和 D(g)的物质的量相等 答案 C 解析由于反应物和生成物均为气体,且反应前后气体的总物质的量不变,故气体的压强和密 度在反应过程中始终保持不变,A、B 项均不能作为反应达到平衡的标志;C(g)、D(g)均为生 成物,反应的任何时刻,生成 C(g)、D(g)的物质的量总是相等,D 项错误。当 c(A)不变时,反应 处于平衡状态。 3.在一定温度下,向密闭容器中充入一定量的 NO2 和 SO2,发生反应:NO2(g)+SO2(g) NO(g)+SO3(g),当化学反应达到平衡时,下列叙述正确的是( )。 A.SO2 和 SO3 的物质的量一定相等 B.NO2 和 SO3 的物质的量一定相等 C.反应混合物的总物质的量一定等于反应开始时 NO2 和 SO2 的总物质的量 D.SO2、NO2、NO、SO3 的物质的量一定相等 答案 C 解析题中没有给出各物质的投料情况,NO2、SO2 和 SO3 的量之间没有必然的关系,可能相等, 也可能不等,A、B、D 错误;该反应反应前后气体分子数不变,故反应混合物的总物质的量一 定等于反应开始时 NO2 和 SO2 的总物质的量,C 正确。 4.在一密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g),已知反应过程中某一时刻 SO2、O2、 SO3 的浓度分别为 0.2 mol·L -1、0.1 mol·L -1、0.2 mol·L -1 ,当反应达到平衡时,可能存在的数据 是( )。 A.SO2 为 0.4 mol·L -1 ,O2 为 0.2 mol·L -1 B.SO2 为 0.25 mol·L -1 C.SO2、SO3 均为 0.15 mol·L -1 D.SO3 为 0.4 mol·L -1 答案 B 解析首先采用极限法分析。若反应向右进行到底,则有:c(SO2)=0,c(O2)=0,c(SO3)=0.4 mol·L -1 ; 若反应向左进行到底,则有:c(SO2)=0.4 mol·L -1 ,c(O2)=0.2 mol·L -1 ,c(SO3)=0。化学反应的限度 决定了可逆反应中的各种成分是不可能完全转化的,所以平衡时各物质的浓度范围为 0<c(SO2)<0.4 mol·L -1 ,0<c(O2)<0.2 mol·L -1 ,0<c(SO3)<0.4 mol·L -1 ,A、D 错误;若 SO2 为 0.15

molL1,则转化的SO2的浓度为(0.2-0.15)mol-L=0.05molL,此时S03的浓度为(0.2+0.05) molL1=0.25molL,C错误。 5.某温度时,在容积为3L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如 图所示。由图中数据分析,下列结论错误的是( 20 16 12 0.8 0.4 时间/min A.该反应的化学方程式为2Z+Y一3X B.反应开始至2min末,X的化学反应速率为0.2 mol-L1.s C.该反应是由正、逆反应同时开始的,最终建立平衡 D若增加或减少X的物质的量,化学反应速率一定会发生明显的变化 答案B 解析从题图中横、纵坐标及曲线的变化趋势可找到X、Y、Z转化的物质的量之比,即可写 出该反应的化学方程式:2Z+Y一3X,故A项正确;根据化学反应速率的计算公式,可求出X 0.8mol-0.4mol 的化学反应速率:WX3Lx2mnx60smim0.0011mol-Ll,s,故B项错误;根据题图中曲线均 不通过原点,可判断该可逆反应是由正、逆反应同时开始的,故C项正确:因容器容积一定,改 变X的物质的量,必然会导致其浓度的改变,因此化学反应速率也会随之改变,故D项正确。 6.在容积固定的容器中,对于反应A(g)+B(g,一3C(g(正反应为放热反应),下列叙述为平衡状 态标志的是 ()。 ①单位时间内A、B生成C的分子数与分解C的分子数相等 ②外界条件不变时,A、B、C浓度不随时间变化 ③体系的分子总数不再变化 ④体系的压强不再变化 A.①②③ B.①④ C.②③④ D.①②③④ 客案PD 解析①同一物质的正、逆反应速率相等,说明已达平衡;②浓度不变,说明已达平衡;③④由于 该反应是一个气体分子数改变的反应,没有达到平衡之前,压强是改变的,分子总数也是改变 的,只有平衡了,两者才不会改变,故①②③④均正确。 7.一定条件下,对于反应X(g)+3Y(g,一2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c(均 不为零)。达平衡时,X、Y、Z的浓度分别为0.1molL1、0.3moL1和0.08moL1,则下列 判断不合理的是( )。 ①c1:c2=1:3②平衡时,Y和Z的生成速率之比为2:3③X和Y的转化率不相等④ c1的取值范围为0<c1<0.14 mol-L! A.①② B.③④ C.①④ D.②③ 答案D 解析分析浓度变化关系:X(g+3Y(g,一2Z(g) c起始/(mol-L) C2 C3 c平衡/(mol-L-1) 0.10.30.08 反应的化学方程式中反应物的化学计量数之比为1:3,所以反应中X和Y必然以物质的量 之比为1:3消耗,因为达平衡时X和Y浓度之比为1:3,故c1:c2=1:3,①正确;平衡时Y 和Z的生成速率之比应该和化学方程式中对应化学计量数之比相等,故Y和Z的生成速率
mol·L -1 ,则转化的 SO2 的浓度为(0.2-0.15) mol·L -1=0.05 mol·L -1 ,此时 SO3 的浓度为(0.2+0.05) mol·L -1=0.25 mol·L -1 ,C 错误。 5.某温度时,在容积为 3 L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲线如 图所示。由图中数据分析,下列结论错误的是( )。 A.该反应的化学方程式为 2Z+Y 3X B.反应开始至 2 min 末,X 的化学反应速率为 0.2 mol·L -1·s -1 C.该反应是由正、逆反应同时开始的,最终建立平衡 D.若增加或减少 X 的物质的量,化学反应速率一定会发生明显的变化 答案 B 解析从题图中横、纵坐标及曲线的变化趋势可找到 X、Y、Z 转化的物质的量之比,即可写 出该反应的化学方程式:2Z+Y 3X,故 A 项正确;根据化学反应速率的计算公式,可求出 X 的化学反应速率:v(X)= 0.8mol-0.4mol 3 L×2min×60 s·min-1 =0.001 1 mol·L -1·s -1 ,故 B 项错误;根据题图中曲线均 不通过原点,可判断该可逆反应是由正、逆反应同时开始的,故 C 项正确;因容器容积一定,改 变 X 的物质的量,必然会导致其浓度的改变,因此化学反应速率也会随之改变,故 D 项正确。 6.在容积固定的容器中,对于反应 A(g)+B(g) 3C(g)(正反应为放热反应),下列叙述为平衡状 态标志的是 ( )。 ①单位时间内 A、B 生成 C 的分子数与分解 C 的分子数相等 ②外界条件不变时,A、B、C 浓度不随时间变化 ③体系的分子总数不再变化 ④体系的压强不再变化 A.①②③ B.①④ C.②③④ D.①②③④ 答案 D 解析①同一物质的正、逆反应速率相等,说明已达平衡;②浓度不变,说明已达平衡;③④由于 该反应是一个气体分子数改变的反应,没有达到平衡之前,压强是改变的,分子总数也是改变 的,只有平衡了,两者才不会改变,故①②③④均正确。 7.一定条件下,对于反应 X(g)+3Y(g) 2Z(g),若 X、Y、Z 的起始浓度分别为 c1、c2、c3(均 不为零)。达平衡时,X、Y、Z 的浓度分别为 0.1 mol·L -1、0.3 mol·L -1 和 0.08 mol·L -1 ,则下列 判断不合理的是( )。 ①c1∶c2=1∶3 ②平衡时,Y 和 Z 的生成速率之比为 2∶3 ③X 和 Y 的转化率不相等 ④ c1 的取值范围为 0<c1<0.14 mol·L -1 A.①② B.③④ C.①④ D.②③ 答案 D 解析分析浓度变化关系:X(g)+3Y(g) 2Z(g) c 起始/(mol·L -1 ) c1 c2 c3 c 平衡/(mol·L -1 ) 0.1 0.3 0.08 反应的化学方程式中反应物的化学计量数之比为 1∶3,所以反应中 X 和 Y 必然以物质的量 之比为 1∶3 消耗,因为达平衡时 X 和 Y 浓度之比为 1∶3,故 c1∶c2=1∶3,①正确;平衡时 Y 和 Z 的生成速率之比应该和化学方程式中对应化学计量数之比相等,故 Y 和 Z 的生成速率

之比为3:2,②错误;由于起始时反应物是按化学计量数之比配料,故X和Y的转化率相等 ③错误:运用极限法,假设Z完全转化为反应物,c1的极限值为0.14molL1,而题设c1>0,反应 又是可逆的④正确。 8.将1mol纯净的A置于真空密闭容器中(假设容器容积不变,固体试样体积忽略不计),在恒 定温度下使其分解达到平衡:A(S)一2B(g)+C(g),下列可以判断该反应已达到化学平衡状态 的是()。 A.反应速率:y(B)=v运(C) B.B的体积分数不变 C.气体的密度保持不变 D.混合气体的平均摩尔质量保持不变 答案c 解析根据方程式可知反应速率:v(B)=2v(C)时达到平衡状态,A项错误;体系中气体只有 B、C,无论是否达到了平衡状态,体积比始终是2:1,B、C的体积分数始终不变,B项错误;根 据巴,容器容积不变,反应物A是固体,只要反应没有达到平衡状态,气体的质量就会改变,当 达到了平衡状态后,气体的密度不再改变,C项正确;体系中气体只有B、C,无论是否达到了平 衡状态,B和C的物质的量比始终是2:1,混合气体的平均摩尔质量始终保持不变,D项错 误。 9.在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时 间变化的曲线如图所示。请回答下列问题 02 111+10) 时间s (1)该反应的化学方程式为】 (2)0-1内,A的反应速率为 (3)反应后与反应前的压强之比为 (4)1+10s)时,A气体的体积分数为 ,此时v(A)(填> 解标1)从0到h时,△c(A)=0.8molL1-0.2 mol L-=0.6molL,△c(B)=0.5molL1-0.3molL 1=0.2molL,△c(C)=0.4molL,三者之比为△c(A):△c(B):△c(C)=0.6molL:0.2molL 1:0.4molL1=3:1:2,所以化学方程式为3A+E一2C。 (2)0-h内,A的反应速率为6molL=5, mol-L-1.s!。 t (3)压强之比等于物质的量之比,为9:13。 (4)A气体的体积分数为。 0.2mol-L1 0.2mol-L+0.3 mol-L0.4 mol-L =名22.2%,在4~1+10s)反应处于平 衡状态,V(A)=3v(B),故v(A)Pv(B)。 10.一定温度下,在容积为V的密闭容器中进行反应:aN(g,一bM(g)。M、N的物质的量随时 间的变化曲线如下图所示:
之比为 3∶2,②错误;由于起始时反应物是按化学计量数之比配料,故 X 和 Y 的转化率相等, ③错误;运用极限法,假设 Z 完全转化为反应物,c1 的极限值为 0.14 mol·L -1 ,而题设 c1>0,反应 又是可逆的,④正确。 8.将 1 mol 纯净的 A 置于真空密闭容器中(假设容器容积不变,固体试样体积忽略不计),在恒 定温度下使其分解达到平衡:A(s) 2B(g)+C(g),下列可以判断该反应已达到化学平衡状态 的是( )。 A.反应速率:v 正(B)=v 逆(C) B.B 的体积分数不变 C.气体的密度保持不变 D.混合气体的平均摩尔质量保持不变 答案 C 解析根据方程式可知反应速率:v 正(B)=2v 逆(C)时达到平衡状态,A 项错误;体系中气体只有 B、C,无论是否达到了平衡状态,体积比始终是 2∶1,B、C 的体积分数始终不变,B 项错误;根 据 ρ= 𝑚 𝑉 ,容器容积不变,反应物 A 是固体,只要反应没有达到平衡状态,气体的质量就会改变,当 达到了平衡状态后,气体的密度不再改变,C 项正确;体系中气体只有 B、C,无论是否达到了平 衡状态,B 和 C 的物质的量比始终是 2∶1,混合气体的平均摩尔质量始终保持不变,D 项错 误。 9.在一定条件下,A 气体与 B 气体反应生成 C 气体。反应过程中,反应物与生成物的浓度随时 间变化的曲线如图所示。请回答下列问题: (1)该反应的化学方程式为 。 (2)0~t1 内,A 的反应速率为 。 (3)反应后与反应前的压强之比为 。 (4)(t1+10 s)时,A 气体的体积分数为 ,此时 v 正(A) (填“>”“ 解析(1)从 0 到 t1 时,Δc(A)=0.8 mol·L -1 -0.2 mol·L -1=0.6 mol·L -1 ,Δc(B)=0.5 mol·L -1 -0.3 mol·L - 1=0.2 mol·L -1 ,Δc(C)=0.4 mol·L -1 ,三者之比为 Δc(A)∶Δc(B)∶Δc(C)=0.6 mol·L -1∶0.2 mol·L - 1∶0.4 mol·L -1=3∶1∶2,所以化学方程式为 3A+B 2C。 (2)0~t1 内,A 的反应速率为0.6mol·L -1 𝑡1 = 0.6 𝑡1 mol·L -1·s -1。 (3)压强之比等于物质的量之比,为 9∶13。 (4)A 气体的体积分数为 0.2mol·L -1 0.2mol·L -1+0.3 mol·L -1+0.4 mol·L -1 = 2 9 =22.2%;在 t1~(t1+10 s)反应处于平 衡状态,v 正(A)=3v 逆(B),故 v 正(A)>v 逆(B)。 10.一定温度下,在容积为 V 的密闭容器中进行反应:aN(g) bM(g)。M、N 的物质的量随时 间的变化曲线如下图所示:

时间/min (1)此反应的化学方程式中a (2)山到2时刻,以M的浓度变化表示的平均反应速率为。 (3)下列叙述能说明上述反应达到平衡状态的是(填字母)。 A.反应中M与N的物质的量之比为1:1 B.混合气体的总质量不随时间的变化而变化 C.混合气体的总物质的量不随时间的变化而变化 D.单位时间内每消耗a mol N,同时生成bmol M E.混合气体的压强不随时间的变化而变化 答案1)2 mol-Lmin (3)CE 解析1)化学计量数之比等于物质的量的变化量之比,所以a:b=(8mol-2mol):(5mol-2 mol=2:1,该反应的化学方程式为2N(g,一M(g)。 (2)v(M)=4mol-3mol 1 《G-t)mnx7=a-tx7molL,minr。 (3)达到平衡状态时,各组分的浓度不再发生变化,物质的量相等不能说明达到平衡状态,A选 项错误:该反应的反应物和生成物都是气体根据质量守恒定律.反应前后,混合气体的质量始 终不变B选项错误:该反应为气体分子数减小的反应,若反应没有达到平衡状态,反应过程中 气体的总物质的量和压强始终在减小,当气体的总物质的量和压强不再发生变化时则说明反 应达到了平衡状态,C和E选项正确:消耗a mol N和生成bmol M都表示的是正反应速率,没 有体现正、逆反应速率的大小关系,不能说明反应达到了平衡状态,D选项错误。 等级考拓展提高 1.(双选)在一定条件下,使10molS03在容积固定为2L的密闭容器中发生反 应:2S02(g)+02(g一2S03(g),则下图中正确的是()。 SO. 正=道 (化学平衡状态) 剑 (M表示混合气体的 平均相对分子质量) C 0 含案D 解析刚开始投入的是SO3,正反应速率为0,故A项错误;根据化学方程式可知SO2与O2的物 质的量之比为2:1,故B项错误:根据M=巴气体的总质量不变,而反应向逆反应方向进行, n
(1)此反应的化学方程式中𝑎 𝑏 = 。 (2)t1 到 t2 时刻,以 M 的浓度变化表示的平均反应速率为 。 (3)下列叙述能说明上述反应达到平衡状态的是 (填字母)。 A.反应中 M 与 N 的物质的量之比为 1∶1 B.混合气体的总质量不随时间的变化而变化 C.混合气体的总物质的量不随时间的变化而变化 D.单位时间内每消耗 a mol N,同时生成 b mol M E.混合气体的压强不随时间的变化而变化 答案(1)2 (2) 1 (𝑡2 -𝑡1 )×𝑉 mol·L -1·min-1 (3)CE 解析(1)化学计量数之比等于物质的量的变化量之比,所以 a∶b=(8 mol-2 mol)∶(5 mol-2 mol)=2∶1,该反应的化学方程式为 2N(g) M(g)。 (2)v(M)= 4mol-3mol (𝑡2 -𝑡1 ) 𝑚𝑖𝑛×𝑉L = 1 (𝑡2 -𝑡1 )×𝑉 mol·L -1·min-1。 (3)达到平衡状态时,各组分的浓度不再发生变化,物质的量相等不能说明达到平衡状态,A 选 项错误;该反应的反应物和生成物都是气体,根据质量守恒定律,反应前后,混合气体的质量始 终不变,B 选项错误;该反应为气体分子数减小的反应,若反应没有达到平衡状态,反应过程中 气体的总物质的量和压强始终在减小,当气体的总物质的量和压强不再发生变化时,则说明反 应达到了平衡状态,C 和 E 选项正确;消耗 a mol N 和生成 b mol M 都表示的是正反应速率,没 有体现正、逆反应速率的大小关系,不能说明反应达到了平衡状态,D 选项错误。 等级考拓展提高 1.(双选)在一定条件下,使 10 mol SO3 在容积固定为 2 L 的密闭容器中发生反 应:2SO2(g)+O2(g) 2SO3(g),则下图中正确的是( )。 答案 CD 解析刚开始投入的是 SO3,正反应速率为 0,故 A 项错误;根据化学方程式可知 SO2 与 O2 的物 质的量之比为 2∶1,故 B 项错误;根据𝑀 = 𝑚 𝑛 ,气体的总质量不变,而反应向逆反应方向进行,n

变大,故丽变小,达到平衡时丽不再变化,故C项正确;反应向逆反应方向进行,根据巴,气体的 总质量不变,容积固定,P始终不变,故D项正确。 2.(双选)一定温度下,在容积恒定的密闭容器中,加入1molX(g)与1molY(g),发生反应 X(g)+3Y(g一2W(g)+M(g),下列说法正确的是( A.向容器中通入A虹,压强增大,反应速率增大 B.当反应达到平衡状态时,X与W的物质的量浓度之比一定为1:2 C.当X的物质的量分数不再改变,表明该反应已达平衡 D若增大Y的浓度,正反应速率增大,逆反应速率增大 答案CD 解析容积恒定,通入A虹,反应体系中各物质的浓度不变,反应速率不变,A项错误;X和W分别 为反应物和生成物,化学计量数只表示反应过程的转化比例,并不能说明达到平衡后的浓度之 比,B项错误;当X的物质的量分数不再变化时,反应达到平衡,C项正确:若增大反应物浓度, 正、逆反应速率均会增大,D项正确。 3.假设某化学反应的反应过程如图所示,观察分析,符合图中变化的化学反应为( 9 00 P 6b 反应前 反应后 A.A2+3B2→2AB3 B.2AB2+B22AB3 C.2A2B+5B2—4AB3 D.2AB2+B2—2AB3 答案B 解析由图可知,反应物用AB2、B2表示,生成物用AB;表示,反应后反应物与生成物共存,说明 反应不能进行到底,为可逆反应,结合反应前后原子守恒可知,反应的化学方程式为2AB2+B2 =2AB30 4.将0.2molL1KI溶液和0.1molL1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实 验,能说明溶液中存在化学平衡2Fe3+2一2F2+2”的是( )。(提示:Fe2+遇到 KFe(CN)6]产生蓝色沉淀) 实验编号 实验操作 实验现象 滴入KSCN溶液 溶液变红色 2 滴入AgNO3溶液 有黄色沉淀生成 ③ 滴入K[Fe(CN)6]溶液 有蓝色沉淀生成 滴入淀粉溶液 溶液变蓝色 A.①和② B.②和④ C.③和④ D.①和③ 含案A 解析设混合后溶液体积为V,则起始时n))=0.2 mol L!×=0.2Vmol,n(Fc3+2×0.1molL 1×V=0.2Vmol,若此反应不可逆,则与Fe3+恰好完全反应,溶液中无F3+和上,故只需证明溶液 中含F3+和I,即能证明此反应为可逆反应,能建立化学平衡。①现象说明存在Fe3+,②现象说 明有上,③现象说明有F2+生成,④现象说明有I2生成。但是③④不能说明反应为可逆反应。 5.在2L的恒容密闭容器内,800℃时进行反应2NO(g+O2(g,一2NO2(g),已知nNO)随时间 的变化如下表: 时间/s 0 2 3 4 n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007 (I)下图表示NO2变化的曲线是 用O2表示从0~2s内该反应的平均速率
变大,故𝑀变小,达到平衡时𝑀不再变化,故 C 项正确;反应向逆反应方向进行,根据 ρ= 𝑚 𝑉 ,气体的 总质量不变,容积固定,ρ 始终不变,故 D 项正确。 2.(双选)一定温度下,在容积恒定的密闭容器中,加入 1 mol X(g)与 1 mol Y(g),发生反应 X(g)+3Y(g) 2W(g)+M(g),下列说法正确的是( )。 A.向容器中通入 Ar,压强增大,反应速率增大 B.当反应达到平衡状态时,X 与 W 的物质的量浓度之比一定为 1∶2 C.当 X 的物质的量分数不再改变,表明该反应已达平衡 D.若增大 Y 的浓度,正反应速率增大,逆反应速率增大 答案 CD 解析容积恒定,通入 Ar,反应体系中各物质的浓度不变,反应速率不变,A 项错误;X 和 W 分别 为反应物和生成物,化学计量数只表示反应过程的转化比例,并不能说明达到平衡后的浓度之 比,B 项错误;当 X 的物质的量分数不再变化时,反应达到平衡,C 项正确;若增大反应物浓度, 正、逆反应速率均会增大,D 项正确。 3.假设某化学反应的反应过程如图所示,观察分析,符合图中变化的化学反应为( )。 A.A2+3B2 2AB3 B.2AB2+B2 2AB3 C.2A2B+5B2 4AB3 D.2AB2+B2 2AB3 答案 B 解析由图可知,反应物用 AB2、B2 表示,生成物用 AB3 表示,反应后反应物与生成物共存,说明 反应不能进行到底,为可逆反应,结合反应前后原子守恒可知,反应的化学方程式为 2AB2+B2 2AB3。 4.将 0.2 mol·L -1 KI 溶液和 0.1 mol·L -1 Fe2(SO4)3 溶液等体积混合后,取混合液分别完成下列实 验,能说明溶液中存在化学平衡“2Fe3++2I- 2Fe2++I2”的是( )。(提示:Fe2+遇到 K3[Fe(CN)6]产生蓝色沉淀) 实验编号 实验操作 实验现象 ① 滴入 KSCN 溶液 溶液变红色 ② 滴入 AgNO3 溶液 有黄色沉淀生成 ③ 滴入 K3[Fe(CN)6]溶液 有蓝色沉淀生成 ④ 滴入淀粉溶液 溶液变蓝色 A.①和② B.②和④ C.③和④ D.①和③ 答案 A 解析设混合后溶液体积为 V,则起始时 n(I- )=0.2 mol·L -1×V=0.2V mol,n(Fe3+)=2×0.1 mol·L - 1×V=0.2V mol,若此反应不可逆,则 I -与 Fe3+恰好完全反应,溶液中无 Fe3+和 I - ,故只需证明溶液 中含 Fe3+和 I - ,即能证明此反应为可逆反应,能建立化学平衡。①现象说明存在 Fe3+ ,②现象说 明有 I - ,③现象说明有 Fe2+生成,④现象说明有 I2 生成。但是③④不能说明反应为可逆反应。 5.在 2 L 的恒容密闭容器内,800 ℃时进行反应 2NO(g)+O2(g) 2NO2(g),已知 n(NO)随时间 的变化如下表: 时间/s 0 1 2 3 4 5 n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007 (1)下图表示 NO2 变化的曲线是 。用 O2 表示从 0~2 s 内该反应的平均速率 v=

>0.010 0.005 (2)能说明该反应己达到平衡状态的是 A.1vNO2)=2O2) B.容器内压强保持不变 C.vNO)=2v(O2) D.容器内密度保持不变 (3)为使该反应的反应速率增大,下列措施正确的是 A.及时分离出NO2气体 B适当升高温度 C增大O2的浓度 D.选择高效催化剂 答1)b1.5×103molL1s (2)BC (3)BCD 解析1)NO2的起始浓度为c(NO2)=O,2s时cNO2)可根据图表中nNO)的变化量求 解,cN02)=△cNO)=002mo-n08mo-0.006mol-L',故答案选b。由图表可求0-2s内 2L NO)002ml008mol-0.003mol-Lls,故02)=l.5×10 mol-L.s。 2L×2s (2)A项,在任意状态下,都存在NO2)=21v(O2),不能作为平衡状态的标志。 B项,因该反应为气体分子数不等的反应,故压强不变可作为平衡状态的标志。 C项,由v(NO)=2v玉(O2),可推出v(NO)=vNO),说明已达到平衡状态。 D项,由于平衡体系中全是气体,容器容积固定,故任意状态下密度不变。 (3)及时分离出NO2气体,不能增大反应速率,故A错误;适当升高温度,反应速率增大,故B正 确:增大O2的浓度能增大反应速率,故C正确:催化剂能增大反应速率,故D正确。 6.在容积为10L的密闭容器中,通入一定量的C0和HO,850℃时发生反应:CO(g)+H2O(g) ℃O2(g)+H(g). 0.30 H20 ·0.20 cO 012345678 (/min (1)C0和H0的浓度变化如图所示,则0~4min的平均反应速率C0)= mol.L min。 (2)如图中45min之间该反应 (填“是”或“否)处于平衡状态,判断理 由 (3)判断该反应达到平衡的依据是 A.CO减小的化学反应速率和CO2减小的化学反应速率相等 B.CO、H2O、CO2、H2的浓度都相等 C.CO、HO、CO2、H的浓度都不再发生变化 D.正、逆反应速率都为零 (4)一定条件下,使绝热恒容密闭容器中的反应达到平衡,正反应速率随时间变化的示意图如 图所示。下列得出的结论正确的是
(2)能说明该反应已达到平衡状态的是 。 A.v(NO2)=2v(O2) B.容器内压强保持不变 C.v 逆(NO)=2v 正(O2) D.容器内密度保持不变 (3)为使该反应的反应速率增大,下列措施正确的是 。 A.及时分离出 NO2 气体 B.适当升高温度 C.增大 O2 的浓度 D.选择高效催化剂 答案(1)b 1.5×10-3 mol·L -1·s -1 (2)BC (3)BCD 解析(1)NO2 的起始浓度为 c(NO2)=0,2 s 时 c(NO2)可根据图表中 n(NO)的变化量求 解,c(NO2)=Δc(NO)=0.02mol-0.008mol 2 L =0.006 mol·L -1 ,故答案选 b。由图表可求 0~2 s 内 v(NO)=0.02mol-0.008mol 2 L×2 s =0.003 mol·L -1·s -1 ,故 v(O2)=1.5×10-3mol·L -1·s -1。 (2)A 项,在任意状态下,都存在 v(NO2)=2v(O2),不能作为平衡状态的标志。 B 项,因该反应为气体分子数不等的反应,故压强不变可作为平衡状态的标志。 C 项,由 v 逆(NO)=2v 正(O2),可推出 v 逆(NO)=v 正(NO),说明已达到平衡状态。 D 项,由于平衡体系中全是气体,容器容积固定,故任意状态下密度不变。 (3)及时分离出 NO2 气体,不能增大反应速率,故 A 错误;适当升高温度,反应速率增大,故 B 正 确;增大 O2 的浓度能增大反应速率,故 C 正确;催化剂能增大反应速率,故 D 正确。 6.在容积为 10 L 的密闭容器中,通入一定量的 CO 和 H2O,850 ℃时发生反应:CO(g)+H2O(g) CO2(g)+H2(g)。 (1)CO 和 H2O 的浓度变化如图所示,则 0~4 min 的平均反应速率 v(CO)= mol·L - 1·min-1。 (2)如图中 4~5 min 之间该反应 (填“是”或“否”)处于平衡状态,判断理 由 。 (3)判断该反应达到平衡的依据是 。 A.CO 减小的化学反应速率和 CO2 减小的化学反应速率相等 B.CO、H2O、CO2、H2 的浓度都相等 C.CO、H2O、CO2、H2 的浓度都不再发生变化 D.正、逆反应速率都为零 (4)一定条件下,使绝热恒容密闭容器中的反应达到平衡,正反应速率随时间变化的示意图如 图所示。下列得出的结论正确的是
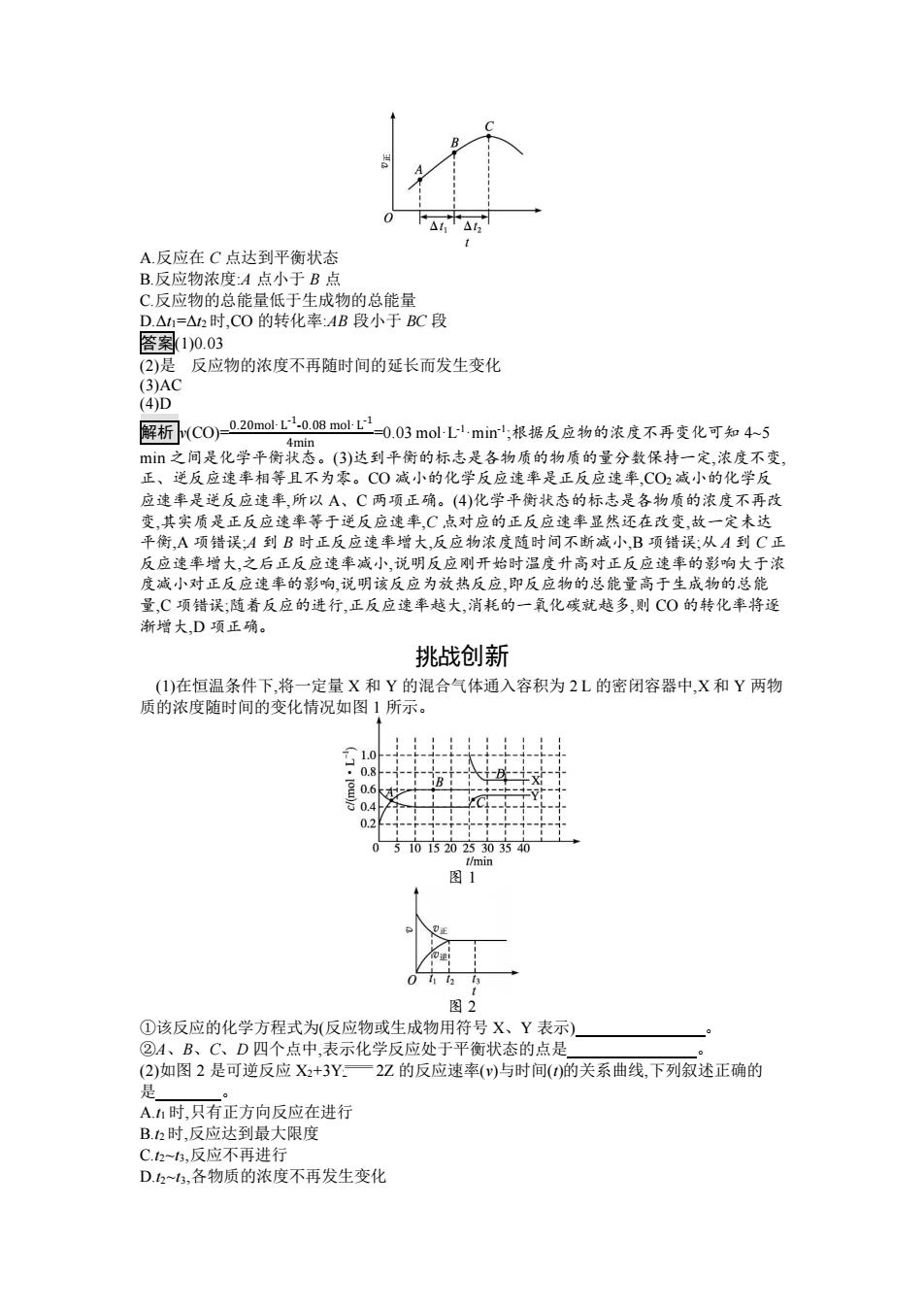
A.反应在C点达到平衡状态 B.反应物浓度:A点小于B点 C.反应物的总能量低于生成物的总能量 D.△11=△12时,CO的转化率:AB段小于BC段 答案1)0.03 (2)是反应物的浓度不再随时间的延长而发生变化 (3)AC (4)D 解析(CO)020molL008molL正0.03molL,miml根据反应物的浓度不再变化可知45 4min m之间是化学平衡状态。(3)达到平衡的标志是各物质的物质的量分数保持一定,浓度不变 正、逆反应速率相等且不为零。C0减小的化学反应速率是正反应速率,CO2减小的化学反 应速率是逆反应速率,所以A、C两项正确。(4)化学平衡状态的标志是各物质的浓度不再改 变,其实质是正反应速率等于逆反应速率,C点对应的正反应速率显然还在改变,故一定未达 平衡,A项错误:A到B时正反应速率增大反应物浓度随时间不断减小,B项错误:从A到C正 反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓 度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能 量,C项错误;随着反应的进行,正反应速率越大,消耗的一氧化碳就越多,则C0的转化率将逐 渐增大D项正确。 挑战创新 (1)在恒温条件下,将一定量X和Y的混合气体通入容积为2L的密闭容器中,X和Y两物 质的浓度随时间的变化情况如图1所示。 0.8 0.6 0.2 510152025303540 t/min 图1 图2 ①该反应的化学方程式为(反应物或生成物用符号X、Y表示) ②A、B、C、D四个点中,表示化学反应处于平衡状态的点是 (2)如图2是可逆反应X2+3Y一2Z的反应速率(v)与时间()的关系曲线,下列叙述正确的 是 A.1时,只有正方向反应在进行 B.12时,反应达到最大限度 C.23,反应不再进行 D.2~3,各物质的浓度不再发生变化
A.反应在 C 点达到平衡状态 B.反应物浓度:A 点小于 B 点 C.反应物的总能量低于生成物的总能量 D.Δt1=Δt2 时,CO 的转化率:AB 段小于 BC 段 答案(1)0.03 (2)是 反应物的浓度不再随时间的延长而发生变化 (3)AC (4)D 解析 v(CO)=0.20mol·L -1 -0.08 mol·L -1 4min =0.03 mol·L -1·min-1 ;根据反应物的浓度不再变化可知 4~5 min 之间是化学平衡状态。(3)达到平衡的标志是各物质的物质的量分数保持一定,浓度不变, 正、逆反应速率相等且不为零。CO 减小的化学反应速率是正反应速率,CO2 减小的化学反 应速率是逆反应速率,所以 A、C 两项正确。(4)化学平衡状态的标志是各物质的浓度不再改 变,其实质是正反应速率等于逆反应速率,C 点对应的正反应速率显然还在改变,故一定未达 平衡,A 项错误;A 到 B 时正反应速率增大,反应物浓度随时间不断减小,B 项错误;从 A 到 C 正 反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓 度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能 量,C 项错误;随着反应的进行,正反应速率越大,消耗的一氧化碳就越多,则 CO 的转化率将逐 渐增大,D 项正确。 挑战创新 (1)在恒温条件下,将一定量 X 和 Y 的混合气体通入容积为 2 L 的密闭容器中,X 和 Y 两物 质的浓度随时间的变化情况如图 1 所示。 图 1 图 2 ①该反应的化学方程式为(反应物或生成物用符号 X、Y 表示) 。 ②A、B、C、D 四个点中,表示化学反应处于平衡状态的点是 。 (2)如图 2 是可逆反应 X2+3Y2 2Z 的反应速率(v)与时间(t)的关系曲线,下列叙述正确的 是 。 A.t1 时,只有正方向反应在进行 B.t2 时,反应达到最大限度 C.t2~t3,反应不再进行 D.t2~t3,各物质的浓度不再发生变化

(3)1℃时,将2molS02和1molO2通入容积为2L的恒温恒容密闭容器中,发生如下反 应:2SO2(g)+O2(g,一2SO(g),2min时反应达到平衡,此时测得反应物O2还剩余0.8mol。 从反应开始到化学平衡,生成SO,的平均反应速率为 :平衡时SO2的转化率 为 。若将物质的量之比为1:1的SO2和O2的混合气体通入一个恒温恒压的密闭 容器中,反应达到平衡时,混合气体体积减少了20%,$02的转化率为 图案1)①Y一2X②B、D (2)BD (3)0.1mol-Lmin120%80% 解析1)从浓度变化趋势来看,X为生成物,Y为反应物。15min时X增加了0.4molL,Y减 小了0.2molL,故X、Y的化学计量数之比为2:1;10-25min内,X、Y的浓度不发生变化, 达到化学平衡状态,则该反应为可逆反应,化学方程式为Y一2X。B、D两点处于化学平衡 状态。(2)对于可逆反应,反应开始后的任何时刻,正、逆反应均在进行。根据图像可知,O2 反应处于非平衡状态,2后正、逆反应速率相等,但不等于0:处于平衡状态时,各物质的浓度不 再发生变化,故B、D两项正确。(3)由题意得 2S02(g)+ O2(g,一2S03(g) 起始浓度/(molL1)1 0.5 0 转化浓度/(molL1)0.2 0.1 0.2 平衡浓度/(mol-L-1)0.8 0.4 0.2 VSO)m0.1 mol-LminSO:-02molL 1m01户×100%=20%。若S02、02的物质的 量均为1mol.反应过程中减少了0.4mol.即反应了0.8 mol SO2.SO2的转化率为80%
(3)t ℃时,将 2 mol SO2 和 1 mol O2 通入容积为 2 L 的恒温恒容密闭容器中,发生如下反 应:2SO2(g)+O2(g) 2SO3(g),2 min 时反应达到平衡,此时测得反应物 O2 还剩余 0.8 mol。 从反应开始到化学平衡,生成 SO3 的平均反应速率为 ;平衡时 SO2 的转化率 为 。若将物质的量之比为 1∶1 的 SO2 和 O2 的混合气体通入一个恒温恒压的密闭 容器中,反应达到平衡时,混合气体体积减少了 20%,SO2 的转化率为 。 答案(1)①Y 2X ②B、D (2)BD (3)0.1 mol·L -1·min-1 20% 80% 解析(1)从浓度变化趋势来看,X 为生成物,Y 为反应物。15 min 时 X 增加了 0.4 mol·L -1 ,Y 减 小了 0.2 mol·L -1 ,故 X、Y 的化学计量数之比为 2∶1;10~25 min 内,X、Y 的浓度不发生变化, 达到化学平衡状态,则该反应为可逆反应,化学方程式为 Y 2X。B、D 两点处于化学平衡 状态。(2)对于可逆反应,反应开始后的任何时刻,正、逆反应均在进行。根据图像可知,O~t2 反应处于非平衡状态,t2 后正、逆反应速率相等,但不等于 0;处于平衡状态时,各物质的浓度不 再发生变化,故 B、D 两项正确。(3)由题意得, 2SO2(g) + O2(g) 2SO3(g) 起始浓度/(mol·L -1 ) 1 0.5 0 转化浓度/(mol·L -1 ) 0.2 0.1 0.2 平衡浓度/(mol·L -1 ) 0.8 0.4 0.2 则 v(SO3)=0.2mol·L -1 2min =0.1 mol·L -1·min-1 ,α(SO2)=0.2mol·L -1 1mol·L -1 ×100%=20%。若 SO2、O2 的物质的 量均为 1 mol,反应过程中减少了 0.4 mol,即反应了 0.8 mol SO2,SO2 的转化率为 80%