
第1课时 1 硫和二氧化硫 课后·训练提升 合格考基础巩固 1.下列关于硫的说法不正确的是()。 A.试管内壁附着的硫可用二硫化碳溶解除去 B.游离态的硫存在于火山喷口附近或地壳的岩层里 C,单质硫既具有氧化性.又具有还原性 D.硫在过量纯氧中的燃烧产物是三氧化硫 答案D 解析硫在氧气中燃烧时只能生成SO2,SO,可由SO2催化氧化制取,D项错误。 2.下列反应中,不能说明SO2是酸性氧化物的是() A.SO2+H2OH2SO: B.SO2+2NaOH-Na2SO3+H2O C.S02+2HS—3S+2H20 D.SO2+Na2ONaSO; 答案c 解析SO2是酸性氧化物,能与水反应生成对应的酸,与碱反应生成盐和水,能与碱性氧化物反 应生成含氧酸盐;SO2能与H2S反应是因为发生氧化还原反应SO2+2H一3S+2H2O,不能 说明SO2是酸性氧化物。 3.下列对可逆反应的认识正确的是()。 A既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应 B.在同一条件下,同时向正反应和逆反应两个方向进行的反应叫可逆反应 C.电解水生成氢气和氧气与氢气和氧气点燃生成水的反应是可逆反应 D.可逆反应一定属于氧化还原反应 答案B 解析可逆反应是在“同一条件下”、能“同时”向正反应和逆反应“两个方向”进行的化学反 应,A项错误;在同一条件下,同时向正反应和逆反应两个方向进行的反应叫可逆反应,B项正 确:电解水生成氢气和氧气与氢气和氧气点燃生成水的反应不是可逆反应,因为反应条件不 同,C项错误,可逆反应不一定属于氧化还原反应,例如二氧化硫与水的反应,D项错误。 4.将等物质的量的$O2和C2同时作用于湿润的红色布条,则布条的颜色()。 A变白 B.不变 C.先褪色后又复原 D.变为无色 答案B 解析二氧化硫和氟气虽然都能使湿润的红色布条褪色,但等物质的量的二氧化硫和氟气同时 作用于湿润的有色布条时发生反应SO2+C12+2HC一H2SO4+2HCL,不再具有漂白作用,故布 条的颜色保持不变。 5.将SO2通入下列各溶液中,均能使溶液褪色.其中利用$O2漂白性的是()。 A.酸性KMnO4溶液 B.品红溶液 C.FeCl3溶液 D.溴水 客案B 解析A项,酸性条件下Mn04将SO2氧化成S0?,本身被还原成无色的Mn+;B项,SO2漂白品 红溶液:C项.2Fe3++SO2+2H2C—S02+4H+2Fe2+:D项.SO2+Br2+2H2C—H2SO4+2HBr。 6.下列实验报告记录的实验现象正确的是()
第 1 课时 硫和二氧化硫 课后· 合格考基础巩固 1.下列关于硫的说法不正确的是( )。 A.试管内壁附着的硫可用二硫化碳溶解除去 B.游离态的硫存在于火山喷口附近或地壳的岩层里 C.单质硫既具有氧化性,又具有还原性 D.硫在过量纯氧中的燃烧产物是三氧化硫 答案 D 解析硫在氧气中燃烧时只能生成 SO2,SO3 可由 SO2 催化氧化制取,D 项错误。 2.下列反应中,不能说明 SO2 是酸性氧化物的是( )。 A.SO2+H2O H2SO3 B.SO2+2NaOH Na2SO3+H2O C.SO2+2H2S 3S+2H2O D.SO2+Na2O Na2SO3 答案 C 解析 SO2 是酸性氧化物,能与水反应生成对应的酸,与碱反应生成盐和水,能与碱性氧化物反 应生成含氧酸盐;SO2 能与 H2S 反应是因为发生氧化还原反应 SO2+2H2S 3S+2H2O,不能 说明 SO2 是酸性氧化物。 3.下列对可逆反应的认识正确的是( )。 A.既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应 B.在同一条件下,同时向正反应和逆反应两个方向进行的反应叫可逆反应 C.电解水生成氢气和氧气与氢气和氧气点燃生成水的反应是可逆反应 D.可逆反应一定属于氧化还原反应 答案 B 解析可逆反应是在“同一条件下”、能“同时”向正反应和逆反应“两个方向”进行的化学反 应,A 项错误;在同一条件下,同时向正反应和逆反应两个方向进行的反应叫可逆反应,B 项正 确;电解水生成氢气和氧气与氢气和氧气点燃生成水的反应不是可逆反应,因为反应条件不 同,C 项错误;可逆反应不一定属于氧化还原反应,例如二氧化硫与水的反应,D 项错误。 4.将等物质的量的 SO2 和 Cl2 同时作用于湿润的红色布条,则布条的颜色( )。 A.变白 B.不变 C.先褪色后又复原 D.变为无色 答案 B 解析二氧化硫和氯气虽然都能使湿润的红色布条褪色,但等物质的量的二氧化硫和氯气同时 作用于湿润的有色布条时发生反应 SO2+Cl2+2H2O H2SO4+2HCl,不再具有漂白作用,故布 条的颜色保持不变。 5.将 SO2 通入下列各溶液中,均能使溶液褪色,其中利用 SO2 漂白性的是( )。 A.酸性 KMnO4 溶液 B.品红溶液 C.FeCl3 溶液 D.溴水 答案 B 解析 A 项,酸性条件下 MnO4 - 将 SO2 氧化成 SO4 2- ,本身被还原成无色的 Mn2+;B 项,SO2 漂白品 红溶液;C 项,2Fe3++SO2+2H2O SO4 2-+4H++2Fe2+;D 项,SO2+Br2+2H2O H2SO4+2HBr。 6.下列实验报告记录的实验现象正确的是( )

分别加入SO,饱和溶液(至现象明显) 实验 BaCl NaOH和 溶液 BaCl,的 混合液 b 、d A 无色 无色 无现象 无色溶液 记B红色 无色 无色溶液 白色沉淀 录 C红色 无色 白色沉淀 白色沉淀 D无色 无色 无色溶液 无色溶液 答案B 解桐试管:二氧化硫的水溶液呈酸性,使石蕊溶液变红色,但不能漂白石蕊溶液,试管b:二氧 化硫能漂白品红溶液,使品红溶液褪色;试管c:将SO2饱和溶液加入BaCl2溶液中不会产生白 色沉淀;试管d:SO2+2NaOH—NaSO3+HO,NaSO3+BaCl2—BaSO3l+2NaCl。 7.将SO2通入一定量NaOH溶液中,充分反应后,该溶液溶质组成不可能为( A.NaSO3和NaOH B.NaHSO: C.NaHSO3和Na2SO3 D.NaOH和NaHSO3 答案p 解析A项,当SO2与NaOH的物质的量之比小于1:2时,反应后生成NaSO,且NaOH有剩 余,A项不符合题意;B项,当SO2与NaOH的物质的量之比大于1:1时,反应后生成 NaHSO3,B项不特合题意:C项,当SO2与NaOH的物质的量之比介于1:1和1:2时,反应后 生成NaHSO3和NaSO3,C项不符合题意:D项,NaOH与NaHSO3能发生反应生成Na2SO3和 H2OD项符合题意。 8.下列离子方程式正确的是()。 A.向NaOH溶液中通入少量的SO2:SO2+OH一HS03 B.向新制氯水中通入少量的S02:C12+SO2+2H2C一4H+2C+S02 C.将SO2通入饱和NaHCO3溶液中2H+C0?.一HO+CO2 D.将SO2通入BaC2溶液中:SO2+HO+Ba24一BaSO3+2H 答案B 解析A项应为SO2+2OH一S0子+HO;C项应为2HC03+S0一S0好+2C02+H20:D项SO2 与BaCl2不反应。 9.下列关于SO2的叙述正确的是()。 A.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 B.SO2是疏在空气中不完全燃烧的产物,S0是硫在空气中完全燃烧的产物 C.大气中$O2的主要来源是汽车排出的尾气 D.SO2具有漂白性,因而可以使石蕊溶液褪色 答案A 解析二氧化硫中硫元素为+4价,可以是硫元素化合价降低的产物,也可以是硫元素化合价升 高的产物,A项正确:硫燃烧只能生成二氧化硫,不能生成三氧化硫,B项错误,大气中的二氧化 硫主要来自化石燃料的燃烧,C项错误;二氧化硫有漂白性,但不能使石蕊溶液褪色,D项错 误。 10.为了探究铁与硫反应生成的产物中铁的化合价,下面是某同学设计的实验过程的一部分。 操作② 操作③ 操作① Fe、S混惰性气体环境中 黑色加人热的KOH 加入煮沸的 溶液并过滤 稀硫酸 溶液 合粉末 固体 D B 请回答下列问题: (1)混合粉末A中硫粉是过量的,原因是 (2)反应在“惰性气体环境”中进行的原因是 (3)操作②的作用是 也可改用加入
答案 B 解析试管 a:二氧化硫的水溶液呈酸性,使石蕊溶液变红色,但不能漂白石蕊溶液;试管 b:二氧 化硫能漂白品红溶液,使品红溶液褪色;试管 c:将 SO2 饱和溶液加入 BaCl2 溶液中不会产生白 色沉淀;试管 d:SO2+2NaOH Na2SO3+H2O,Na2SO3+BaCl2 BaSO3↓+2NaCl。 7.将 SO2 通入一定量 NaOH 溶液中,充分反应后,该溶液溶质组成不可能为( )。 A.Na2SO3 和 NaOH B.NaHSO3 C.NaHSO3 和 Na2SO3 D.NaOH 和 NaHSO3 答案 D 解析 A 项,当 SO2 与 NaOH 的物质的量之比小于 1∶2 时,反应后生成 Na2SO3,且 NaOH 有剩 余,A 项不符合题意;B 项,当 SO2 与 NaOH 的物质的量之比大于 1∶1 时,反应后生成 NaHSO3,B 项不符合题意;C 项,当 SO2 与 NaOH 的物质的量之比介于 1∶1 和 1∶2 时,反应后 生成 NaHSO3 和 Na2SO3,C 项不符合题意;D 项,NaOH 与 NaHSO3 能发生反应生成 Na2SO3 和 H2O,D 项符合题意。 8.下列离子方程式正确的是( )。 A.向 NaOH 溶液中通入少量的 SO2:SO2+OH- HSO3 - B.向新制氯水中通入少量的 SO2:Cl2+SO2+2H2O 4H++2Cl-+SO4 2- C.将 SO2 通入饱和 NaHCO3 溶液中:2H++CO3 2- H2O+CO2 D.将 SO2 通入 BaCl2 溶液中:SO2+H2O+Ba2+ BaSO3+2H+ 答案 B 解析 A 项应为 SO2+2OH- SO3 2-+H2O;C 项应为 2HCO3 - +SO2 SO3 2-+2CO2+H2O;D 项 SO2 与 BaCl2 不反应。 9.下列关于 SO2 的叙述正确的是( )。 A.SO2 既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 B.SO2 是硫在空气中不完全燃烧的产物,SO3 是硫在空气中完全燃烧的产物 C.大气中 SO2 的主要来源是汽车排出的尾气 D.SO2 具有漂白性,因而可以使石蕊溶液褪色 答案 A 解析二氧化硫中硫元素为+4 价,可以是硫元素化合价降低的产物,也可以是硫元素化合价升 高的产物,A 项正确;硫燃烧只能生成二氧化硫,不能生成三氧化硫,B 项错误;大气中的二氧化 硫主要来自化石燃料的燃烧,C 项错误;二氧化硫有漂白性,但不能使石蕊溶液褪色,D 项错 误。 10.为了探究铁与硫反应生成的产物中铁的化合价,下面是某同学设计的实验过程的一部分。 Fe、S 混 合粉末 A 黑色 固体 B 滤渣 C 溶液 D 请回答下列问题: (1)混合粉末 A 中硫粉是过量的,原因是 。 (2)反应在“惰性气体环境”中进行的原因是 。 (3)操作②的作用是 ,也可改用加入
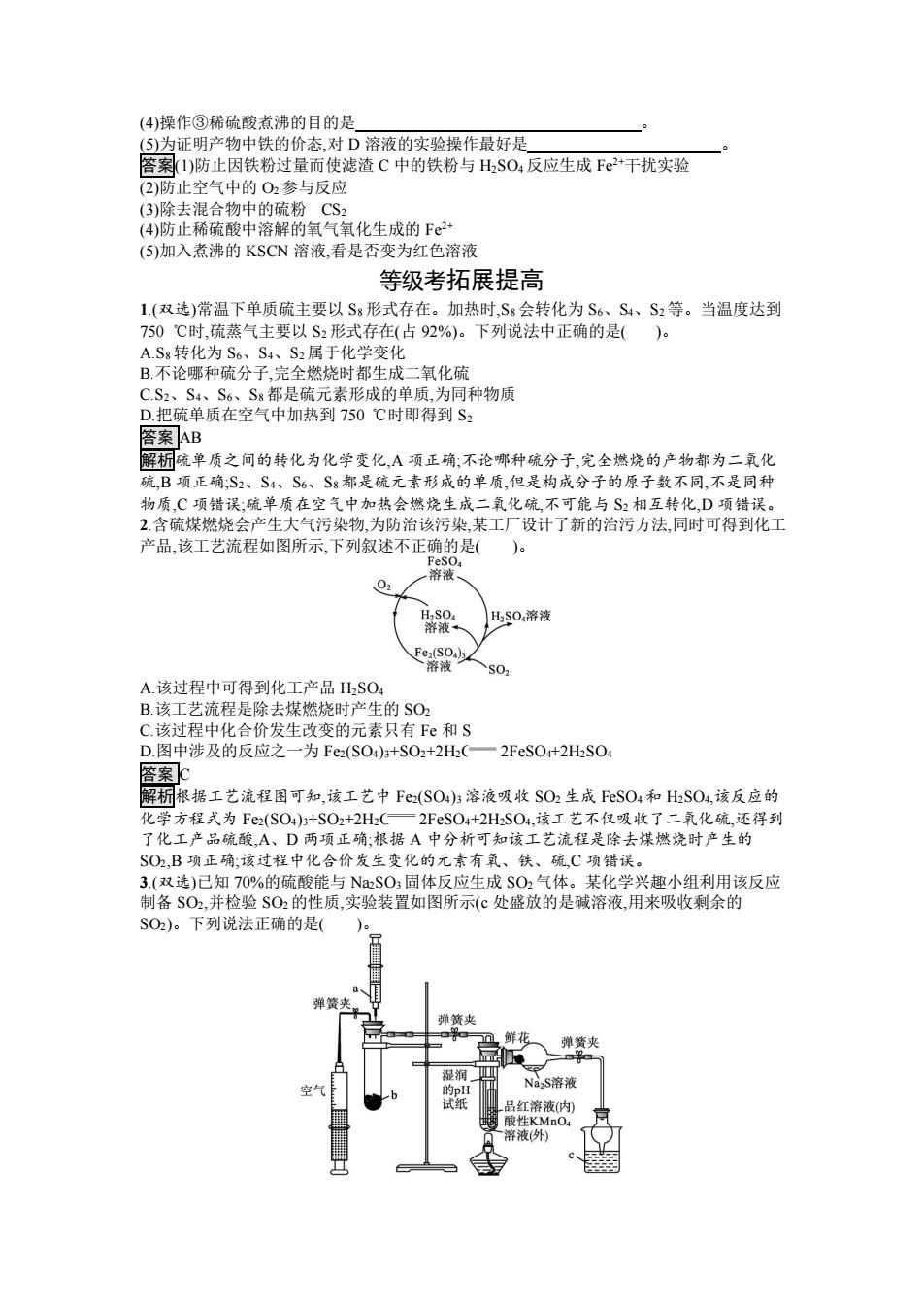
(4)操作③稀硫酸煮沸的目的是 (⑤)为证明产物中铁的价态,对D溶液的实验操作最好是 答案(1)防止因铁粉过量而使滤渣C中的铁粉与HSO4反应生成Fe2+干扰实验 (2)防止空气中的O2参与反应 (3)除去混合物中的硫粉CS2 (4)防止稀硫酸中溶解的氧气氧化生成的F2 (5)加入煮沸的KSCN溶液,看是否变为红色溶液 等级考拓展提高 1.(双选)常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温度达到 750℃时,硫蒸气主要以S2形式存在(占92%)。下列说法中正确的是()。 A.S8转化为S6、S4、S2属于化学变化 B.不论哪种硫分子,完全燃烧时都生成二氧化硫 C.S2、S4、S6、S8都是硫元素形成的单质,为同种物质 D.把硫单质在空气中加热到750℃时即得到S2 答案AB 解析硫单质之间的转化为化学变化,A项正确,不论哪种硫分子,完全燃烧的产物都为二氧化 硫,B项正确:S2、S4、S6、S8都是硫元素形成的单质,但是构成分子的原子数不同,不是同种 物质,C项错误;硫单质在空气中加热会燃烧生成二氧化硫,不可能与S2相互转化,D项错误。 2.含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工 产品,该工艺流程如图所示,下列叙述不正确的是( )a FeSO4 溶液 02 H2SO,溶液 溶液。 Fe2(SO4)3 溶液 S02 A.该过程中可得到化工产品HSO4 B.该工艺流程是除去煤燃烧时产生的SO2 C.该过程中化合价发生改变的元素只有Fe和S D.图中涉及的反应之一为Fe2(SO4)3+SO2+2H(一2FeSO4+2HSO4 窨案c 解析根据工艺流程图可知,该工艺中Fez(SO4)3溶液吸收SO2生成FSO4和HSO4,该反应的 化学方程式为Fe2(SO4)3+SO2+2H2C一2FSO4+2HSO4,该工艺不仅吸收了二氧化硫,还得到 了化工产品硫酸,A、D两项正确:根据A中分析可知该工艺流程是除去煤燃烧时产生的 SO2,B项正确:该过程中化合价发生变化的元素有氧、铁、硫,C项错误。 3.(双选)已知70%的硫酸能与NSO3固体反应生成SO2气体。某化学兴趣小组利用该反应 制备SO2,并检验SO2的性质,实验装置如图所示(℃处盛放的是碱溶液,用来吸收剩余的 SO2)。下列说法正确的是( 弹簧夹 弹簧夹 鲜花 弹簧夹 湿润」 Na2S溶液 的pH 试纸 品红溶液(内) 酸性KMnO4 溶液(外)
(4)操作③稀硫酸煮沸的目的是 。 (5)为证明产物中铁的价态,对 D 溶液的实验操作最好是 。 答案(1)防止因铁粉过量而使滤渣 C 中的铁粉与 H2SO4 反应生成 Fe2+干扰实验 (2)防止空气中的 O2 参与反应 (3)除去混合物中的硫粉 CS2 (4)防止稀硫酸中溶解的氧气氧化生成的 Fe2+ (5)加入煮沸的 KSCN 溶液,看是否变为红色溶液 等级考拓展提高 1.(双选)常温下单质硫主要以 S8 形式存在。加热时,S8 会转化为 S6、S4、S2 等。当温度达到 750 ℃时,硫蒸气主要以 S2 形式存在(占 92%)。下列说法中正确的是( )。 A.S8 转化为 S6、S4、S2 属于化学变化 B.不论哪种硫分子,完全燃烧时都生成二氧化硫 C.S2、S4、S6、S8 都是硫元素形成的单质,为同种物质 D.把硫单质在空气中加热到 750 ℃时即得到 S2 答案 AB 解析硫单质之间的转化为化学变化,A 项正确;不论哪种硫分子,完全燃烧的产物都为二氧化 硫,B 项正确;S2、S4、S6、S8 都是硫元素形成的单质,但是构成分子的原子数不同,不是同种 物质,C 项错误;硫单质在空气中加热会燃烧生成二氧化硫,不可能与 S2 相互转化,D 项错误。 2.含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工 产品,该工艺流程如图所示,下列叙述不正确的是( )。 A.该过程中可得到化工产品 H2SO4 B.该工艺流程是除去煤燃烧时产生的 SO2 C.该过程中化合价发生改变的元素只有 Fe 和 S D.图中涉及的反应之一为 Fe2(SO4)3+SO2+2H2O 2FeSO4+2H2SO4 答案 C 解析根据工艺流程图可知,该工艺中 Fe2(SO4)3 溶液吸收 SO2 生成 FeSO4 和 H2SO4,该反应的 化学方程式为 Fe2(SO4)3+SO2+2H2O 2FeSO4+2H2SO4,该工艺不仅吸收了二氧化硫,还得到 了化工产品硫酸,A、D 两项正确;根据 A 中分析可知该工艺流程是除去煤燃烧时产生的 SO2,B 项正确;该过程中化合价发生变化的元素有氧、铁、硫,C 项错误。 3.(双选)已知 70%的硫酸能与 Na2SO3 固体反应生成 SO2 气体。某化学兴趣小组利用该反应 制备 SO2,并检验 SO2 的性质,实验装置如图所示(c 处盛放的是碱溶液,用来吸收剩余的 SO2)。下列说法正确的是( )

A.a、b、c中依次盛装的一定是70%的硫酸、NaSO3固体、澄清石灰水 B.实验时,湿润的pH试纸、鲜花、品红溶液、酸性KMnO4溶液均褪色,NaS溶液出现淡黄 色沉淀 C.此设计可证明SO2水溶液的酸性,SO2的氧化性、还原性、漂白性 D.点燃酒精灯加热,可证明SO2使品红溶液褪色具有可逆性,使酸性KMO4溶液褪色不具有 可逆性 答案CD 解析A项,70%的硫酸与亚硫酸钠反应生成二氧化硫,多余的二氧化硫气体最后用碱溶液吸 收,但是澄清石灰水的溶解度比较小,一般不用其吸收二氧化硫,可以选用NOH溶液,故错 误;B项,二氧化硫不能漂白pH试纸,二氧化硫与水反应生成亚硫酸,使湿润的pH试纸显红 色,所以湿润的pH试纸不褪色,故错误;C项,SO2水溶液使pH试纸变红说明其水溶液具有酸 性,二氧化硫能使鲜花、品红溶液褪色说明有漂白性,使酸性高锰酸钾溶液褪色说明有还原 性,与N2S反应生成S说明有氧化性,故正确;D项,点燃酒精灯加热,可证明SO2使品红溶液 褪色具有可逆性,使酸性KMO4溶液褪色不具有可逆性,故正确。 4.如图所示是一种综合处理$O2废气的工艺流程,若每步都完全反应,下列说法正确的是 含S0,的尾气 空气 酸性Fez(SO)3溶液 溶液B 溶液c A.溶液B中发生的反应为2S02+0.一2SO3 B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+ C.由以上流程可推知氧化性:Fe3+>O2>S0? D.此工艺的优点之一是物质能循环利用 答案D 解析酸性Fe2(SO4)3溶液能吸收SO2,反应的离子方程式为2Fe3+SO2+2H(一 2Fe2++S02-+4H.溶液B中通入空气发生反应4Fe2++O2+4H一4Fe3++2H2O.氧化 性:O2>Fe3t>S0子,A、C两项错误;溶液C中含有Fe2(SO4)3,可用KSCN溶液检验Fe3+,B项错 误;Fe2(SO4)3可循环利用,D项正确。 挑战创新 某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分,该小组成员将气 体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清。 (1)由此该小组成员对气体的成分提出猜想。 猜想1:该气体为C02 猜想2:该气体为 猜想3:该气体为 (2)为了验证猜想,该小组成员设计实验加以探究。该小组同学按如图所示装置,将气体从 端通入。 气体一 品红溶液 品红溶液澄清石灰水 A B D ①B中应该加入 (填字母)。 A.NaCl溶液 B.酸性KMnO4溶液 C盐酸 D.澄清石灰水 ②A中品红溶液的作用是 ③D中澄清石灰水的作用是
A.a、b、c 中依次盛装的一定是 70%的硫酸、Na2SO3 固体、澄清石灰水 B.实验时,湿润的 pH 试纸、鲜花、品红溶液、酸性 KMnO4 溶液均褪色,Na2S 溶液出现淡黄 色沉淀 C.此设计可证明 SO2 水溶液的酸性,SO2 的氧化性、还原性、漂白性 D.点燃酒精灯加热,可证明 SO2 使品红溶液褪色具有可逆性,使酸性 KMnO4 溶液褪色不具有 可逆性 答案 CD 解析 A 项,70%的硫酸与亚硫酸钠反应生成二氧化硫,多余的二氧化硫气体最后用碱溶液吸 收,但是澄清石灰水的溶解度比较小,一般不用其吸收二氧化硫,可以选用 NaOH 溶液,故错 误;B 项,二氧化硫不能漂白 pH 试纸,二氧化硫与水反应生成亚硫酸,使湿润的 pH 试纸显红 色,所以湿润的 pH 试纸不褪色,故错误;C 项,SO2 水溶液使 pH 试纸变红说明其水溶液具有酸 性,二氧化硫能使鲜花、品红溶液褪色说明有漂白性,使酸性高锰酸钾溶液褪色说明有还原 性,与 Na2S 反应生成 S 说明有氧化性,故正确;D 项,点燃酒精灯加热,可证明 SO2 使品红溶液 褪色具有可逆性,使酸性 KMnO4 溶液褪色不具有可逆性,故正确。 4.如图所示是一种综合处理 SO2 废气的工艺流程,若每步都完全反应,下列说法正确的是 ( )。 A.溶液 B 中发生的反应为 2SO2+O2 2SO3 B.可用酸性高锰酸钾溶液检验溶液 C 中是否含有 Fe3+ C.由以上流程可推知氧化性:Fe3+>O2>SO4 2- D.此工艺的优点之一是物质能循环利用 答案 D 解析酸性 Fe2(SO4)3 溶液能吸收 SO2,反应的离子方程式为 2Fe3++SO2+2H2O 2Fe2++SO4 2-+4H+ ,溶液 B 中通入空气发生反应 4Fe2++O2+4H+ 4Fe3++2H2O,氧化 性:O2>Fe3+>SO4 2- ,A、C 两项错误;溶液 C 中含有 Fe2(SO4)3,可用 KSCN 溶液检验 Fe3+,B 项错 误;Fe2(SO4)3 可循环利用,D 项正确。 挑战创新 某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分,该小组成员将气 体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清。 (1)由此该小组成员对气体的成分提出猜想。 猜想 1:该气体为 CO2; 猜想 2:该气体为 ; 猜想 3:该气体为 。 (2)为了验证猜想,该小组成员设计实验加以探究。该小组同学按如图所示装置,将气体从 a 端通入。 ①B 中应该加入 (填字母)。 A.NaCl 溶液 B.酸性 KMnO4 溶液 C.盐酸 D.澄清石灰水 ②A 中品红溶液的作用是 。 ③D 中澄清石灰水的作用是

通过该实验,该小组同学观察到以下三个实验现象: aA中品红溶液褪色 b.C中品红溶液不褪色 c.D中澄清石灰水变浑浊 ④由上述现象该小组同学确认该气体的成分为 答1)S02C02和SO2 (2)①B②验证气体中是否含有SO2③验证气体中是否含有CO2④CO2和SO2 解析SO2和CO2均为酸性氧化物,并且均能使澄清石灰水变浑浊,分别生成CSO3沉淀和 CaCO3沉淀。SO2还有还原性,能被新制氯水、酸性KMO4溶液氧化而使溶液褪色:还有漂 白性能使品红溶液褪色等
通过该实验,该小组同学观察到以下三个实验现象: a.A 中品红溶液褪色 b.C 中品红溶液不褪色 c.D 中澄清石灰水变浑浊 ④由上述现象该小组同学确认该气体的成分为 。 答案(1)SO2 CO2 和 SO2 (2)①B ②验证气体中是否含有 SO2 ③验证气体中是否含有 CO2 ④CO2 和 SO2 解析 SO2 和 CO2 均为酸性氧化物,并且均能使澄清石灰水变浑浊,分别生成 CaSO3 沉淀和 CaCO3 沉淀。SO2 还有还原性,能被新制氯水、酸性 KMnO4 溶液氧化而使溶液褪色;还有漂 白性,能使品红溶液褪色等