
志鸿优化系列丛书 志鸿优化网,永远提供更新的: 丛书主编任志湖。 http://www.zhyh.org 第四节 配合物与超分子 课后·训练提升 基础巩固 1.下列有关配位键的分析正确的是( A.是离子键 B.是极性键 C是非极性键 D.是π键 答案B 解析配位键是成键原子通过共用电子对形成的,属于共价键;配位键存在于不同原子之间且为单键, 故属于极性键,属于G键。 2.下列各种说法中错误的是()。 A配位键是一种特殊的共价键 B.NH4NO3、HSO4都含有配位键 C.共价键的形成条件是成键原子必须有未成对电子 D.形成配位键的条件是一方有空轨道,另一方有孤电子对 答案c 解析配位键是成键的两个原子一方提供孤电子对,另一方提供空轨道而形成的共价键,可见成键双方 都不存在未成对电子,C项错误。 3.下列关于配位化合物的叙述中,不正确的是( A.配位化合物中必定存在配位键 B.配位化合物中只有配位键 C.[Cu(HO)4]2+中的Cu2+提供空轨道,H0中的氧原子提供孤电子对形成配位键 D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用 答案B 解析含有配位键的化合物就是配位化合物,但配位化合物还会含有普通共价键、离子键等,B项错 误。 4.某物质的结构如图所示,下列有关该物质的分析中正确的是( )。 CH -0 1
1 第四节 配合物与超分子 课后· 基础巩固 1.下列有关配位键的分析正确的是( )。 A.是离子键 B.是极性键 C.是非极性键 D.是 π 键 答案:B 解析:配位键是成键原子通过共用电子对形成的,属于共价键;配位键存在于不同原子之间且为单键, 故属于极性键,属于 σ 键。 2.下列各种说法中错误的是( )。 A.配位键是一种特殊的共价键 B.NH4NO3、H2SO4 都含有配位键 C.共价键的形成条件是成键原子必须有未成对电子 D.形成配位键的条件是一方有空轨道,另一方有孤电子对 答案:C 解析:配位键是成键的两个原子一方提供孤电子对,另一方提供空轨道而形成的共价键,可见成键双方 都不存在未成对电子,C 项错误。 3.下列关于配位化合物的叙述中,不正确的是( )。 A.配位化合物中必定存在配位键 B.配位化合物中只有配位键 C.[Cu(H2O)4] 2+中的 Cu2+提供空轨道,H2O 中的氧原子提供孤电子对形成配位键 D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用 答案:B 解析:含有配位键的化合物就是配位化合物,但配位化合物还会含有普通共价键、离子键等,B 项错 误。 4.某物质的结构如图所示,下列有关该物质的分析中正确的是( )

志鸿优化系列丛书 志鸿优化网永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org A.该物质分子中不存在σ键 B.该物质的分子内存在氢键这种化学键 C.该物质是一种配合物,其中Ni为中心原子 D.该物质的分子中C、N、O均存在孤电子对 含案c 解析单键和双键中均存在σ键,所以该物质中存在。键,A项错误。由结构图可知,该物质中存在分 子内氢键,但氢键不属于化学键,B项错误。分子中N提供空轨道,N提供孤电子对,所以N为中心原 子,N为配位原子,C项正确。分子中C原子形成四个共价键,没有孤电子对,N、O存在孤电子对,D 项错误。 5.下列配合物的配位数不是6的是()。 A.K3[Fe(SCN)6] B.Naz[SiF6] C.Nas[AIF6] D.[Cu(NH3)4]Cl2 答案p 解析[CuNH)A]Ch中配合物的配位数为4,配体为NH。 6.关于化学式为[TiCI(HO)5]CH0的配合物的下列说法正确的是( A配体是C和HO,配位数是8 B.中心离子是Ti4+,配离子是[TiCI(H2O)5]2+ C.内界和外界中CI的数目比是1:2 D.向1mol该配合物溶液中加入足量AgNO溶液,可以得到3 mol AgCl沉淀 含案 解析配合物[TiCI(H,O)C2H0,配体是C和H,0,配位数是6,A项错误。中心离子是T+,B项错 误。配合物[TiC1(HO)]C2H0中内界C的个数为1,外界CI的个数为2,内界和外界中CI的数目 比是1:2,C项正确。加入足量AgNO溶液,外界CI与Ag*反应,内界CI不与Ag反应,故只能生成2 mol AgCl沉淀,D项错误。 7.NH和BF3可以通过配位键形成化合物NHBF3,下列说法正确的是()。 A.NH、BF3两分子都是平面三角形分子 B.NH、BF3两分子的中心原子采取的都是sp杂化 C.形成配合物时NH中N原子提供的是孤电子对,BF3中B原子提供空轨道 D.形成配合物时BF3中B原子提供的是孤电子对,NH:中N原子提供空轨道 客案c 2
2 A.该物质分子中不存在 σ 键 B.该物质的分子内存在氢键这种化学键 C.该物质是一种配合物,其中 Ni 为中心原子 D.该物质的分子中 C、N、O 均存在孤电子对 答案:C 解析:单键和双键中均存在 σ 键,所以该物质中存在 σ 键, A 项错误。由结构图可知,该物质中存在分 子内氢键,但氢键不属于化学键, B 项错误。分子中 Ni 提供空轨道,N 提供孤电子对,所以 Ni 为中心原 子,N 为配位原子, C 项正确。分子中 C 原子形成四个共价键,没有孤电子对,N、O 存在孤电子对, D 项错误。 5.下列配合物的配位数不是 6 的是( )。 A.K3[Fe(SCN)6] B.Na2[SiF6] C.Na3[AlF6] D.[Cu(NH3)4]Cl2 答案:D 解析: [Cu(NH3)4]Cl2 中配合物的配位数为 4,配体为 NH3。 6.关于化学式为[TiCl(H2O)5]Cl2·H2O 的配合物的下列说法正确的是( )。 A.配体是 Cl-和 H2O,配位数是 8 B.中心离子是 Ti4+ ,配离子是[TiCl(H2O)5] 2+ C.内界和外界中 Cl-的数目比是 1∶2 D.向 1 mol 该配合物溶液中加入足量 AgNO3 溶液,可以得到 3 mol AgCl 沉淀 答案:C 解析:配合物[TiCl(H2O)5]Cl2·H2O,配体是 Cl-和 H2O,配位数是 6,A 项错误。中心离子是 Ti3+,B 项错 误。配合物[TiCl(H2O)5]Cl2·H2O 中内界 Cl-的个数为 1,外界 Cl-的个数为 2,内界和外界中 Cl-的数目 比是 1∶2,C 项正确。加入足量 AgNO3 溶液,外界 Cl-与 Ag+反应,内界 Cl-不与 Ag+反应,故只能生成 2 mol AgCl 沉淀,D 项错误。 7. NH3 和 BF3 可以通过配位键形成化合物 NH3BF3,下列说法正确的是( )。 A.NH3、BF3 两分子都是平面三角形分子 B.NH3、BF3 两分子的中心原子采取的都是 sp3 杂化 C.形成配合物时 NH3 中 N 原子提供的是孤电子对,BF3 中 B 原子提供空轨道 D.形成配合物时 BF3 中 B 原子提供的是孤电子对,NH3 中 N 原子提供空轨道 答案:C

志鸿优化系列丛书 志鸿优化网,永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org 解析NH是三角锥形分子,A项错误。NH中N的杂化轨道数=o键电子对数+孤电子对数=3+1=4,N 采取的是sp3杂化;BF3中B形成3个σ键B上无孤电子对,B的杂化轨道数=o键电子对数+孤电子对 数=3+0=3,B采取的是sp2杂化,B项错误。NHBF3中B有空轨道,N有孤电子对,所以N提供孤电子 对,B提供空轨道,形成配位键,C项正确,D项错误。 8.某物质的实验式为PtC142NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,以强碱处理并没有 NH放出,则关于此化合物的说法中正确的是()。 A配合物中中心离子的电荷数和配位数均为6 B.该配合物可能是平面正方形结构 C.CI和NH分子均与Pt+配位 D.配合物中CI与P配位,而NH分子不配位 答案c 解析在PtCL42NH水溶液中加入AgNO3溶液无沉淀生成,经强碱处理无NH放出,说明C、NH均 是配体故该配合物中中心离子的配位数为6,电荷数为4,A、D项错误,C项正确。因为配体在中心 离子周围配位时采取对称分布以达到能量上的稳定状态,P+配位数为6,则其空间构型为八面体形,B 项错误。 9.Fe为过渡金属元素,在工业生产中具有重要的用途。己知NO能被FeSO4溶液吸收生成配合物 [F(NO)HO)m]SO4,该配合物的中心离子的最外层电子数与配体提供的电子总数之和为26。下列有 关说法正确的是()。 A.该配合物的化学式为Fe(NO)HO)5]SO4 B.该配合物中所含非金属元素均位于元素周期表p区 C.1mol该配合物与足量Ba(OH2溶液反应可生成2mol沉淀 D.该配合物中阳离子呈正八面体结构,阴离子呈正四面体结构 含案A 解析该配合物中Fe显+2价,Fe2+最外层电子排布为3s23p3d6,即最外层电子数为14,则配体提供的电 子总数为12,每个NO和H0均可提供2个电子,故n=5,该配合物的化学式为FC(NO)(HO)5]SO4,A 项正确。氢元素位于元素周期表s区,B项错误。该配合物中只有S0?能与Ba+反应生成沉淀,C项 错误。该配合物阳离子为[F©(NO)H2O)5]2+,由其配体组成可知,其不可能是正八面体结构,D项错误。 10.超分子化学己逐渐扩展到化学的各个分支,还扩展到生命科学和物理学等领域。由Mo将2个C60 分子、2个p-甲酸丁酯吡啶及2个C0分子利用配位键自组装的超分子结构如图所示。 3
3 解析:NH3 是三角锥形分子,A 项错误。NH3 中 N 的杂化轨道数=σ 键电子对数+孤电子对数=3+1=4,N 采取的是 sp3 杂化;BF3 中 B 形成 3 个 σ 键,B 上无孤电子对,B 的杂化轨道数=σ 键电子对数+孤电子对 数=3+0=3,B 采取的是 sp2 杂化,B 项错误。NH3BF3 中 B 有空轨道,N 有孤电子对,所以 N 提供孤电子 对,B 提供空轨道,形成配位键,C 项正确,D 项错误。 8.某物质的实验式为 PtCl4·2NH3,其水溶液不导电,加入 AgNO3 溶液也不产生沉淀,以强碱处理并没有 NH3 放出,则关于此化合物的说法中正确的是( )。 A.配合物中中心离子的电荷数和配位数均为 6 B.该配合物可能是平面正方形结构 C.Cl-和 NH3 分子均与 Pt4+配位 D.配合物中 Cl-与 Pt4+配位,而 NH3 分子不配位 答案:C 解析:在 PtCl4·2NH3 水溶液中加入 AgNO3 溶液无沉淀生成,经强碱处理无 NH3 放出,说明 Cl-、NH3均 是配体,故该配合物中中心离子的配位数为 6,电荷数为 4,A、D 项错误,C 项正确。因为配体在中心 离子周围配位时采取对称分布以达到能量上的稳定状态,Pt4+配位数为 6,则其空间构型为八面体形,B 项错误。 9.Fe 为过渡金属元素,在工业生产中具有重要的用途。已知 NO 能被 FeSO4 溶液吸收生成配合物 [Fe(NO)(H2O)n]SO4,该配合物的中心离子的最外层电子数与配体提供的电子总数之和为 26。下列有 关说法正确的是( )。 A.该配合物的化学式为[Fe(NO)(H2O)5]SO4 B.该配合物中所含非金属元素均位于元素周期表 p 区 C.1 mol 该配合物与足量 Ba(OH)2 溶液反应可生成 2 mol 沉淀 D.该配合物中阳离子呈正八面体结构,阴离子呈正四面体结构 答案:A 解析:该配合物中 Fe 显+2 价,Fe2+最外层电子排布为 3s23p63d6 ,即最外层电子数为 14,则配体提供的电 子总数为 12,每个 NO 和 H2O 均可提供 2 个电子,故 n=5,该配合物的化学式为[Fe(NO)(H2O)5]SO4,A 项正确。氢元素位于元素周期表 s 区,B 项错误。该配合物中只有 SO4 2-能与 Ba2+反应生成沉淀,C 项 错误。该配合物阳离子为[Fe(NO)(H2O)5] 2+ ,由其配体组成可知,其不可能是正八面体结构,D 项错误。 10.超分子化学已逐渐扩展到化学的各个分支,还扩展到生命科学和物理学等领域。由 Mo 将 2 个 C60 分子、2 个 p-甲酸丁酯吡啶及 2 个 CO 分子利用配位键自组装的超分子结构如图所示

志鸿优化系列丛书 志鸿优化网,永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org Mo o c C-0CH N (1)Mo处于第五周期第ⅥB族,核外电子排布与Cr相似,它的基态原子的价层电子排布式是 核 外未成对电子数是个。 (2)该超分子中存在的化学键类型有 A.o键 B.π键 C离子键 D.氢键 (3)该超分子中配体C0提供孤电子对的原子是(填元素符号),P-甲酸丁酯吡啶配体中碳原子的 杂化方式有 (4)从电负性角度解释CF3COOH的酸性强于CH;COOH的原 因: (5)C60与C70互为同素异形体,分离混合物的实验操作 是 客案1)4d55s6 (2)AB (3)Csp3、sp2 (4)F的电负性强于H,对电子的吸引能力强,导致共用电子对偏向F,则O一H较易断裂,所以酸性强于 乙酸 (5)将C60与C70的混合物加入一种空腔大小与C60适配的“杯酚”中,然后加入甲苯溶剂,甲苯将未装入 杯酚的C0溶解,过滤后分离C0;再向不溶物中加入氯仿,氯仿溶解“杯酚”而将不溶解的C60释放出来 并沉淀 解析1)Mo处于第五周期第ⅥB族,核外电子排布与Cr相似,其价电子为4d、5s电子,4d能级上有5 个电子、5s能级上有1个电子,据此书写它的基态原子的价层电子排布式:核外未成对电子是4d、5s 能级上的电子。 (2)该分子中只存在共价键,共价单键为。键、共价双键中含有。键和π键
4 (1)Mo 处于第五周期第ⅥB 族,核外电子排布与 Cr 相似,它的基态原子的价层电子排布式是 ;核 外未成对电子数是 个。 (2)该超分子中存在的化学键类型有 。 A.σ 键 B.π 键 C.离子键 D.氢键 (3)该超分子中配体 CO 提供孤电子对的原子是 (填元素符号),p-甲酸丁酯吡啶配体中碳原子的 杂化方式有 。 (4)从电负性角度解释 CF3COOH 的酸性强于 CH3COOH 的原 因: 。 (5)C60 与 C70 互为同素异形体,分离混合物的实验操作 是 。 答案:(1)4d55s1 6 (2)AB (3)C sp3、sp2 (4)F 的电负性强于 H,对电子的吸引能力强,导致共用电子对偏向 F,则 O—H 较易断裂,所以酸性强于 乙酸 (5)将 C60 与 C70 的混合物加入一种空腔大小与 C60 适配的“杯酚”中,然后加入甲苯溶剂,甲苯将未装入 杯酚的 C70 溶解,过滤后分离 C70;再向不溶物中加入氯仿,氯仿溶解“杯酚”而将不溶解的 C60 释放出来 并沉淀 解析:(1)Mo 处于第五周期第ⅥB 族,核外电子排布与 Cr 相似,其价电子为 4d、5s 电子,4d 能级上有 5 个电子、5s 能级上有 1 个电子,据此书写它的基态原子的价层电子排布式;核外未成对电子是 4d、5s 能级上的电子。 (2)该分子中只存在共价键,共价单键为 σ 键、共价双键中含有 σ 键 和 π 键
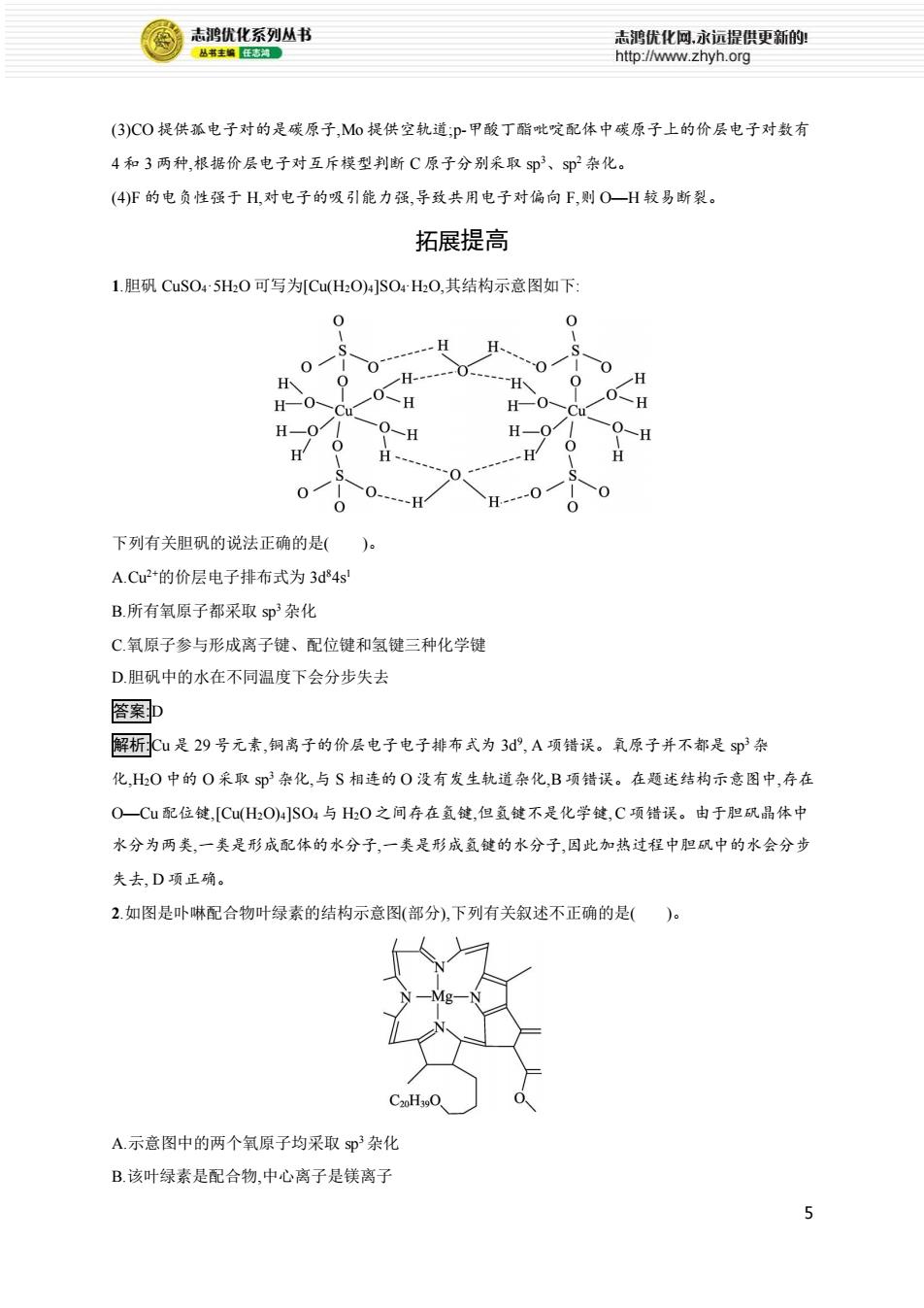
志鸿优化系列丛书 志鸿优化网永远提供更新的! 丛书主编任志河。 http://www.zhyh.org (3)C0提供孤电子对的是碳原子,M0提供空轨道;p-甲酸丁酯吡啶配体中碳原子上的价层电子对数有 4和3两种,根据价层电子对互斥模型判断C原子分别采取s即3、sp杂化。 (4)F的电负性强于H,对电子的吸引能力强,导致共用电子对偏向F,则O一H较易断裂。 拓展提高 1.胆矾CuSO45H0可写为[Cu(HO)4]SO4HO,其结构示意图如下: 0 下列有关胆矾的说法正确的是()。 A.Cu2+的价层电子排布式为3d84s B.所有氧原子都采取sp杂化 C氧原子参与形成离子键、配位键和氢键三种化学键 D.胆矾中的水在不同温度下会分步失去 答案p 解析Cu是29号元素,铜离子的价层电子电子排布式为3d,A项错误。氧原子并不都是sp杂 化,H0中的O采取sp3杂化,与S相连的O没有发生轨道杂化,B项错误。在题述结构示意图中,存在 O一Cu配位键,[Cu(HO)4]SO4与HO之间存在氢键,但氢键不是化学键,C项错误。由于胆矾晶体中 水分为两类,一类是形成配体的水分子,一类是形成氢键的水分子,因此加热过程中胆矾中的水会分步 失去,D项正确。 2.如图是卟啉配合物叶绿素的结构示意图(部分),下列有关叙述不正确的是()。 C20H390 A.示意图中的两个氧原子均采取sp3杂化 B.该叶绿素是配合物,中心离子是镁离子 5
5 (3)CO 提供孤电子对的是碳原子,Mo 提供空轨道;p-甲酸丁酯吡啶配体中碳原子上的价层电子对数有 4 和 3 两种,根据价层电子对互斥模型判断 C 原子分别采取 sp3、sp2 杂化。 (4)F 的电负性强于 H,对电子的吸引能力强,导致共用电子对偏向 F,则 O—H 较易断裂。 拓展提高 1.胆矾 CuSO4·5H2O 可写为[Cu(H2O)4]SO4·H2O,其结构示意图如下: 下列有关胆矾的说法正确的是( )。 A.Cu2+的价层电子排布式为 3d84s1 B.所有氧原子都采取 sp3 杂化 C.氧原子参与形成离子键、配位键和氢键三种化学键 D.胆矾中的水在不同温度下会分步失去 答案:D 解析:Cu 是 29 号元素,铜离子的价层电子电子排布式为 3d9 , A 项错误。氧原子并不都是 sp3 杂 化,H2O 中的 O 采取 sp3 杂化,与 S 相连的 O 没有发生轨道杂化,B 项错误。在题述结构示意图中,存在 O—Cu 配位键,[Cu(H2O)4]SO4 与 H2O 之间存在氢键,但氢键不是化学键, C 项错误。由于胆矾晶体中 水分为两类,一类是形成配体的水分子,一类是形成氢键的水分子,因此加热过程中胆矾中的水会分步 失去, D 项正确。 2.如图是卟啉配合物叶绿素的结构示意图(部分),下列有关叙述不正确的是( )。 A.示意图中的两个氧原子均采取 sp3 杂化 B.该叶绿素是配合物,中心离子是镁离子

志鸿优化系列丛书 志鸿优化网,永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org C该叶绿素是配合物,N提供孤电子对 D.该叶绿素不是配合物,而是高分子化合物 答案D 解析由示意图知,两个氧原子均形成了两个。键,故均为Sp杂化,A项正确。Mg的最高化合价为+2 价,而化合物中Mg与4个氨原子形成化学键,由此可以判断该化合物中Mg与N间存在配位键,N提 供孤电子对,该物质为配合物,B、C项正确。高分子化合物的相对分子质量通常很大,D项错误。 3.己知某紫色配合物的组成为CoC135NHHO,其水溶液显弱酸性,加入强碱加热至沸腾有NH放 出,同时产生Co2O3沉淀;向一定量该配合物溶液中加过量AgNO3溶液,有AgC1沉淀生成,待沉淀完全 后过滤,再向滤液中加过量AgNO,溶液,无明显变化,但加热至沸腾又有AgC沉淀生成,且第二次沉 淀量为第一次沉淀量的。则该配合物的化学式最可能为 ()。 A.[CoCl2(NH3)4]CI-NH3H2O B.[Co(NH3)s(H2O)]Cl3 C.[CoCl(NH3)3(H2O)]CI22NH3 D.[CoCl(NH3)s]Cl2-H2O 答案D 解析CoCl5NHHO的水溶液显弱酸性,加入强碱加热至沸腾有NH放出,说明NH均在内界,向该 配合物溶液中加过量AgNO3溶液,有AgCI沉淀生成,说明该配合物外界有CI,过滤后再向滤液中加 入过量AgNO,溶液,无明显变化,但加热至沸腾又有AgC沉淀生成,且第二次沉淀量为第一次沉淀量 的与说明该配合物内界也含有C,且外界的C与内界的C个数之比为2:1。综上分析,D项最有可 能。 4.向疏酸铜溶液中逐滴滴加浓氨水,先出现现象a,继续滴加浓氨水,现象a逐渐消失,得到一种含二价 阳离子的深蓝色透明溶液,继续加入乙醇,析出深蓝色的晶体[Cu(NH)4]SO4O。这种二价阳离子的 空间结构如图所示(4个NH与Cu2+共面,跟O-Cu2+H0轴线垂直)。请回答以下问题。 H20 HaN NH Cu2+ H:N ->NHg H20 (1)基态Cu原子的价层电子的轨道表示式为 (2)硫酸铜水溶液滴加浓氨水的变化过程,现象a是 ,写出生成深蓝色透明溶液 的离子方程式: 6
6 C.该叶绿素是配合物,N 提供孤电子对 D.该叶绿素不是配合物,而是高分子化合物 答案:D 解析:由示意图知,两个氧原子均形成了两个 σ 键,故均为 sp3 杂化,A 项正确。Mg 的最高化合价为+2 价,而化合物中 Mg 与 4 个氮原子形成化学键,由此可以判断该化合物中 Mg 与 N 间存在配位键,N 提 供孤电子对,该物质为配合物,B、C 项正确。高分子化合物的相对分子质量通常很大,D 项错误。 3.已知某紫色配合物的组成为 CoCl3·5NH3·H2O,其水溶液显弱酸性,加入强碱加热至沸腾有 NH3 放 出,同时产生 Co2O3 沉淀;向一定量该配合物溶液中加过量 AgNO3 溶液,有 AgCl 沉淀生成,待沉淀完全 后过滤,再向滤液中加过量 AgNO3 溶液,无明显变化,但加热至沸腾又有 AgCl 沉淀生成,且第二次沉 淀量为第一次沉淀量的1 2。则该配合物的化学式最可能为( )。 A.[CoCl2(NH3)4]Cl·NH3·H2O B.[Co(NH3)5(H2O)]Cl3 C.[CoCl(NH3)3(H2O)]Cl2·2NH3 D.[CoCl(NH3)5]Cl2·H2O 答案:D 解析:CoCl3·5NH3·H2O 的水溶液显弱酸性,加入强碱加热至沸腾有 NH3 放出,说明 NH3 均在内界,向该 配合物溶液中加过量 AgNO3 溶液,有 AgCl 沉淀生成,说明该配合物外界有 Cl- ,过滤后再向滤液中加 入过量 AgNO3 溶液,无明显变化,但加热至沸腾又有 AgCl 沉淀生成,且第二次沉淀量为第一次沉淀量 的 1 2 ,说明该配合物内界也含有 Cl- ,且外界的 Cl-与内界的 Cl-个数之比为 2∶1。综上分析,D 项最有可 能。 4.向硫酸铜溶液中逐滴滴加浓氨水,先出现现象 a,继续滴加浓氨水,现象 a 逐渐消失,得到一种含二价 阳离子的深蓝色透明溶液,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。这种二价阳离子的 空间结构如图所示(4 个 NH3 与 Cu2+共面,跟 H2O-Cu2+ -H2O 轴线垂直)。请回答以下问题。 (1)基态 Cu 原子的价层电子的轨道表示式为 。 (2)硫酸铜水溶液滴加浓氨水的变化过程,现象 a 是 ;写出生成深蓝色透明溶液 的离子方程式:

志鸿优化系列丛书 志鸿优化网,永远提供更新的: 丛书主编任志湖。 http://www.zhyh.org (3)NH与Cu2+可形成[Cu(NHs)4]2+。已知NF3与NH具有相同的空间结构,但NF3不易与Cu2+形成 配离子,其原因是 (4)已知高温下CuO→Cu2O+02,从铜原子价层电子结构变化角度来看,能生成Cu20的原因 是 3d 4s 答案1四D (2)形成蓝色沉淀Cu(OH2+4NH3HC一[Cu(NH)4(HO2]2+2OH+2HO (3)F的电负性比N大,N一F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强, 难以形成配位键 (4)CuO中铜的价层电子排布为3d,Cu20中铜的价层电子排布为3d0,后者处于稳定的全充满状态而 前者不是 解析2)向硫酸铜溶液中滴氨水,氨水与硫酸铜反应首先生成氢氧化铜蓝色沉淀,则现象是生成蓝色 沉淀:继续滴加氨水,沉淀溶解,氨水与氢氧化铜反应生成可溶性的铜氨配合物,根据离子的空间结构 可知生成 [Cu(NH3)4(HO)2]2+。 (3)F的电负性大于N的,NF3中N一F成键电子对偏向于F原子,导致NF3中氨原子核对其孤电子对 的吸引能力增强,N原子上的孤电子对难与铜离子形成配离子,所以NF3不易与C+形成配离子。 (4)高温下CuO→CuO+O2,Cu2+的价层电子排布为3d°,Cu*的价层电子排布为3d1°,固相中Cu更稳定, 因此能够生成Cu20的原因可以解释为:CuO中铜的价层电子排布为3d,Cu2O中铜的价层电子排布 为3d10,后者处于稳定的全充满状态而前者不是。 挑战创新 冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图 1所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。 图1 (1)L与X的空腔大小相近,恰好能进入X的环内,且L与氧原子的一个孤电子对作用形成稳定结构 W(如图)。基态锂离子核外能量最高的电子所处能层符号为 (2)冠醚Y能与K+形成稳定结构,但不能与L形成稳定结构。理由是 7
7 (3)NH3 与 Cu2+可形成[Cu(NH3)4] 2+。已知 NF3与 NH3 具有相同的空间结构,但 NF3不易与 Cu2+形成 配离子,其原因是 。 (4)已知高温下 CuO→Cu2O+O2,从铜原子价层电子结构变化角度来看,能生成 Cu2O 的原因 是 。 答案:(1) (2)形成蓝色沉淀 Cu(OH)2+4NH3·H2O [Cu(NH3)4(H2O)2] 2++2OH-+2H2O (3)F 的电负性比 N 大,N—F 成键电子对偏向 F,导致 NF3中氮原子核对其孤电子对的吸引能力增强, 难以形成配位键 (4)CuO 中铜的价层电子排布为 3d9 ,Cu2O 中铜的价层电子排布为 3d10 ,后者处于稳定的全充满状态而 前者不是 解析:(2)向硫酸铜溶液中滴氨水,氨水与硫酸铜反应首先生成氢氧化铜蓝色沉淀,则现象 a 是生成蓝色 沉淀;继续滴加氨水,沉淀溶解,氨水与氢氧化铜反应生成可溶性的铜氨配合物,根据离子的空间结构 可知生成 [Cu(NH3)4(H2O)2] 2+。 (3)F 的电负性大于 N 的,NF3 中 N—F 成键电子对偏向于 F 原子,导致 NF3中氮原子核对其孤电子对 的吸引能力增强,N 原子上的孤电子对难与铜离子形成配离子,所以 NF3 不易与 Cu2+形成配离子。 (4)高温下 CuO→Cu2O+O2,Cu2+的价层电子排布为 3d9 ,Cu+的价层电子排布为 3d10 ,固相中 Cu+更稳定, 因此能够生成 Cu2O 的原因可以解释为:CuO 中铜的价层电子排布为 3d9 ,Cu2O 中铜的价层电子排布 为 3d10 ,后者处于稳定的全充满状态而前者不是。 挑战创新 冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z 是常见的三种冠醚,其结构如图 1 所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。 图 1 (1)Li+与 X 的空腔大小相近,恰好能进入 X 的环内,且 Li+与氧原子的一个孤电子对作用形成稳定结构 W(如图)。基态锂离子核外能量最高的电子所处能层符号为 。 (2)冠醚 Y 能与 K+形成稳定结构,但不能与 Li+形成稳定结构。理由是

志鸿优化系列丛书 志鸿优化网,永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org (3)烯烃难溶于水,被KMO4水溶液氧化的效果较差。若烯烃中溶入冠醚Z,氧化效果明显提升。 已知:冠醚Z与KMnO4可以发生如图2所示的变化。 KMnO,+[ 图2 加入冠醚Z后,烯烃的氧化效果明显提升的原因是 答案1)K (2)L半径比Y的空腔小很多,不易与空腔内氧原子上的孤电子对作用形成稳定结构 (3)冠醚可溶入烯烃中,进入冠醚中的K+因静电作用将M0:带入烯烃中,增大烯烃与M0:的接触机 会,提升氧化效果 解析)基态锂离子核外只有1s能级上有电子,为K层上的电子,所以其能层符号为K。 (2)冠醚Y空腔较大,L计半径较小,L计半径远远小于Y空腔,导致该离子不易与氧原子上的孤电子对形 成配位键,所以得不到稳定结构。 (3)根据“相似相溶”规律知,冠醚可溶入烯烃中,进入冠醚中的K因静电作用将M0:带入烯烃中,增大 反应物间的接触面积,增大烯烃与MO:的接触机会,提高氧化效果。 8
8 (3)烯烃难溶于水,被 KMnO4 水溶液氧化的效果较差。若烯烃中溶入冠醚 Z,氧化效果明显提升。 已知:冠醚 Z 与 KMnO4 可以发生如图 2 所示的变化。 图 2 加入冠醚 Z 后,烯烃的氧化效果明显提升的原因是 。 答案:(1)K (2)Li+半径比 Y 的空腔小很多,不易与空腔内氧原子上的孤电子对作用形成稳定结构 (3)冠醚可溶入烯烃中,进入冠醚中的 K+因静电作用将 MnO4 - 带入烯烃中,增大烯烃与 MnO4 - 的接触机 会,提升氧化效果 解析:(1)基态锂离子核外只有 1s 能级上有电子,为 K 层上的电子,所以其能层符号为 K。 (2)冠醚 Y 空腔较大,Li+半径较小,Li+半径远远小于 Y 空腔,导致该离子不易与氧原子上的孤电子对形 成配位键,所以得不到稳定结构。 (3)根据“相似相溶”规律知,冠醚可溶入烯烃中,进入冠醚中的 K+因静电作用将 MnO4 - 带入烯烃中,增大 反应物间的接触面积,增大烯烃与 MnO4 - 的接触机会,提高氧化效果