
志鸿优化系列丛书 志鸿优化网,永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org 第二章过关检测(B卷) (时间:90分钟满分:100分) 一、选择题(本题共18个小题,每小题2分,共36分。每小题四个选项只有一项符合题 目要求) 1.共价键、离子键和范德华力是粒子之间的不同作用力,下列物质中含有两种上述作用力的是 ()。 ①NaOH ②SiO2③NaO2④金刚石⑤NaCI ⑥白磷 A.①③⑥ B.①②④ c.②④⑤ D.③④⑤ 答案A 解析DNaOH是离子化合物,Na与O肝之间存在离子健,氧原子与氢原子之间存在共价键;②SiO2是 共价化合物,只存在共价键:③Na2O2是离子化合物,Na与02~间存在离子键,氧原子与氧原子之间存在 共价键;④金刚石中只存在共价键;⑤NCl是离子化合物,只存在离子键:⑥白磷存在P一P共价键,白 磷分子间通过范德华力结合,故选A。 2.根据键能数据(H一C1431.8 kJ-mol-,H一I298.7 kJ.mol-),可得出的结论是()。 A.溶于水时,HⅢ比HC1更容易电离,所以氢碘酸是强酸 BHⅢ的熔、沸点比HCI的熔、沸点高 C.HⅢ比HCI稳定 D.拆开等物质的量的HⅢ和HCL,HⅢ消耗的能量多 答案A 解析比较H一和H一C的健能大小可知H一1的镀能小,易断裂,国此HC比Ⅲ稳定,HⅢ的酸性强, 但由分子组成的物质的熔、沸点与键能无关。 CI NH;-Pt-NH, H,N-Pt-Cl 3.科学家发现铂的两种化合物(短线表示化学键),ā为 ,b为 NH: ,两者有不同 的特性,a具有抗癌作用,而b没有。a和b互为()。 A同分异构体 B同素异形体 C同位素 D.同一物质 答案A 1
1 第二章过关检测(B 卷) (时间:90 分钟 满分:100 分) 一、选择题(本题共 18 个小题,每小题 2 分,共 36 分。每小题四个选项只有一项符合题 目要求) 1.共价键、离子键和范德华力是粒子之间的不同作用力,下列物质中含有两种上述作用力的是 ( )。 ①NaOH ②SiO2 ③Na2O2 ④金刚石 ⑤NaCl ⑥白磷 A.①③⑥ B.①②④ C.②④⑤ D.③④⑤ 答案:A 解析:①NaOH 是离子化合物,Na+与 OH-之间存在离子键,氧原子与氢原子之间存在共价键;②SiO2 是 共价化合物,只存在共价键;③Na2O2 是离子化合物,Na+与O2 2-间存在离子键,氧原子与氧原子之间存在 共价键;④金刚石中只存在共价键;⑤NaCl 是离子化合物,只存在离子键;⑥白磷存在 P—P 共价键,白 磷分子间通过范德华力结合,故选 A。 2.根据键能数据(H—Cl 431.8 kJ·mol-1 ,H—I 298.7 kJ·mol-1 ),可得出的结论是( )。 A.溶于水时,HI 比 HCl 更容易电离,所以氢碘酸是强酸 B.HI 的熔、沸点比 HCl 的熔、沸点高 C.HI 比 HCl 稳定 D.拆开等物质的量的 HI 和 HCl,HI 消耗的能量多 答案:A 解析:比较 H—I 和 H—Cl 的键能大小可知 H—I 的键能小,易断裂,因此 HCl 比 HI 稳定,HI 的酸性强, 但由分子组成的物质的熔、沸点与键能无关。 3.科学家发现铂的两种化合物(短线表示化学键),a 为 ,b 为 ,两者有不同 的特性,a 具有抗癌作用,而 b 没有。a 和 b 互为( )。 A.同分异构体 B.同素异形体 C.同位素 D.同一物质 答案:A

志鸿优化系列丛书 志鸿优化网,永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org 解析观察a、b的组成和结构可知:两者分子式相同,空间结构不同,属于同分异构体。 4.在S0O2分子中,分子的空间结构为V形,S采用sp杂化,那么SO2的键角()。 A.等于120° B.大于120° C.小于120 D.等于180° 含案c 解析由于SO2分子的VSEPR模型为平面三角形,从理论上讲其键角应为120°,但是由于SO2分子 中的S上有一个孤电子对,对其他的两个化学镀存在排斥作用,因此分子中的键角要小于120°。 5.二甘醇可用作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。二甘醇的结构简式 是 HO-CH2CH2一OCH2CH2一OH。下列有关二甘醇的叙述正确的是()。 A.符合通式CnH2nOs B.分子间能形成氢键 C.分子间不存在范德华力 D.能溶于水,不溶于乙醇 答案B 解析二甘醇的分子式为CHo0,不符合通式C.H2.Os;二甘醇分子之间能形成0一H…0一,也存在范 德华力;由“相似相溶”规律可知,二甘醇能溶于水和乙醇。 6.下列说法中错误的是()。 A.氨水中含有分子间氢键 B.HO的沸点比HF的沸点高,可能与氢键有关 C氢键X一HY一的三个原子总在一条直线上 D.卤化氢中,HF沸点最高,是由于HF分子间存在氢键 答案c 解析氨水中除NH分子之间存在氢键,NH与HO、H0与H0之间都存在氢健,A项正确。氢键 中的X一H…Y一三原子应尽可能在一条直线上,但在特定条件下,如空间位置的影响下,也可能不在 一条直线上,C项错误。因氯化氢分子之间存在氢键,所以HF是卤化氢中沸点最高的。 7.下列物质的熔、沸点高低顺序正确的是()。 A.F2>Cl2>Br2>I2 B.CF4>CCl4>CBr4>CI4 C.HF<HCI<HBr<HI 2
2 解析:观察 a、b 的组成和结构可知:两者分子式相同,空间结构不同,属于同分异构体。 4.在 SO2 分子中,分子的空间结构为 V 形,S 采用 sp2 杂化,那么 SO2 的键角( )。 A.等于 120° B.大于 120° C.小于 120° D.等于 180° 答案:C 解析:由于 SO2 分子的 VSEPR 模型为平面三角形,从理论上讲其键角应为 120°,但是由于 SO2分子 中的 S 上有一个孤电子对,对其他的两个化学键存在排斥作用,因此分子中的键角要小于 120°。 5.二甘醇可用作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。二甘醇的结构简式 是 HO—CH2CH2—O—CH2CH2—OH。下列有关二甘醇的叙述正确的是( )。 A.符合通式 CnH2𝑛O3 B.分子间能形成氢键 C.分子间不存在范德华力 D.能溶于水,不溶于乙醇 答案:B 解析:二甘醇的分子式为 C4H10O3,不符合通式 CnH2nO3;二甘醇分子之间能形成 O—H…O—,也存在范 德华力;由“相似相溶”规律可知,二甘醇能溶于水和乙醇。 6.下列说法中错误的是( )。 A.氨水中含有分子间氢键 B.H2O 的沸点比 HF 的沸点高,可能与氢键有关 C.氢键 X—H…Y—的三个原子总在一条直线上 D.卤化氢中,HF 沸点最高,是由于 HF 分子间存在氢键 答案:C 解析:氨水中除 NH3 分子之间存在氢键,NH3 与 H2O、H2O 与 H2O 之间都存在氢键,A 项正确。氢键 中的 X—H…Y—三原子应尽可能在一条直线上,但在特定条件下,如空间位置的影响下,也可能不在 一条直线上,C 项错误。因氟化氢分子之间存在氢键,所以 HF 是卤化氢中沸点最高的。 7.下列物质的熔、沸点高低顺序正确的是( )。 A.F2>Cl2>Br2>I2 B.CF4>CCl4>CBr4>CI4 C.HF<HCl<HBr<HI

志鸿优化系列丛书 志鸿优化网永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org D.CH4②>③ B.③>①>② C.③>②>① 3
3 D.CH4②>③ B.③>①>② C.③>②>①

志鸿优化系列丛书 志鸿优化网,永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org D.②>①>③ 答案B 解析苯酚以及木糖醇都含有羟基,可与水形成分子间氢健,含有羟基数目越多,越易溶于水,溶解性③> ①:花生油为酯类物质,难溶于水,溶解性最小。 11.下列事实与氢键无关的是()。 A.乙醇和水互溶 B.一定条件下,NH3与BF3可以形成NHBF3 C.羊毛制品水洗再晒干后变形 D.H2O和CH:COCH3的结构和极性并不相似,但两者能完全互溶 答案B 解析乙醇和水可形成分子间氢键,是乙醇与水可互溶的一个原因,A项不符合题意。NHBF;中,B提 供空原子轨道、N提供孤电子对,B、N之间形成共价键,与氢键无关,B项符合题意。羊毛制品含有 电负性很大的氮原子,水洗后,氮原子与氢原子形成氢键,水洗再晒干后变形,C项不符合题意。HO 和CH;COCH的结构和极性并不相似,但CH;COCH能与水形成分子间氢键,所以两者能完全互溶, D项不符合题意。 12.下列对应关系不正确的是( 选项 B D 中心原子 第IVA族 第VA族 第IVA族 所在族 第VIA族 分子通式 AB AB3 AB2 AB2 分子的 正四面 体形 平面三角形 直线形 V形 空间结构 答案B 解析当中心原子在第VA族,AB:分子的空间结构应是三角锥形。当中心原子在第NA族,AB:分子 的空间结构是正四面体形,AB2分子的空间结构是直线形。当中心原子在第VIA族,AB2分子的空间 结构是V形。 13.NH3、HS等是极性分子,CO2、BF3、CC14等是含极性键的非极性分子。根据上述实例可推出 ABn型分子是非极性分子的经验规律是()。 A分子中不能含有氢原子 B.在ABm分子中A的相对原子质量应小于B的相对原子质量 4
4 D.②>①>③ 答案:B 解析:苯酚以及木糖醇都含有羟基,可与水形成分子间氢键,含有羟基数目越多,越易溶于水,溶解性③> ①;花生油为酯类物质,难溶于水,溶解性最小。 11.下列事实与氢键无关的是( )。 A.乙醇和水互溶 B.一定条件下,NH3 与 BF3 可以形成 NH3•BF3 C.羊毛制品水洗再晒干后变形 D.H2O 和 CH3COCH3 的结构和极性并不相似,但两者能完全互溶 答案:B 解析:乙醇和水可形成分子间氢键,是乙醇与水可互溶的一个原因, A 项不符合题意。NH3·BF3 中,B提 供空原子轨道、N 提供孤电子对,B、N 之间形成共价键,与氢键无关, B 项符合题意。羊毛制品含有 电负性很大的氮原子,水洗后,氮原子与氢原子形成氢键,水洗再晒干后变形, C 项不符合题意。H2O 和 CH3COCH3 的结构和极性并不相似,但 CH3COCH3 能与水形成分子间氢键,所以两者能完全互溶, D 项不符合题意。 12.下列对应关系不正确的是( )。 选项 A B C D 中心原子 所在族 第ⅣA 族 第ⅤA 族 第ⅣA 族 第ⅥA 族 分子通式 AB4 AB3 AB2 AB2 分子的 空间结构 正四面 体形 平面三角形 直线形 V 形 答案:B 解析:当中心原子在第ⅤA 族,AB3 分子的空间结构应是三角锥形。当中心原子在第ⅣA 族,AB4 分子 的空间结构是正四面体形,AB2 分子的空间结构是直线形。当中心原子在第ⅥA 族,AB2 分子的空间 结构是 V 形。 13.NH3、H2S 等是极性分子,CO2、BF3、CCl4 等是含极性键的非极性分子。根据上述实例可推出 ABn 型分子是非极性分子的经验规律是( )。 A.分子中不能含有氢原子 B.在 ABn 分子中 A 的相对原子质量应小于 B 的相对原子质量

志鸿优化系列丛书 志鸿优化网永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org C.在ABn分子中A原子上没有孤电子对 D.分子中每个共价键的键长应相等 答案c 解析题中五种分子的电子式分别为H:N:H、 H HS、0C0、FBF :CI:C:C:,其中NH、HS分子的中心原子上有孤电子对,导致正电中心和负电中心不重合,使分子具 Q 有极性。而CO2、BF3、CC4分子的中心原子上没有孤电子对,正电中心和负电中心重合,分子无极 性。 14.全硼富勒烯团簇B40的结构酷似中国的红灯笼(如图)。该材料可用于组装分子器件,在储氢储锂、 半导体、超导、绿色催化等领域具有重要的应用前景。下列有关说法正确的是()。 A.B40与石墨烯的结构相同,两者互为同素异形体 B.43.2g该物质含有2.408×1024个原子 C.B4o中既含极性键,又含有非极性键 D.全硼富勒烯团簇是一种新型的高分子材料 答案B 解析B40与石墨烯是不同元素形成的单质,不是同素异形体的关系,A项错误。43.2gB40为0.1 mol,0.1molB40含有4molB原子,即2.408×1024个原子,B项正确。不同的非金属元素原子之间形成 极性键,故B40中无极性键,C项错误。全硼富勒烯团簇是一种单质,且相对分子质量不是很大,不是高 分子,D项错误。 15.在半导体生产或灭火剂的使用中,会向空气中逸散气体,如NF3、CHCIFCF3、C3Fg,它们虽是微量 的,但有些却是强温室气体。下列有关推测正确的是()。 ANF3属于非极性分子 B.CHCIFCF3属于手性分子 C.C3F8中C采取sp2杂化 D.由价层电子对互斥模型可确定NF3分子中N采用s即杂化,NF3分子呈平面三角形 5
5 C.在 ABn 分子中 A 原子上没有孤电子对 D.分子中每个共价键的键长应相等 答案:C 解析:题中五种分子的电子式分别为H· ·N ·· H ·· · ·H、 H· ·S ·· H ·· · ·、· · O ·· · · · · C· · · ·O ·· · ·、· · F ·· ·· · · B ·· · ·F· · ·· · ·F ·· ·· · ·、 · ·Cl ·· ·· · · C ·· · ·Cl· · ·· ·· · ·Cl· · ·· · ·Cl ·· ·· · · ,其中 NH3、H2S 分子的中心原子上有孤电子对,导致正电中心和负电中心不重合,使分子具 有极性。而 CO2、BF3、CCl4 分子的中心原子上没有孤电子对,正电中心和负电中心重合,分子无极 性。 14.全硼富勒烯团簇 B40 的结构酷似中国的红灯笼(如图)。该材料可用于组装分子器件,在储氢储锂、 半导体、超导、绿色催化等领域具有重要的应用前景。下列有关说法正确的是( )。 A.B40 与石墨烯的结构相同,两者互为同素异形体 B.43.2 g 该物质含有 2.408×1024 个原子 C.B40 中既含极性键,又含有非极性键 D.全硼富勒烯团簇是一种新型的高分子材料 答案:B 解析:B40 与石墨烯是不同元素形成的单质,不是同素异形体的关系, A 项错误。 43.2 g B40 为 0.1 mol,0.1 mol B40 含有 4 mol B 原子,即 2.408×1024 个原子, B 项正确。不同的非金属元素原子之间形成 极性键,故 B40 中无极性键, C 项错误。全硼富勒烯团簇是一种单质,且相对分子质量不是很大,不是高 分子, D 项错误。 15.在半导体生产或灭火剂的使用中,会向空气中逸散气体,如 NF3、CHClFCF3、C3F8,它们虽是微量 的,但有些却是强温室气体。下列有关推测正确的是( )。 A.NF3 属于非极性分子 B.CHClFCF3 属于手性分子 C.C3F8 中 C 采取 sp2 杂化 D.由价层电子对互斥模型可确定 NF3 分子中 N 采用 sp2 杂化,NF3 分子呈平面三角形

志鸿优化系列丛书 志鸿优化网,永远提供更新的: 丛书主编任志河。 http://www.zhyh.org 答案B 解析由价层电子对互斥模型可确定NF3分子中N采用sp杂化,NF3分子呈三角锥形,故NF3的结构 类似NH,属于极性分子,A、D项错误。连有4个不同原子或者原子团的碳原子属于手性碳原子,故 CHCIFCF3中存在一个手性碳原子,其属于手性分子,B项正确。C3Fg中C均形成4个键,C采取sp 杂化,C项错误。 16.下列模型分别表示C2H2、S8、SF6的结构,下列说法正确的是()。 oo-00o C2H2 SF6 A.32gS8分子中含有0.125molo键 B.SF6是由非极性键构成的分子 C.1molC2H4分子中有5molo键和1molπ键 D.C2H分子中不含非极性键 答案c 8x32gm0*8=1mol,A项错误。 解析1 mol Ss分子中含有8molc键,因此32gS8分子中所含c健为32g 根据SF6的结构模型可知,SF6是由S一F极性键构成的分子,B项错误。成镀原子之间最多形成1个 o键,双键中有1个π键,因此1mol乙烯中含有5molo键和1molπ键,C项正确。C2H分子中所含 的碳碳三键是非极性键,D项错误。 17.甲醛(分子式为CHO)是一种具有强烈刺激性气味的气体,被列入世界卫生组织国际癌症研究机构 2017年10月27日公布的一类致癌物清请单。下列关于其结构及性质的分析正确的是()。 A.碳原子采取sp3杂化,氧原子采取s即杂化 B.甲醛分子中心原子上的价层电子对数为4,含有1个孤电子对,是三角锥形结构 C.甲醛分子与水分子间可以形成氢键,但甲醛分子之间不能形成氢键 D.甲醛分子为非极性分子 答案c 解析甲醛分子的中心碳原子上的孤电子对数=(42×11×2)0,故中心原子上的价层电子对数为3, 则分子中的碳原子采取$p杂化,故甲醛分子的空间结构为平面三角形,A、B项错误。甲醛分子中的 氧原子可以与水分子中的氢原子形成氢键,但由于甲醛分子中无形成氢键的氢原子,故甲醛分子间不 能形成氢键,C项正确。虽然甲醛分子是平面三角形结构,但正、负电中心不重合,故甲醛分子为极性 分子,D项错误。 6
6 答案:B 解析:由价层电子对互斥模型可确定 NF3 分子中 N 采用 sp3 杂化,NF3 分子呈三角锥形,故 NF3的结构 类似 NH3,属于极性分子,A、D 项错误。连有 4 个不同原子或者原子团的碳原子属于手性碳原子,故 CHClFCF3 中存在一个手性碳原子,其属于手性分子,B 项正确。C3F8 中 C 均形成 4 个 σ 键,C 采取 sp3 杂化,C 项错误。 16.下列模型分别表示 C2H2、S8、SF6 的结构,下列说法正确的是( )。 A.32 g S8 分子中含有 0.125 mol σ 键 B.SF6 是由非极性键构成的分子 C.1 mol C2H4 分子中有 5 mol σ 键和 1 mol π 键 D.C2H2 分子中不含非极性键 答案:C 解析:1 mol S8 分子中含有 8 mol σ 键,因此 32 g S8 分子中所含 σ 键为 32 g 8×32 g·mol -1×8=1 mol,A 项错误。 根据 SF6 的结构模型可知,SF6 是由 S—F极性键构成的分子,B 项错误。成键原子之间最多形成 1个 σ 键,双键中有 1 个 π 键,因此 1 mol 乙烯中含有 5 mol σ 键和 1 mol π 键,C 项正确。C2H2 分子中所含 的碳碳三键是非极性键,D 项错误。 17.甲醛(分子式为 CH2O)是一种具有强烈刺激性气味的气体,被列入世界卫生组织国际癌症研究机构 2017 年 10 月 27 日公布的一类致癌物清单。下列关于其结构及性质的分析正确的是( )。 A.碳原子采取 sp3 杂化,氧原子采取 sp 杂化 B.甲醛分子中心原子上的价层电子对数为 4,含有 1 个孤电子对,是三角锥形结构 C.甲醛分子与水分子间可以形成氢键,但甲醛分子之间不能形成氢键 D.甲醛分子为非极性分子 答案:C 解析:甲醛分子的中心碳原子上的孤电子对数= 1 2 ×(4-2×1-1×2)=0,故中心原子上的价层电子对数为 3, 则分子中的碳原子采取 sp2 杂化,故甲醛分子的空间结构为平面三角形,A、B 项错误。甲醛分子中的 氧原子可以与水分子中的氢原子形成氢键,但由于甲醛分子中无形成氢键的氢原子,故甲醛分子间不 能形成氢键,C 项正确。虽然甲醛分子是平面三角形结构,但正、负电中心不重合,故甲醛分子为极性 分子,D 项错误
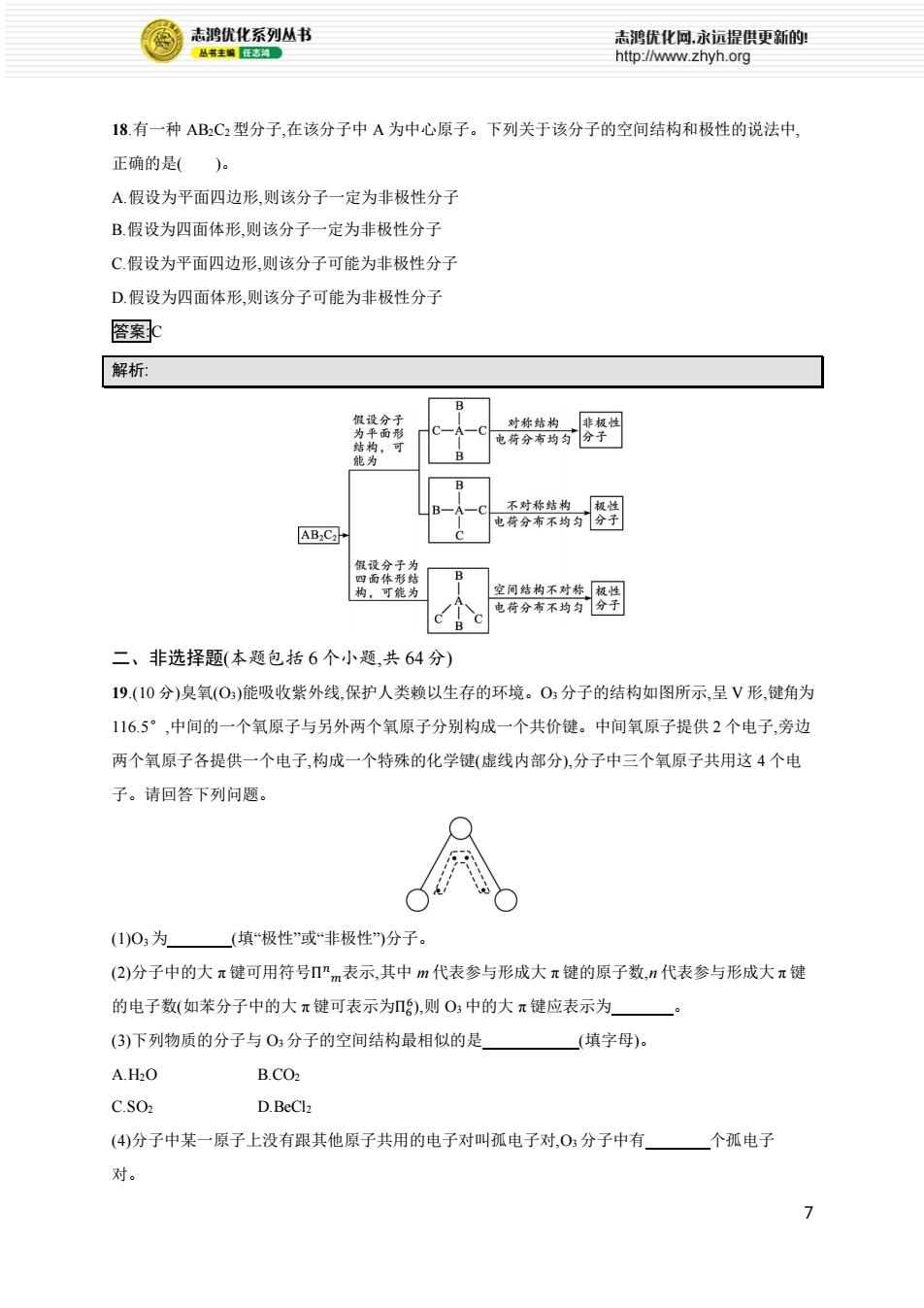
志鸿优化系列丛书 志鸿优化网,永远提供更新的: 丛书主编任志河。 http://www.zhyh.org 18.有一种AB2C2型分子,在该分子中A为中心原子。下列关于该分子的空间结构和极性的说法中, 正确的是()。 A.假设为平面四边形,则该分子一定为非极性分子 B.假设为四面体形,则该分子一定为非极性分子 C.假设为平面四边形,则该分子可能为非极性分子 D.假设为四面体形,则该分子可能为非极性分子 含案c 解析 B 假设分子 对称结构 非极性 为平面形 结构,可 电荷分布均匀 分子 能为 不对称结构 极性 电荷分布不均匀门分子 ABC☑ 假设分子为 四面体形结 B 构,可能为 空间结构不对称极性 电荷分布不均匀分子 B 二、非选择题(本题包括6个小题,共64分) 19.(10分)臭氧(O)能吸收紫外线,保护人类赖以生存的环境。O3分子的结构如图所示,呈V形,键角为 1165°,中间的一个氧原子与另外两个氧原子分别构成一个共价键。中间氧原子提供2个电子,旁边 两个氧原子各提供一个电子,构成一个特殊的化学键(虚线内部分),分子中三个氧原子共用这4个电 子。请回答下列问题。 (1)03为 (填“极性”或“非极性)分子。 (2)分子中的大π键可用符号”m表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键 的电子数(如苯分子中的大π键可表示为),则O中的大π键应表示为 (3)下列物质的分子与O:分子的空间结构最相似的是 (填字母)。 A.H2O B.CO2 C.S02 D.BeCl2 (4)分子中某一原子上没有跟其他原子共用的电子对叫孤电子对,O,分子中有 个孤电子 对。 7
7 18.有一种 AB2C2 型分子,在该分子中 A 为中心原子。下列关于该分子的空间结构和极性的说法中, 正确的是( )。 A.假设为平面四边形,则该分子一定为非极性分子 B.假设为四面体形,则该分子一定为非极性分子 C.假设为平面四边形,则该分子可能为非极性分子 D.假设为四面体形,则该分子可能为非极性分子 答案:C 解析: 二、非选择题(本题包括 6 个小题,共 64 分) 19.(10 分)臭氧(O3)能吸收紫外线,保护人类赖以生存的环境。O3 分子的结构如图所示,呈 V 形,键角为 116.5°,中间的一个氧原子与另外两个氧原子分别构成一个共价键。中间氧原子提供 2 个电子,旁边 两个氧原子各提供一个电子,构成一个特殊的化学键(虚线内部分),分子中三个氧原子共用这 4 个电 子。请回答下列问题。 (1)O3 为 (填“极性”或“非极性”)分子。 (2)分子中的大 π 键可用符号Π 𝑛 𝑚表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大 π 键 的电子数(如苯分子中的大 π 键可表示为Π6 6 ),则 O3 中的大 π 键应表示为 。 (3)下列物质的分子与 O3 分子的空间结构最相似的是 (填字母)。 A.H2O B.CO2 C.SO2 D.BeCl2 (4)分子中某一原子上没有跟其他原子共用的电子对叫孤电子对,O3 分子中有 个孤电子 对

志鸿优化系列丛书 志鸿优化网,永远提供更新的: 丛书主编任志湖。 http://www.zhyh.org 答案1)极性 (2)n (3)C (4)5 解析1)0为极性分子。 (3)03分子中中间氧原子采用sp2杂化;H0分子中氧原子采用sp3杂化;C02中碳原子采用s即杂 化;BC2中铍原子采用sp杂化:SO2中硫原子采用sp2杂化,SO2为V形结构,所以SO2和O3的结构最 相似。 20.(8分)数十亿年来,地球上的物质不断地发生变化,大气的成分也发生了变化。下表是原始大气和 目前的空气的成分 空气的成分 N2、O2、CO2、水蒸气及稀有气体(He、Ne等)等 原始大气的成分 CH4、NH、CO、CO2等 用上表中所涉及的分子填写下列空白。 (1)含有10个电子的分子有」 (填化学式,下同)。 (2)由极性键构成的非极性分子有 (3)沸点最高的是 用所学知识解释其沸点高的原 因 (4)分子中不含孤电子对的分子(除稀有气体外)有 它的空间结构为 (5) 极易溶于水,它之所以极易溶于水是因为它的分子和水分子之间可形 成 答案I)HO、Ne、CH4、NH (2)CH4、CO2 (3)H0液态水分子间存在氢键,使分子间作用力较强,沸点较高 (4)CH4正四面体形 (5)NH氢键 解析4)甲烷的电子式为H:CH不存在孤电子对,且中心碳原子为sp杂化,故其空间结构为正四面体 H 形。 21.(12分)1)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别 (2)元素As与N同族。预测As的氢化物分子的空间结构为】 其沸点比NH的 (填“高或“低,其判断理由是」 8
8 答案:(1)极性 (2)Π3 4 (3)C (4)5 解析:(1)O3 为极性分子。 (3)O3 分子中中间氧原子采用 sp2 杂化;H2O 分子中氧原子采用 sp3 杂化;CO2 中碳原子采用 sp 杂 化;BeCl2 中铍原子采用 sp 杂化;SO2 中硫原子采用 sp2 杂化,SO2 为 V 形结构,所以 SO2 和 O3 的结构最 相似。 20.(8 分)数十亿年来,地球上的物质不断地发生变化,大气的成分也发生了变化。下表是原始大气和 目前的空气的成分: 空气的成分 N2、O2、CO2、水蒸气及稀有气体(He、Ne等)等 原始大气的成分 CH4、NH3、CO、CO2等 用上表中所涉及的分子填写下列空白。 (1)含有 10 个电子的分子有 (填化学式,下同)。 (2)由极性键构成的非极性分子有 。 (3)沸点最高的是 ,用所学知识解释其沸点高的原 因: 。 (4)分子中不含孤电子对的分子(除稀有气体外)有 ,它的空间结构为 。 (5) 极易溶于水,它之所以极易溶于水是因为它的分子和水分子之间可形 成 。 答案:(1)H2O、Ne、CH4、NH3 (2)CH4、CO2 (3)H2O 液态水分子间存在氢键,使分子间作用力较强,沸点较高 (4)CH4 正四面体形 (5)NH3 氢键 解析:(4)甲烷的电子式为H· ·C ·· H ·· H · ·H,不存在孤电子对,且中心碳原子为 sp3 杂化,故其空间结构为正四面体 形。 21.(12 分)(1)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别 是 、 。 (2)元素 As 与 N 同族。预测 As 的氢化物分子的空间结构为 ,其沸点比 NH3 的 (填“高”或“低”),其判断理由是

志鸿优化系列丛书 志鸿优化网,永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org (3)①FeCl,中的化学键具有明显的共价性,蒸气状态下以双聚分子存在的FCl,的结构式 为 ②NH4HPO4中,电负性最高的元素是 P的 杂化轨道与0的2p轨道形成 键。 答案1)sp3sp (2)三角锥形低NH分子间存在氢键 FeFe (3)①CC1C②0sp3o 解析1)1个乙二胺分子中每个N形成3个单键,含有1个孤电子对,N原子均属于sp杂化:每个C形 成4个单键,不存在孤电子对,C原子也是s即3杂化。 (2)As与N同族,则AsH分子的空间结构类似于NH3,为三角锥形;由于NH分子间存在氢键使其沸 点升高,故AsH的沸,点比NH的低。 (3)①氯化铁的双聚分子,就是两个氯化铁相连接在一起,已知氯化铁的化学键有明显的共价性,所以仿 C CI Fe Fe 照共价键的形式将两个氯化铁连接在一起,即结构式为C1 CI ②一般来说,同周期主族元素从左到右,元素的电负性依次增大,同主族元素从上到下,元素的电负性 依次减小,故NH4HPO4中O的电负性是最大的。NH4PO4中P的杂化类型是sp3,P的sp3杂化轨道 与0的2p轨道形成o键。 22.(10分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。 A B GH K L M N 试回答下列问题。 (1)表中的元素,电负性最强的是 (填元素符号),J的元素名称为】 (2)D元素原子的价层电子的轨道表示式为 该元素形成的常见单质 分子中σ键和π键的个数比为 (3)ME2L2常温下为深红色液体,能与CC4、CS2等互溶,据此可判断MEzL2是 (填“极性”或 “非极性”)分子。 (4)在①苯、②CHOH、③HCHO、④CS2、⑤CC14五种分子中,碳原子采取sp2杂化的分子有 (填序号)。 答案1)F硅 9
9 (3)①FeCl3 中的化学键具有明显的共价性,蒸气状态下以双聚分子存在的 FeCl3 的结构式 为 。 ②NH4H2PO4 中,电负性最高的元素是 ;P 的 杂化轨道与 O 的 2p 轨道形成 键。 答案:(1)sp3 sp3 (2)三角锥形 低 NH3 分子间存在氢键 (3)① ②O sp3 σ 解析:(1)1 个乙二胺分子中每个 N 形成 3 个单键,含有 1 个孤电子对,N 原子均属于 sp3 杂化;每个 C 形 成 4 个单键,不存在孤电子对,C 原子也是 sp3 杂化。 (2)As 与 N 同族,则 AsH3 分子的空间结构类似于 NH3,为三角锥形;由于 NH3 分子间存在氢键使其沸 点升高,故 AsH3 的沸点比 NH3 的低。 (3)①氯化铁的双聚分子,就是两个氯化铁相连接在一起,已知氯化铁的化学键有明显的共价性,所以仿 照共价键的形式将两个氯化铁连接在一起,即结构式为 。 ②一般来说,同周期主族元素从左到右,元素的电负性依次增大,同主族元素从上到下,元素的电负性 依次减小,故 NH4H2PO4 中 O 的电负性是最大的。NH4H2PO4 中 P 的杂化类型是 sp3 ,P 的 sp3 杂化轨道 与 O 的 2p 轨道形成 σ 键。 22.(10 分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。 试回答下列问题。 (1)表中的元素,电负性最强的是 (填元素符号),J 的元素名称为 。 (2)D 元素原子的价层电子的轨道表示式为 ,该元素形成的常见单质 分子中 σ 键和 π 键的个数比为 。 (3)ME2L2 常温下为深红色液体,能与 CCl4、CS2 等互溶,据此可判断 ME2L2 是 (填“极性”或 “非极性”)分子。 (4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4 五种分子中,碳原子采取 sp2 杂化的分子有 (填序号)。 答案:(1)F 硅

志鸿优化系列丛书 志鸿优化网,永远提供更新的! 丛书主编任志湖。 http://www.zhyh.org 2s 2p (2四 ]1:2 (3)非极性 (4)①③ 解析I)根据元素周期表中元素的位置可知A-N分别为H、Li、C、N、O、F、Na、Mg、A、Si、 S、CI、Cr(铬)、Co(钻),则电负性最强的为F。 2s 2p (2)D为N,N为7号元素,核外电子排布式为1sS22s22p,故其价层电子的轨道表示式田t□。 N2的结构式为N=N,故N2分子中G键和π键的个数比为1:2。 (3)ME2L2为CrO2Cl2,能与CCL4、CS2等互溶,根据“相似相溶”规律,CC14、CS2为非极性分子,则 CrO2Cl2也为非极性分子。 (4)苯中碳原子采取sp2杂化,CHOH中碳原子采取sp3杂化,HCHO中碳原子采取sp2杂化,CS2中碳原 子采取s即杂化,CC4中碳原子采取sp3杂化。 23.(10分)氮元素是地球大气中含量最多的元素。 (1)氮元素基态原子核外电子成对电子数与未成对电子数之比为 (2)氨分子中氮原子与氢原子之间的作用力是」 ,而在氨水中,分子间的作用力 有 (3)甘氨酸(H0CCH,一NH,)是最简单的一种氨基酸,其相对分子质量为75,而戊烷的相对分子质 量也为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因 是 (4)氮的氢化物除氨气外,还有联氨,其结构简式为NH一NH2。在联氨分子中,氮原子采取 杂 化,联氨中的六个原子 (填“在或“不在)同一个平面上。 H,N (5)三聚氰胺( NH, )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸( )后,三聚氰 酸与三聚氰胺分子相互之间通过 结合,在肾脏内易形成结石。故严禁非法添加三聚氰 胺和三聚氰酸到食品和饲料中。 答案1)4:3 (2)共价键氢键、范德华力 (3)甘氨酸分子与水分子之间存在氢键,而戊烷与水分子之间不能形成氢键 (4)sp3不在 (5)氢键 10
10 (2) 1∶2 (3)非极性 (4)①③ 解析:(1)根据元素周期表中元素的位置可知 A~N 分别为 H、Li、C、N、O、F、Na、Mg、Al、Si、 S、Cl、Cr(铬)、Co(钴),则电负性最强的为 F。 (2)D 为 N,N 为 7 号元素,核外电子排布式为 1s22s22p3 ,故其价层电子的轨道表示式为 。 N2 的结构式为 N≡N,故 N2 分子中 σ 键和 π 键的个数比为 1∶2。 (3)ME2L2 为 CrO2Cl2,能与 CCl4、CS2 等互溶,根据“相似相溶”规律,CCl4、CS2 为非极性分子,则 CrO2Cl2 也为非极性分子。 (4)苯中碳原子采取 sp2 杂化,CH3OH 中碳原子采取 sp3 杂化,HCHO 中碳原子采取 sp2 杂化,CS2 中碳原 子采取 sp 杂化,CCl4 中碳原子采取 sp3 杂化。 23.(10 分)氮元素是地球大气中含量最多的元素。 (1)氮元素基态原子核外电子成对电子数与未成对电子数之比为 。 (2)氨分子中氮原子与氢原子之间的作用力是 ,而在氨水中,分子间的作用力 有 。 (3)甘氨酸( )是最简单的一种氨基酸,其相对分子质量为 75,而戊烷的相对分子质 量也为 72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因 是 。 (4)氮的氢化物除氨气外,还有联氨,其结构简式为 NH2—NH2。在联氨分子中,氮原子采取 杂 化,联氨中的六个原子 (填“在”或“不在”)同一个平面上。 (5)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸( )后,三聚氰 酸与三聚氰胺分子相互之间通过 结合,在肾脏内易形成结石。故严禁非法添加三聚氰 胺和三聚氰酸到食品和饲料中。 答案:(1)4∶3 (2)共价键 氢键、范德华力 (3)甘氨酸分子与水分子之间存在氢键,而戊烷与水分子之间不能形成氢键 (4)sp3 不在 (5)氢键