
第七章逐步聚合((stepwise polymerization) 【课时安排】 71 1学时 7.2 线性逐步聚合反应机理 1学时15分句 7.3 线性遂步聚合反应动力学 1学时35分钟 7.4 线性学北聚合反应聚合度的控制 2学时 75 重要线性遂步聚合物 自学 76 利北密 1学时40分钟 2> 逐步共聚反 自学 7.8遂步聚合施方法 10分钟 总计 8学时 【掌握内容】 1遂北聚合反应分类 2官能团的等活性 比较线型、 体型逐步聚合、连锁聚合 4线型送步聚合反应聚合度的控削 5体型逐步聚合凝胶点的控制 6遂北聚合滩方法 【孰采内这】 线型遂步聚合反应动力学 2.遂步聚合产品合成工艺 3统计学方法计算凝胶点 【了解内容】 1.线型逐步聚合反应的分子量分布 【教学难点】 1.线性逐步聚合反应机理与动力学 2.控制线性逐步聚合相对分子质量方法 3.控制体型遂步聚合凝胶点 【教学目标】 1掌握逐步聚合反应分类、官能团的等活性、线型与体型逐步聚合、连锁聚合与体型逐步聚 合、反应程度与转化率 当量系数与过量分率 结构预聚物与无规预聚物等基本概念 2掌握线性逐步聚合相对分子质量控制方法及其计算 3掌握体型逐步聚合凝胶点控制方法及其计算 4能正确书与重要隧步聚合产品合成反应式 5四种家※合方法的区别 7.1概述 【教学内容】 7.1.1逐步聚合反应分类 7.12修北聚合反成的单从 【授课时间】1学时 【教学重点】遂步聚合反应分类 【教学难点】 【教学目标】

1掌握逐步聚合反应分类 2区别单体的官能团与官能度 3能正确命名逐步聚合物 【教学手段】课堂讲授 【教学过程】 7.1.1逐步聚合反应分类 1.按反应机理 缩合聚合:多次缩合反应,有小分子析出(典型遂步聚合,重点研究) nH:N(CH2)NH2+nHCOOC(CH:)COOH H NH(CH2)NHOC(CH2)CO ]OH_ (2n-DH:Q 逐步加聚:多次官能团间加成,无小分子析出 HO-R-OH+O-C=N-R-N=C-O-DHO-RL-O-CO-NH-R-N=C-0 HO-R-O[CO-NH-R-NH-CO-O-R-O]CO-NH-R-NC0(聚氨酯) 2.按反应动力学 平衡反应:K10聚碳酸酯 3.按产物链结构 线型缩聚,单休2线型结构,可溶解,可熔功 尼龙 体型缩聚:单体3体型 支化或 状)结构, 不溶解,不熔融 环氧树脂 4.按所含特征官能团:聚醚化.聚酯化.聚酰胺化 5.按反应单体种类 均箱聚homopolycondensation:aRb HN(CH:)COOH→ 混缩聚mixing poly ondensation:aRa+bR'b H2N(CH2)NH2+HOOC(CH2)4COOH-> 共缩聚co-condensation polymerization: 7.1.2遂步聚合反应的单体 单体的官能团与官能度 官能团:参与反应并表征反应类型的原子(团 官能度:单体分子中反应点的数目叫做单体功能度(),一般就等于单体所含功能基的数目。 二单体种类 1两功能基相同并可相互反应:二元醇聚合生成聚醚 2两功能基相同,但相互不能反应,聚合反应只能在不同单体间进行:二元胺和二元按酸 聚合生成聚酰肪 3两功能基不同并可相互反应:如羟基酸聚合生成聚 一:单体的反应能力 1官能团伸类 2官能团位立留 3单体设计 【作业】p50-1

7,2线性逐步聚合反应机理 【教学内容】 7.21 官能团的等活性 7.22反应机理 7.2.3遂步聚合与连锁聚合的比较 【授课时间】1学时15分钟 【教学重点】官能团的等活性慨念:反应进程:逐步聚合与连锁聚合的比较 【教学难点】 【教学目标】 1掌挥官能团的等活性、反应进程等基本概念 2对遂步聚合与连锁聚合的正确辨析 【教学手段】课堂讲授,辅以多媒体幻灯 【教学过程】 aAa+bBb与aABb+ab 单体+单体反应速率R 平衡常数K aABb+aAa与aABAa+ab 单体+二聚体 R2 K ABh+hBh与bBaBh+ah单h+聚 R K AABb+aABbSaABABb+ab一聚体+二聚体 R Ka a(AB)w2b+a(AB)w2ba(AB).b+ab R Kn 7.2.1官能团的等活性 概念(Floy) 官能团等活性概念:反应物的两官能团的反应活性是相等的,它与分子链大小无关,与另 官能团是杏反应也无关→缩聚反应表示: a+b与 +ab. R1=R==RK1-K=.=K 依据 1实验依据(表2-2,2-3) 2理论依据 (1)化学效率 2)稀挤知率 成立条件 1真溶液 均相体系 2官能团所处环境在反应中不变 3无扩散控制 7.2.2反应机匣 一大子生成后成 1反应的逐步性 2官能团间反应:无活性中心,各基元反应活化能相同 3(大多数)为可逆半衡反应 4反应进度描术 1)转化案无意义 2)反应进程P:参加反应的官能团数起始官能团 Xn =1/(1-P) 二大分子生长终止 1热力学特征:半衡常数,黏度

2动力学限制 (1)用单官能团封端 2)反应 ①环化反应(聚合初期) 羟基酸HO(CH2).COOH 措藩:提高单体浓度降低反应温度利于线型聚合 ②官能团消去反应(聚合中后期) ③化学降解反应(聚合中后期)缩合反应的逆反应 ④链交换反应(聚合中后期)(不影响M血 且利于M均匀化 7.2.3遂步聚合与连锁聚合的比较 比较 连锁聚合 线形猫聚 活性中心 基元反应,Ea 有,各步Ea个同 无,各步Ea相同 只停?在最后阶段 可停留在任何阶段 组成 单体+大分子+微量引发剂 聚合度不等的同系物 反市进阻表示法 C% p (1)【作业】p50-2 7.3线性逐步聚合反应动力学 【教学内容】 7.3.1不可逆条件下线性遂步聚合动力学(以聚酯反应为例) 7.3.2衡逐步聚合动力学(不排除小分子) 【授课时间】1学时35分钟 【教学玉点】平衡逐步聚合动力学的动力学方程式 【教学难点】 【教学日标】 1堂程平衡遂北豪合动力学的动力学方程式 2熟悉自催化聚合 、外加催化剂聚合时的动力学特每 【教学手段】课党讲授 【教学过程】 7.3.1不可逆条件下线性逐步聚合动力学(以聚酯反应为例) 适用情况:1:K小且不断排除小分子:情况2:K很大 QH OH+HA-k OH OH 及时移走 一oH 9 及时排出水,k,k=0另外,kkk>k

→聚脂化速率R,=-C0OH_产CO1=k[COH,IOH 而CoD,lL.点=K 且K,=HLE [COOHIHA] K →%尝.wr四.款amow1-C [A] R。=k,[COOH][OH][H*] 一自催化聚合(体系中的按酸单体起自催化作用) 1方程式 RP=[COOH][OH酸催化=K[COOH]OH] Rp =-d[M]/dt=K[M] 2M2kt=1/1-P2-1 X=1+22 2动力学曲线 (1)P=0.8-0.93,符合二级动力学关系 (2)P0.93.偏离 ,外加催化剂(外加催化剂不消耗,其浓度为常量) 1方程式 Xn 1+[Mlok't 2动力学曲线 三官能团不等活性体系 7.3.2平衡逐步聚合动力学(不排除小分子) OH+ k OH K.I 起始 Co Co 0 t时刻,未除水 t时刻,部分除水 Co-C 1封闭体系(不排出水分子) Rc0-时月 2.开放体系(部分排出水分子) 飞=4c0-9念 3分析 【作业】p50-3,4

7.4线性逐步聚合反应聚合度的控制 【教学内容】 7.4.1影响线性逐步聚合反应聚合度的因素 7.4.2控制相对分子质量方法 7.4.3某一官能团过量时的定量关系 74.4综合分析与计算聚合度小结 【授课时间】2学时 【教学重点】拎制线性遂步聚合反应聚合度的方法与计算 【教学难点】某一官能团过量时的定量关系 【教学目标】 1掌握影响线性遂步聚合反应聚合度的因素及其控制方法 2运用定量关系式计算求解相关参数并提出控制方案 【教学手段】课常讲授 【教学过程】 7.4.1影响线性遂步聚合反应聚合度的因素 。反应积府 X=1(1-P) P0.5000.7500.9000.9800.9900.999 X,2410501001000 二半衡常数 1封闭体系 P=F(√R+) Xn=√K+I 2开放体系 X.-\Pn. KCo 3K的影响 三官能团过量程度越大,分子量越小 74.2控制相对分子质量方法 Xm小士需增大聚合度士在开放的环境中及时移走小分子 二不m大需控制聚合度子 1控制反应程度 2控制反应官能团的当量比 3加入少量单官能团单体 7.4.3某一官能团过量时的定量关系 一AA与B-B(过量) 1过量表示参数

D当服系威r一受 (2)过量分率g=N,-心 N (3)关系=1/(1+0) 2与r.9的关系 数均聚合度X=起始单体的AA和B-B分子总数/生成聚合物的分子总数 1+P X.-1+r-2rP X= +2 9+20-P 3讨论 结论:要狄得高聚合度,需同时使一1,P一1:「的微妙变化会引起聚合度大辐变化 二AA与B-B(等当量)+单官能团单体B 聚合度计算公式同前,但,q需调整 r-N.+2Ni N 二A-B+单官能团单体B 聚合度计算公式同前,但,q需调整 N -NAT2N g兴 四反应中r的变化 7.4.4综合分析与计算聚合度小结(学生六成) 【作业】p50-5.6,7

7.5重要线性逐步聚合物 76林刑球北聚合 逐步共聚反 逐步聚合施方法 【教学内容】 7.5重要线性途步聚合物 7.6体型遂北聚合 7.6.1基本概念 7.62预聚物 7.6.3挺胶点的控制 7.6.4线型与体型遂步聚合的比较 7.7遂步共聚反应 7.8逐步聚合施方法 【授课时间】2学时 【教学重点】体型逐步聚合基本概念:凝胶点的控制:逐步聚合施方法 【教学难点】凝胶点的控制 【教学目标】 1掌握体型遂步聚合、结构与无规预聚物、半均官能度基本概念 2通过运用公式计算确定凝胶点的控制方法 3能正确写出重要结构与无规预聚物的合成反应式 4比较四种遂步聚合方法的异同 【教学手段】课堂讲授,辅以多媒体幻灯 【教学过程】 7.5重要线性逐步聚合物 学生自学,要求掌握涤纶、聚酰胶、聚氨酯、聚碳酸酯的合成工艺与反应式 7.6体望逐步聚合 7.6.1基本概念 体型逐步聚合:山企少一种二官能团(及以上)单体参与绢聚并生成交联树状结构聚合物的 逐步聚合反应 热塑性树脂与热固性树脂 树脂 结构 热行为 溶解性 热塑性线型或支链形 可反复受热成型,成品可熔融可溶解 热固性交联树状 只可一次受热成型,成品不熔融不溶解 热固性树脂的 线型 可溶可发 甲阶PPe 凝胶化现象:在交联型筝北聚合反应中,随若黎合反应的进行,体系粘度究然增大,失去流 动性,反应及搅拌所产生的气泡无法从体系逸出,可看到凝胶或不溶性聚合 物的明显生成。 出现凝胶化现象时的反应程度叫做凝胶点(Gel Point) 网预聚物的分类(按基团在分子结构中的分布状况) 无规交联热固性树脂 结构可控热固性树脂 7.6.2预聚物

一无规循聚物 1藏催化酚醛树脂 [8-&&ed6 2醇酸树脂 oo Cg一eg 3联醛树脂 结构预聚物 1环氧树脂 awo○-ow+mr23cmc-e品CH,NOW sOOawaaoOO-ga 园化剂:多元胺、羧酸、酸仟 2不饱和聚蕾 0 +n HOCH2CH2OH 0CH2CH2-00C-CH=CH-cO 般通过加入的烯类单体如苯乙烯、甲基丙烯酸甲酯等进行自山基共聚合反应米实现 3聚秘 7.6.3凝胶点的控制 ,Carothes方法(理论要点:Xm→∞) 1官能团等当量 ∑Nf D¥均言能度了=空N ②数点P-月 2官能团非等当量 7=2×未过量官能团数 所有分子数
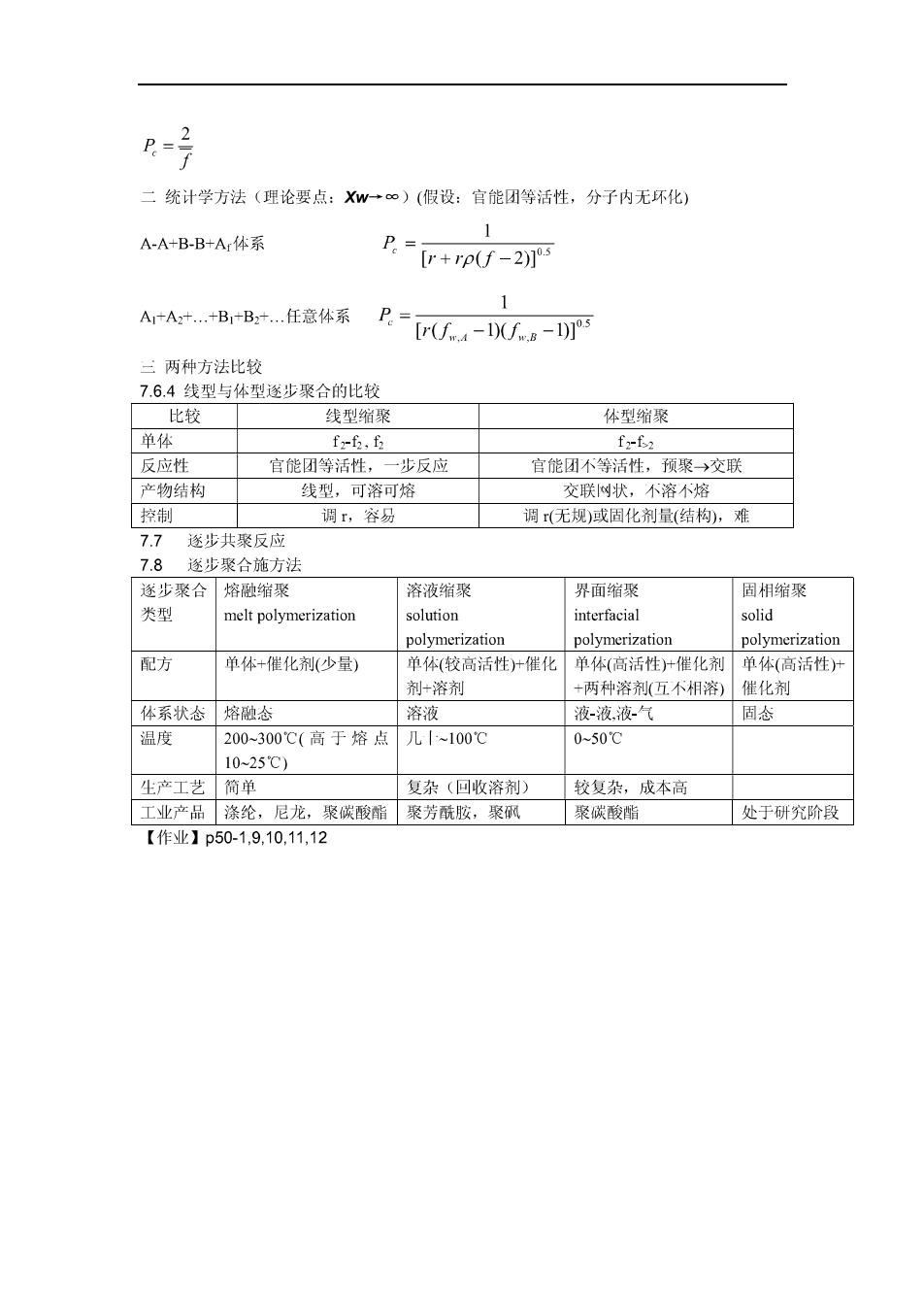
R=号 二统计学方法(理论要点:Xw一©)(假设:官能团等活性,分子内无环化) A-A+B-B+A体系 P.-r+r-2 1 A+A.+B1+B+.任意体系 R-C- 三两种方法比较 7.6.4线型与体型遂步聚合的比较 比较 线型缩聚 体型缩聚 单体 【2-2,lh 1262 反应性 宫能团等活性,一步反应 官能团不等活性,预聚→交联 产物结构 线型,可溶可熔 交联树状,不落不嫁 控制 调r,容易 调r(无规)或固化剂量(结构,难 7.7 遂步共聚反应 7.8逐步聚合施方法 燃北聚合熔融缩聚 溶液缩聚 界面缩聚 固相缩聚 类型 solution solid polymerization polymerization polymerization 配方 单体+催化剂(少量) 单体(较高活性)十催化 单体(高活性)十催化剂 单体(高活性 剂+溶剂 +两种溶剂万五不相溶催化剂 体系状盒熔融盒 溶液 液-液液汽 固 温度 200 300℃(高于熔点 几~100( 0-50'℃ 10-25℃) 生产工艺简单 复杂(回收溶剂) 较复杂,成本高 工业产品涤纶,尼龙,聚碳酸酯聚芳酰胺,聚砜 聚碳酸喵 处于研究阶段 【作业】p50 1,9,10,11,12