
第三章 自由基聚合 3.1单体的聚合能力 种化合物能否用作单体进行聚合反应形成聚合物,需从化学结构、热力学和动力学等 方面进行分析。 从化学结构看,单体必须具有两个可相互反应的官能团才有可能形战线型聚合物。逐步 聚合中发生反应的官能团通常是一些典型的有机基团,如-OH、-COOH、-COC1、NH2、-C1、 H等。连锁聚合的单体主要有烯烃(包括共轭二烯烃)炔烃、基化合物和一些杂环化合物, 烯烃聚合发生反应的官能团主要是碳一碳双键,一个n键相当于两个宫能团:而碳基化合物中 的碳-氧双键、不稳定杂环化合物的碳-杂原子键等均可视为双官能团。 聚合反应的热力学和动力学研究是相辅相成的。热力学主要研究反应的方向、限度、平 衡等问题。在考忠某一化合物能否聚合时,需先做热力学分析。对热力学研究表明是不可能 的反应,没有必要进行动力学研究。因为一个没有推动力的反应,阻力再小也是不可能的 α-甲基苯乙矫在0℃常压下可以聚合,但在65℃以上需加压才能聚合:甲醛很容易聚合, 但乙醛在常温常压下却不能聚合:三、四元环单体容易聚合,而五、六元环的化合物则很难 聚合;在缩聚反应中,由于平衡的原因使单体残留于聚合物中,这些都属于热力学问题。动 力学主要研究反应的速度、机理等问题。热力学上可行的反应,动力学上不一定可行。常温 常压下,如没有引发剂,乙烯、丙烯不能聚合:异丁烯中只能通过阳离子聚合得到聚合物, 而苯乙烯却可通过多种聚合历程得到聚合物,这些都属于动力学问题。对于热力学可行的反 应,可通过动力学研究选择一个最佳的反应途径,以降低其反应活化能,加快反应速度,缩 短达到或接近平衡的时间。 3.1.1聚合热力学 聚合热力学主要研究聚合过程中能量的变化,进而判断单体聚合的可能性单体发生聚 合的热力学条件(如温度、压力):以及单体转化为聚合物的限度(最高转化率)等。 单体能否转变为聚合物,可由自由焓变化来判断。对于聚合反应,单体是初态,聚合物 是终态。根据热力学第二定律,自由能的烙、熵表达式为: △G=△H-T△S (3.1) 式中△G一聚合时自由能的变化(kJ/mol) △H一聚合时的烙变(kJ/mol) △s一聚合时的熵变(J/mol·K) T一热力学温度(K) 由式3-1可知,若聚合物的自由能比初态的单体自由能低,聚合反应可以自发发生,△G为 负值:反之,如聚合物的自由能大于起始单体的自由能,则△G为正值,聚合物将降解为单 体,即发生解聚反应。△G=0时,聚合和解聚处于可逆平衡状态。 以△G作为聚合反应能否进行的判,有以下几种情况: a.△H0此时△G总是负值,聚合反应在任何温度下都能发生。这类例子很

少,如结晶四聚甲醛聚合为晶态聚甲醛(△H=-3.32kJ/mol,△S=3.41kJ/mol). b.△H>0,△S0,△S>0这种情况极少,如S环的聚合反应(△H=31.8kJ/mol,△S=13.8 k/mol)。与前一类相反,体系存在一个热力学最低聚合温度。 3.1.1.1聚合热 在聚合反应中的热效应称作聚合反应热,即聚合焓变△H。单体转变为聚合物的过程, 般为放热反应(△H<0)。根据热力学定律: △H=△E-P△V (3-2)》 对于多数聚合反应来说,尽管在聚合过程中有少量的体积收缩,但总体看可以忽路不计,即 △V≈0。因此聚合热相当于分子内能的变化,△H=△E。内能的变化可由三部分组成:键 能的变化、共轭、空间张力。由于键能的变化在内能的变化中起主要作用,因此可用聚合反 应前后键能变化的理论计官值来估算聚合执。 不饱和单体如烯类单体的聚合包含有一个n键的衡断裂,两个σ键的生成。打开一个双键 所需能量为609.2kJ/mol,形成一个单键放出的能量为-351.7kJ/mol,总的能量变化为: △H=2E。-E,=2×(-351.7) -(-609.2)=94.2kJ/mo 缩聚反应中,聚合热是其反应物在化学键重新组合时键能的变化值。如聚酰胺的聚合热可 由醋酸和氨的反应热进行估算: CHCOOH +H-NH2-CH;CONH2 +H-OH △H=-(E-十E十E+E)=-(304.8+463.1-358.0-391.1)=-18.8kJ/mol 几种不饱和单体聚合时键能的变化如表3-1所示。 表3-1几种不饱和单体聚合时健能的降低 链形(K/o1) 预计的聚合热(k/o1)■ C-N(615.5)→-CN304.8 23 从表3-1所列数据看,含C-0双键的醛或制类单体,聚合时的△H为正值,已知它们的 △S为负值,这似乎表明醛、酮类单体的聚合在热力学上是不可能的,但实际上,除丙酮外 醛类如甲醛、甲基丙烯醛等的△H均为负值,可以聚合。这说明用键能来计算聚合热并据此 判断单体能否聚合不够准确,还需要考虑共轭、空间张力等因素。后两者影响较小,需具体 问题具体分析。如共轭影响,要具体比较单体和聚合物重复单元共轭能的大小,因为反应总 是向生成共轭能大的产物方向进行。 乙烯的△H=-88.8kJ/moL,与计算值相差不大。但乙烯衍生物烯类单体的△H值却在 -30~-160kJ/o1之间波动。这种差异主要由下述原因引起: (1)取代基的位阻效应

聚合物链上取代基之间的空间张力使聚合热降低。这是由于取代基的空间效应对聚合物 的影响程度大于单体,当单体转变为聚合物后,原本可以在空间自由排布的取代基在聚合物 中受主链化学键的约束而挤在一起,免不了有键角的变化,键长的仲缩,非键合原子间的相 互作用等因素,从而心贮藏了部分内能,使聚合热有较为明显的下降。 实验事实证明,取代基的空间位阻张力能与取代基的范德华半径有关,与原子半径无关。 取代基数量的多少比其位置更重要,如a,B-二取代基之间的斥力不比a,a-二取代的大, 前者不易聚合主要是由于动力学原因,即单体分子接近活性中心时遇到了位阻障得。另外, 取代基对羰基的影响比碳碳双键大。 表3-2空间位阻对聚合热的影响 聚合热kJ/ol) 乙烯 -88.8 丙烯 -81.6 异丁烯 -54.0 苯乙烯 -69.9 口-甲基苯乙烯 -35.2 丙烯酸甲 甲基丙烯酸甲酯 留 甲醛 -21.0 乙醛 0 丙酮 25.1 (2)共轭效应 午名不物和单体的取代堪由干与不物和建形成共氟或超共郁而付单体有稳定作用,但形 成聚合物后,不饱和键的消失使共轭作用下降,导致由共轭产生的稳定作用明显下降。由共 轭或超共轭造成稳定能的不同使聚合热下降,降低的程度相当于单体的共振能。 苯乙烯为单取代乙烯,苯环与碳碳双键有共轭效应,因此苯乙烯聚合热(69.9kJ/1)较 计算值低。对α-甲基苯乙烯来说,苯基的共轭效应、甲基的超共轭效应、两个取代基的位阻 效应对聚合热的影响,方向一致,三者叠加,使聚合热大大降低(-35.2k灯/1)。 当取代基的共轭效应很弱或不存在时,如醋酸乙烯酯,聚合热与乙烯基本相似。 (3)强电负性取代基 当不饱和单体的碳-碳双键上带有电负性强的取代基时,聚合热往往比理论值高出许多。 如氟乙烯(-95.8k灯/o1入硝基乙烯(-90.8k灯/ol1)、俯二氟乙稀(-129.2kJ/o1)、四氟乙 烯(-154.8k/ol)等 对这种现象有几种解释。一种认为是由于聚合后强电负性基团上非键合电子间斥力减少: 种认为可能是由于分子间缔合作用使聚合物的稳定性增加:对四氟乙烯则认为可能是由于 氟原子范德华半径小,降低了氟原子间的斥力或可能与含氟烃类中碳碳键能较大有关。 (4)氢键和溶剂化作用 总体看影响小于以上三类,趋势上是使聚合热降低。主要是由于游离单体分子中氢键的 缔合作用比之相应聚合物中要强。如丙烯酸(67.0kJ/o1)、甲基丙烯酸(←42.3k/o1)在

很稀的水溶液或醇溶液中聚合氢键的影响可以显著地减少,比缔合液态时的聚合热要高出 12.6~209k/ol 3.1.1.2聚合嫡 体系嫡是该体系的统计几率或无序程度的量度。体系中分子、原子的排列和混合程度的 无序程度变大,熵值增加:反之,熵值降低。聚合反应是许多小分子单体通过共价键结合成 大分子的过程,体系无序程度下降,因而聚合反应是熵减过程,即△$<0。相反,由一个大 分子降解为单体或低聚合物的过程是嫡增过程。 气态单体的熵可以看为是其平动嫡S、外转动熵S、振动嫡S,和内振动熵S之和,即: S=S+S+S+S。而聚合物的熵只含有振动熵S和内振动熵S,二项值的增加大致与所 失去的外转动嫡相抓,因而聚合反应的熵减大致为聚合后失去的平动熵值。从实验数据看, 单体的结构,如共轭作用的大小、取代基的体积和数量等对单体的熵值姥响不大。可以认为 熵值是一个与结构无关的热力学函数,对烯类单体来说,△S大都在-100~-125JoK。 3.1.1.3聚合上限温度 对于大多数单体的聚合反应,△H<0,△S<0,要想使聚合反应正常进行(△G<0), 反应温度(T)的作用就非常重要了。 当聚合和解聚处于平衡状态时,△G=0,则△H=T△S。这时的反应温度称为聚合上限 温度(ceiling temperature),记为T。。高于这一温度,聚合反应无法进行。在热力学研究中, T。是一个重要参数 △T T.=AS (3-3) 严格来讲,任何聚合反应都是平衡反应。当温度达到T时,链增长与解聚达到平衡。即: Kp M·+M 两反应的速率方程为: Ro=kp[Ma:][M] (3-4) R=kM1 (35) 达平衡时,两反应速度相等 ko[Me:][M]=kdp[Mo+r] (3-6) 如果聚合度很大,则M·]=M1·】。此时平衡常数K与平衡单体浓度M间关系为: K=k、1 (3-7) kd IMI 在标准状态下: △G=△f一T△s=-RT1nk=RT1n[M0. (3-8) 平衡时,△G=0,T=T,则: T.= (3-9) △S9+RIn[M]. 或 -会-A9 (3-10)
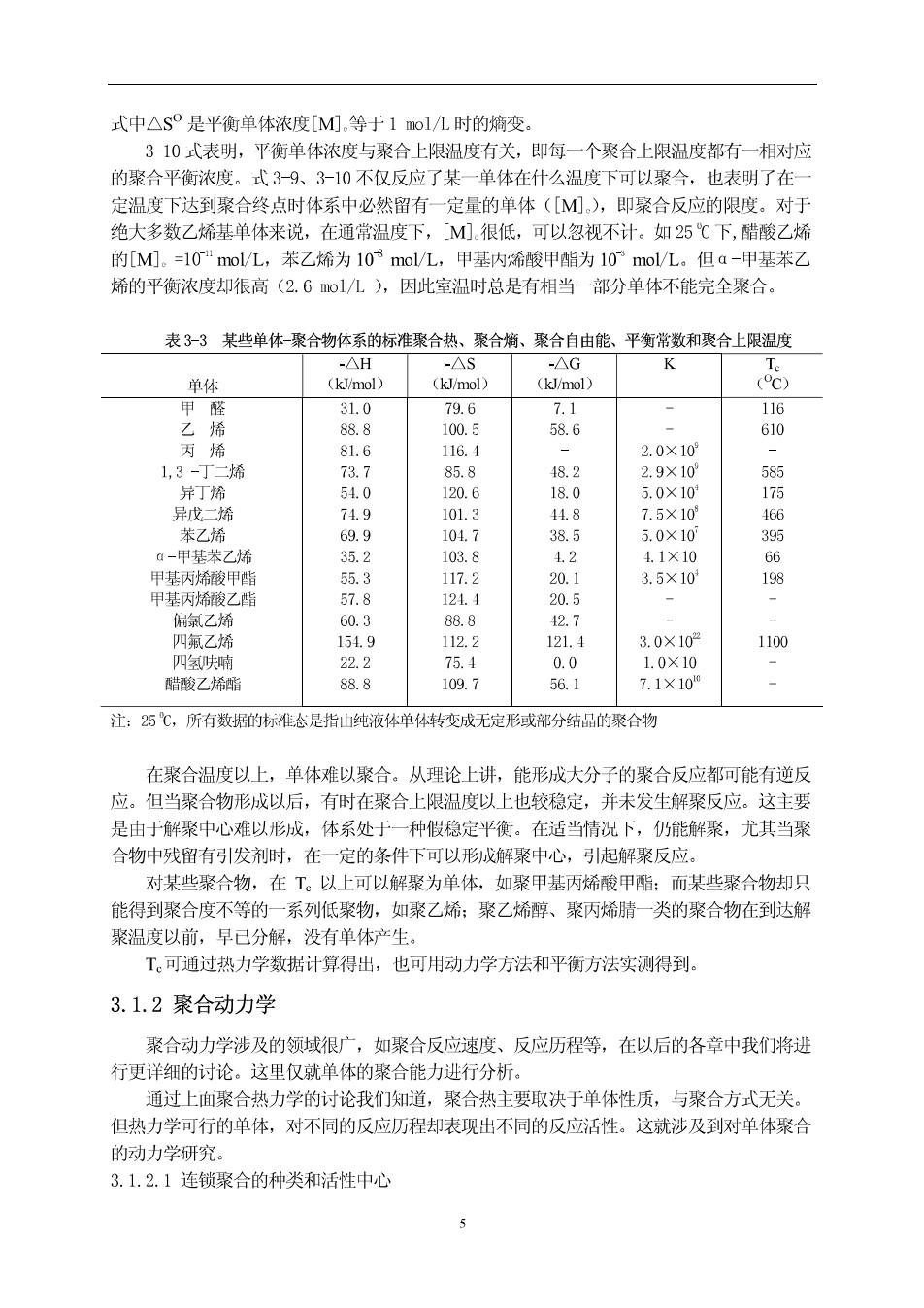
式中△s是平衡单体浓度[M).等于1mol/L时的熵变。 3-10式表明,平衡单体浓度与聚合上限温度有关,即每一个聚合上限温度都有一相对应 的聚合平衡浓度。式3-9、3-10不仅反应了某一单休在什么温度下可以聚合,也表明了在一 定温度下达到聚合终点时体系中必然留有一定量的单休([M),即聚合反应的限度。对于 绝大多数乙烯基单体来说,在通常温度下,[M)很低,可以忽视不计。如25℃下,醋酸乙烯 的[M.=10"mol/L,苯乙烯为10$mol/L,甲基丙烯酸甲酯为10°mol/L。但a-甲基苯乙 烯的平衡浓度却很高(2.61/L),因此室温时总是有相当一部分单体不能完全聚合。 表3-3某些单体-聚合物体系的标准聚合热、聚合、聚合自由能、平衡常数和聚合上限温度 单体 16 58.6 610 2.0×10 丁二烯 585 异丁 120 175 异戊二烯 101.3 75×10 166 茉了搭 6g g 1047 385 50×10 395 a-甲基茶乙摇 35.2 103.8 1. 1.1×10 G66 甲基丙烯酸甲酯 55.3 117.2 20.1 3.5×10 198 甲基丙希酸乙酯 57.8 121. 20.5 2.7 3.0×10 1100 2 109.7 69 7x10 注:25℃,所有数据的标准态是指山纯液体单体转变成无定形或部分结品的聚合物 在聚合温度以上,单体难以聚合。从理论上讲,能形成大分子的聚合反应都可能有逆反 应。但当聚合物形成以后,有时在聚合上限温度以上也较稳定,并未发生解聚反应。这主要 是由于解聚中心难以形城,体系处于一种假稳定平衡。在适当情况下,仍能解聚,尤其当聚 合物中残留有引发剂时,在一定的条件下可以形成解聚中心,引起解聚反应。 对某些聚合物,在T。以上可以解聚为单体,如聚甲基丙矫酸甲酯:而某些聚合物却只 能得到聚合度不等的一系列低聚物,如聚乙烯:聚乙烯醇、聚丙烯晴一类的聚合物在到达解 聚温度以前,早已分解,没有单休产生。 T。可通过热力学数据计算得出,也可用动力学方法和平衡方法实测得到。 3.1.2聚合动力学 聚合动力学涉及的领域很广,如聚合反应速度、反应历程等,在以后的各章中我们将进 行更详细的讨论。这里仅就单体的聚合能力进行分析 通过上面聚合热力学的讨论我们知道,聚合热主要取决于单体性质,与聚合方式无关。 但热力学可行的单体,对不同的反应历程却表现出不同的反应活性。这就涉及到对单体聚合 的动力学研究。 3.1.2.1车饰聚合的种类和活性中心

有机化合物发生化学反应时,总是伴随着一部分共价键的断裂和新的共价键的形成。共 价键的断裂可以有两种形式:均裂和异裂 均裂时,两个原子间的共用电子对均匀分裂,两个原子各保留一个电子,形成具有不成 对电子的原子或原子团,称为自由基(游离基) R|R→2R 异裂时,两原子间的共用原子对完全转移到其中的一个原子上,异裂的结果是产生带正 电荷或带负电荷的离子。 A:BA+B" 在聚合反应中,活性中心为自由基的聚合反应称为自由基聚合(radical polymerization)。所用引发剂称为自由基引发剂。 H R+CH2-CH-R-CH2-C 活性中心为阳离子(带正电荷)的聚合反应称为阳离子聚合(cationic polymerization)。 所用引发剂称为阳离子引发剂。 H R+CH2-CH→R-CH- OCH3 OCH: 活性中心为阴离子(带负电荷)的聚合反应称为阴离子聚合(anionic polymerization)。 所用引发剂称为阴离子引发剂。 R+CH-CH-NO2→R-CH-C NO2 NO 阳离子聚合和阴离子聚合也称离子型聚合(ionic polymerization)。属于离子型聚合的还 有配位聚合(coordination)等 聚合历程不同,活性中心不同,对应的聚合体系(单体、引发剂、聚合条件等)不同, 动力学行为亦不相同。如自由基聚合的反应活化能一般为20一80kJ/mol,而阳离子聚合反应 的反应活化能则多为20~40kJ/ol. 3.1.2.2单休对聚合类刑的洗择及聚合能力 热力学上可行的单体对能引起它们们聚合的活性中心类型有不同程度的选择,在许多情况 下,对某类单体只能用某一类引发剂,经某一特定的反应历程才能得到动力学上可行的聚合 反应 单体对聚合类型的选择及聚合能力主要受下述因素影响: 一诱导效应 。电子效应 一内因(单体化学结构) 共轭效应 影响因素 (空间效应 外因-温度、压力、聚合方法等 (1)取代基的电子效应 6

取代基的电子效应包含诱导效应和共轭效应,对于单取代不饱和单体,C-C-X: a.X为-H,即乙烯。热力学分析表明可以发生聚合反应(△G=-58.6kJ/mo1)。但从 动力学看,由于没有取代基,无电子效应,加之结构对称,聚合因难。目前乙烯的聚合,或是采 用高温、高压的自由基聚合,或是采用特殊催化剂的配位聚合。 b.X为供电子基团,如-R,-O基团。这类单体由于取代基的推电子作用,使单体双键 处电子云密度增加: H 6 R+CH2CH→R-CH-C OR OR 故不利于自由基聚合。但双键处电子云密度的增加,便于阳离子进攻形成单体阳离子,同时 O的准电子作用使形成的活性中心稳定,进而利于进行阳离子聚合。对于丙烯,由于只有 个推电子基团,作用弱,不能进行阳离子聚合。如采用自由基聚合,则因自由基容易从丙 烯分子中提取氢,形成活性低的烯丙基自由基而只能得到低聚物,因此丙烯只能采用特殊催 化剂的配位聚合 CH2-CH-CH RH+CH2=C H-C'H c.X为吸电子基团,如-NO2,CN基团。这类单体取代基的吸电子作用使单体双键处的 电子云密度下降: H R+CH CH-R-CH-.C- NO 同样不利于自由基聚合。但双键处电子云密度的降低,便于阴离子进攻形成单体阴离子,同 时-NO2的吸电子作用使形成的活性中心稳定,进而利于进行阴离子聚合。 总体看,带有强供电子取代基的单体易于进行阳离子聚合,带有吸电子取代基的单体易 于进行阴离子聚合。对于自由基聚合来说,由于带有独电子,易于与有吸电子基团的、双键 上电子云密度较低的单体相互作用: H R+CHCH→R-CH-C c 除非取代基吸电子作用太强而只能进行阴离子聚合,如硝基乙烯,二氰基乙烯等,多数能进 行阴离子聚合的单体也能进行自由基聚合。相反,能进行阳离子聚合的单体多数不能进行自 由基聚合。 山.共轭效应最典型的例子是带有”一共轭体系的单体,如苯乙烯、丁二烯、异戊二烯。 由于π电子可以沿π一π体系流动,易于诱导极化,可以很容易地按自由基、阳离子、阴离子 三种历程进行聚合。 取代基电子效应的影响有叠加性。有时方向一致,作用加强,如1,1-二氰基乙烯。有时 方向相反,作用互抵。如氯乙烯,C的诱导作用和共轭作用相反,一般只能进行自由基聚 合。具有同样情况的还有醋酸乙烯。 按照单烯HC-CHX中取代基-X电负性次序和聚合倾向的关系排列如下: 取代基-X:

一阳离子聚合 NO2-CN -F -CI -COOCH]-CONH2 -OCOR -CH-CH2 -CoHs -CHs -OR 一自由基聚合 阴离子聚合 (2)取代基的空间效应 取代基的数量、体积、位置等对单体的聚合能力均有很大影响 a.单取代由于只有一个取代基,空间位阻小,即使取代基的体积较大,仍可聚合,如 N-乙烯基咔唑。 b.L,1-二取代当取代基体积不大时,一般都能按相应的历程进行聚合反应。由于结构 不对称,极化程度上升,比单取代单体更易聚合。如异丁稀很容易进行阳离子聚合,而丙烯 则只能采用特殊的催化剂进行配位聚合。甲基丙烯酸甲酯和二氟乙烯除可自由基聚合外 还可进行阴离子聚合。 如果两个取代基都很大,则无法聚合。如1,1-二苯基乙烯,正常聚合所形成的四个相邻 大体积苯环的空间阻力和张力可使碳一碳键断裂,因此只能形成二聚体。 c1.2-一取代如C1CH-CHC1.CH-CH=HCH.CHCH=CHC0OH.这类单体结 构对称,空间位阻大,尽管热力学可行,但反应中单体分子接近活性中心时会遇到大的位阻 障碍,阻碍了聚合的进行。另一方面,这类单体的电子效应往往互抓,降低了极化度。 选择空间位阻小的单体与这类单体共聚,是充分利用这类单体的一个有效途径。如顺丁 烯二酸酐不容易均聚,但可与苯乙烯进行交替共聚。另外,近来研究表明具有1,2-二取代乙 烯结构的五元环状单休能进行自由基聚合 d.三取代,四取代取代基过多,空间位阻大,一般不能聚合。但如取代基体积很小. 则可以聚合。最典型的例子是氟代乙烯,即使是四氟乙烯亦能聚合 表3-4常用烯类单体对聚合类型的选择性 CH-CHPHE 阴离子聚合 配位聚合 CH:-CHCH 8 CH.-CHCH-CH: 8 8 CH,-CHCHs + CF:-CF: CHCH-OR CH:=CHOCOCH =CICH )COOCH CH,-CHCN 。一已工业化.+—可以聚合

醛、时中碳基双键和杂环化合物中碳-杂原子键异裂后,具有类似离子的特性,可进行阳 离子或阴离子聚合 以上只是从热力学和动力学两方面对单体聚合能力定性地进行了分析,由于多种因素同 时存在,相互影响,且很多数据不全,因此实际应用中一般需要通过实验来判断和验证单体 能否进行聚合。 3.2碳自由基 自由基聚合在高分子化学中占有极其重要的地位。是人类开发最早,研究最为透彻的一种 聚合反应历程。目前60%以上的聚合物是通过自由基聚合得到的,主要品种有低密度聚乙烯、 聚苯乙烯、聚氯乙烯、聚甲基丙烯酸甲丽、聚丙烯腈、聚醋酸乙烯、丁苯橡胶、丁腈橡胶、 氯丁橡胶等。通过对自由基聚合历程的深入研究,如活性中心的产生和性质、基元反应的机 理、动力学与热力学、相对分子质量与相对分子质量分布等问题的研究,为其它类型聚合反 应的研究提供了比较和借鉴。 自由基聚合的活性中心主要是碳自由基,从这点上可以说自由基聚合是有机化学中碳自 由基反应的延仲,如自由基的生成与链引发反应、自由基的活性与聚合反应速率、自由基的 结构与聚合物链立构控制能力、自由基的反应与聚合过程中的链增长、链终止及各种链转移 反应等,因此有必要重温一下有关自由基(主要是碳自由基)的基本知识。 3.2.1自由基的产生 在原子、分子或离子中,只要有未成对的电子存在,都叫自由基。如原子自由基(Na H)、分子自由基[O-N,O-O,(CH),C]、离子自由[CH-C(CHh,CH.CHCH 有很多方法可以使共价键发生均裂生成自由基,在聚合反应中应用最多的是热解、氧化还原 反应、光解、辐射等方法。这些将在下一节加以详细介绍 3.2.2自由基的结构与活性 碳自由基有两种结构:一种是平面构型,碳原子自由基为s杂化,三个s0杂化轨道与 其它三个原子成共价键,未配对电子占据p轨道:另一种是角锥型,碳原子自由基为s杂 化。一般平面型结构要稳定些。 R R ⊙±⊙>( R 自由基的寿命一般很短,在有机化学中为一种活性中间体。自由基中心原子上未成对电 子的存在,使其有强烈地取得电子的倾向,这就是自由基的活性所在。影响自由基活性的主 要因素是共新效应、极件效应和空间位阳」 一般来说,具有共轭或超共轭作用的自由基,活性低于无共轭作用的自由基。这是由于 共轭作用使未成对电子的电子云密度下降的缘故。同理,当取代基的吸电子效应加大时,自 9

由基的活性下降。大体积取代基的有在妨碍了反应物的靠近,降低了反应活性。各种自由基 的相对活性顺序大致为: H>CHa>CsHs>CH-R>CHR2>CR1>CH(OR)R CH(CN)R>CH(COOR)R>-CH-CH-CH CH2-CoHs>CH(CoHs)>C(CoHs)s 最下一行的自由基十分稳定,为不活泼自由基。如三苯甲基自由基,可长期稳定存在。 3.2.3自由基的反应 自由基有多种反应,在自由基聚合反应中能遇到的有关自由基的反应主要有: (1)加成反应这类反应多出现在引发反应和增长反应中。 R+CH-CH-X→R-CH-CH-X (2)氧化-还原反应这类反应多出现在引发反应中。 Fe2++OH→Fe++OH (3)偶合反应这类反应多出现在终止反应中。 R.+RRR (4)抽氢反应这类反应也多出现在终止反应中。 R-'CH2+Rz-CHz-'CH2R-CH3+Rz-CH=CH2 3.3自由基聚合的基元反应 自由基聚合属于链式聚合的一种。1935年,Staudinger提出正常的聚合反应含三个基元 反应:链引发反应、链增长反应、链终止反应。后米的研究表明还存在第四个基元反应,链 转移反应。 3.3.1链引发反应 链引发反应(chain initiation)是形城单体自由基的反应。在实现自由基聚合时,首先要求 在适宜的条件下以适当的速率生成有足够活性的自由基。目前常用的形成自由基的方法中, 应用最多的是采用引发剂。时至今日,开发与选用合适的引发剂仍是自由基聚合研究的一个 重要方面。此外,热引发、光引发和辐引发也占有一席之地。 对常用的引发剂引发来说,链引发反应分为两步: a.引发剂I分解,形成初级自由基(primary radical)R: b.初级自由基与单体M加成,形h成单体自由基(monomer radical)M: R.+M-RM- 引发剂的分解是吸热反应,反应活化能高,约为100~170kl:反应速率小,分解速 率常数约为10~10$。初级自由基与单体反应的一步是放热反应,反应活化能低,约20~ 34 kJ/mol,反应速率大。由于体系中存在某些杂质,或因其它一些因素,反应开始形成的初 级自由基在与单体反应前,有可能发生一些副反应而失去活性。只有当杂质被消耗掉并形城 单体自由基后,下一步链增长反应才有可能发生。因此链引发反应必需包括上述两步反应