
第四章 离子型聚合 4.1碳离子 自19世纪人们就开始了对离子聚合的研究,由于实现离子聚合比自由基聚合 要困难得多,直到20世纪50年代对离子聚合的研究及应用才得到较大发展。阴 离子聚合首先实现了活性聚合,为聚合物结构与性能的关联开辟了道路,打开了 聚合物设计合成的大门。其后阳离子聚合在可控聚合方面的发展为适用于阳离子 聚合的单体的精细合成开辟出新天地 离子聚合的活性中心是碳离子(碳阳离子与碳阴离子),对碳离子的研究有利 于对离子聚合机理、聚合物形成原因、聚合反应影响因素等的研究。 4.1.1碳阳离子 阳离子聚合的活性中心可以是C、Si、、P、O、S、Se等。其中碳阳离子在 高分子化学中应用最多。 4.1.1.1碳阳离子的产生 含有带正电荷的三价碳原子叫做碳阳离子。有多种生成碳阳离子的方法,通 常碳阳离子可用两种方法形成: 直接裂解,即与碳原子相连的原子或原子团带着一对成键电子裂解出去。 RX4R++X” 质子或其它带正电荷的原子团与不饱和体系的一个原子加成,使其相邻的碳 原子带正电荷。 -C=Z+H→C-Z-H 4.1.12碳阳离子的结构与活性 碳阳离子的价电子层仅有6个电子,可有两种结构:一种是平面构型,为p 杂化:另一种是角锥型,为sp杂化。 R、Q -R R.AE R 一般平面型结构要稳定些,这可能是平面构型中和碳阳离子相连的三个原子 团在空间可进一步仲展,且sp2杂化比sp杂化具有更多的s轨道成份的缘故。由 于碳阳原子的缺电荷性,因此任何使碳阳离子电子云密度增加的结构均会使碳阳 离子的稳定性增加。从诱导效应看,供电子基团的增加有利于碳阳离子的稳定: (CHa)aC*>(CHa)2C"H CHaC"H2>HaC* R2N-C*H2>RO-C*H2 CoHs-CH2>RCH2=CH-C*H2 CH3C*H2>H3C*

随共轭作用的加大,碳阳离子的稳定性增加: CH3 -c >-c 当然还有一些其它姥响因素,如反离子、溶剂等。 4.1.1.3碳阳离子的反应 碳阳离子通常为寿命很短的活泼中间体,可按多种方式进行反应,有一些反应 得到稳定产物,另一些反应则生成另外的阳离子。在阳离子聚合反应中能遇到的 有关阳离子的反应主要有: (1)亲电加成这类反应多出现在引发反应和增长反应。 R+一C=C-→R一C-C+ (2)重排反应这类反应多出现在增长反应,使大分子链结构发生异构化。 CH3 CH3-C-C"H2 CH3-C*-CH2-CH3 CH (3)由相邻原子失去一个质子这类反应多出现在终止反应和链转移反应。 C'-C-H--C-C-+H (4)与具有电子对的阴离子结合,这类反应多出现在终止反应。 R+X→R-X 4.1.2碳阴离子 阴离子聚合活性中心可以是碳阴离子、氧阴离子、硫阴离子等,常用的是碳 阴离子。 4.1.1.1碳阴离子的产生 含有未共亨电子对的三价碳原子叫做碳阴离子。有多种生成碳阴离子的方法, 通常碳阴离子可用两种方法形成: 直接裂解,即与碳原子相连的原子或原子团不带着它的一对成键电子裂解出 去。 R—HR+H+ 阴离子和碳碳双键或参键的加成,阴离子加在双键中的一个碳原子上,使另 一个碳原子带负电荷。 C-C-+Y--C-C-Y 4.1.1.2碳阴离子的结构与活性 碳阴离子有两种构型,一种是sp杂化的角锥型,另一种是sp2杂化的平面型

0 R日 -R R R R 一般碳阴离子为角锥型,未共享电子对占据四面体的一个顶点,与氧及胺类 相似,角雏型结构可以通过中心碳原子的再杂化,由sp3转变为sp再转变为p 发生构型翻转。当与中心碳原子相连的基团可与其形成共轭结构,如三苯甲基阴 离子,则因共轭作用而成平面型结构。 与碳阳离子相反,由于中心碳原子含有未共享电子对,因此任何使碳阴离子 电子云密度降低的结构均会使碳阴离子的稳定性增加。从诱导效应看,吸电子基 团的增加有利于碳阴离子的稳定: H3C>CH;CH2 >(CH3)2CH (CH3)3C 随共轭作用的加大,碳阴离子的稳定性增加。 反离子、溶剂等一些其它影响因素也会对碳阴离子的活性产生影响。 4.1.1.3碳阴离子的反应 阴离子有多种反应,在阴离子聚合反应中能遇到的有关阴离子的反应主要有: (1)亲核加成这类反应多出现在引发反应和增长反应。 R+C-C-→R-C-C (2)亲核取代 / R+C-X一RC+X (3)重排反应这类反应多出现在增长反应,使大分子链结构发生异构化 Na" -C-CH,Cl+Na→Φ-C-CH2-Φ 4.1.3活性中心状态 离子聚合和自由基聚合的根本不同就是生长链末端性质的不同,即活性中心 不同。离子聚合活性中心的特征在于: 离子聚合的生长链带电荷,为了抓消其电荷,在活性中心近旁就要有一个带 相反电荷的离子有在,称之为反离子(gegenion)或抗衡离子(counterion),当活 性中心与反离子之间得距离小于某一个临界值时被称作离子对(ion-pair)。反离子 及离子对的存在对整个链增长都有影响。不仅影响单体的的聚合速度,聚合物的 立体构型有时也受影响,条件适当时可以得到立体规整的聚合物。 活性中心和反离子的结合,可以是共价键、离子键、乃至自由离子等多种形 式,彼此处于平衡状态:

BA±BAB∥A±B+A IV (4-1) 式(4-1)中,I为共价物种(covalent species),它通常是非活性的, 般可以忽略。Ⅱ和Ⅲ为离子对,引发剂绝大多数以这种形式存在。其中,Ⅱ称作 紧密离子对(intimate ion pair),即反离子在整个时间里紧靠着活性中心。Ⅲ称作 松散离子对(loose ion pair),即活性中心与反离子之间被溶剂分子隔开,或者说 是溶剂化。W为自由离子(free ion)。通常在一个聚合体系中,增长物种包括以 上两种或两种以上的形式,它们彼此之间处于热力学平衡状态。 4.2阳离子聚合 阳离子聚合(cationic polymerization)是指链增长活性中心是阳离子的聚合反 应,聚合反应通式可表示如下: BA+M一BM+AM十M 4.2.1阳离子聚合的单体 适合阳离子聚合反应的烯类单体,其分子取代基(X)多属给电子基团,即X =R一,RO一等。另外,阳离子聚合有一个特点,即阳离子活性中心在聚合过程 中会发生异构化,使空间阻碍较大的单体也能聚合,并生成稳定的活性中心(详 述见4.1.1.2部分)。 阳离子聚合的单体有以下二类: (1)有供电子取代基的烯类单体 CH H,C=C CHa HC=CH2 H,C=CH H,C=CH-CH-CH2 (2)环状单体 H2C—CH2 HCCH2 H2C、CH2 H2C-CH-CH3 CH:-O-CHz 0 0 CHo

4.2.2阳离子聚合的引发体系和引发反应 阳离子聚合的链引发过程与自由基聚合同样包括二个步骤:初始阳离子(质 子或碳阳离子)的形成:初始阳离子与烯类单体反应,生成聚合活性中心。初始 阳离子的生成方法可以大致分为化学方法和物理方法二大类,前者应用较多:后 者主要有高温辐射引发、电子引发等。阳离子聚合用的引发剂均为亲电试剂,主 要有以下几种。 42.2.1质子酸 常见的质子酸有:HC1、HBr、HSO4和HCIO4等。这些酸在溶液中电离产生 H,由它与单体的双键加成,形成活性中心一单体阳离子。其引发过程为: HAHA R R H'A+H,C=C →H-CH2C+A R R 质子酸引发单体和聚合的能力取决于酸与负离子的亲核能力,这是质子酸引 发成败的关键。酸既要能产生质子,同时负离子的亲核性又不能太强:否则极易 与~~C*结合,形成共价键而造成终止: R R H-CH-C+A 李H-CH2C-A R R 负离子亲核性不能太强的这一前提,通常限制了大部分强酸作为正离子引发 剂的应用,总体上讲,氢卤酸不能引发烷基取代的烯烃聚合就是这个道理。其它 的强酸如硫酸、磷酸、高氯酸、氟代或氯代磺酸、甲磺酸、三氟甲磺酸等可以用 于阳离子聚合反应,但通常得到的产物为低分子质量的聚合物,相对分子质量 般不超过几千。由烃制得的低相对分子质量聚合物在工业上被用作内燃机燃料、 润滑剂等。 采用质子酸作引发剂,要得到高相对分子质量聚合物可以从以下几方面改进: ①选择活性较大的单体如N-乙烯基咔唑,在甲苯溶剂中用HC1引发可以 得到高聚物。 ②采用极性溶剂溶剂的极性越大,越容易稳定离子对(或离子),阻碍了 正、负离子间的成键作用。Throssell等用CH;COOH引发苯乙烯聚合,发现将 CH;COOH加到苯乙烯中去,不发生聚合:反之,将苯乙烯加到CH3COOH中去可 获得高聚物。在前一种加料次序下,苯乙烯一方面作为单体,另一方面又作为反 应介质。由于它的极性小,不能使活性中心稳定,故不能聚合。后一种情况下, 极性很大的CH,COOH起着溶剂的作用,故使聚合反应顺利地进行。 ③降低聚合温度降低聚合温度有利于活性中心的稳定,如CF3COOH引发 苯乙烯时,50℃下仅得二聚体,0℃下可得到数均相对分子质量为1000的聚合物

④加入某些金属或其氧化物异丁烯乙烯基醚用HC1引发时不能聚合,只能 发生加成反应。若在反应体系中添加Ni、Co、Fc、Ca或有关的氧化物VOs、PbO 或SO,等即可聚合。这些添加剂可促进HC1电离,且与CI络合使之稳定,这样 就遏止了亲核能力较强的负离子与活性中心的成键反应,而使聚合反应能顺利进 行。 4.2.2.2 Lewis酸 它们都是Friedel-Crafts催化剂,是缺电子的无机化合物,阳离子的主要催化 剂。从工业的角度讲,Lws酸是阳离子聚合反应的最重要的引发剂,可以应用的 Lewis酸包括金属卤化物(如BF3、AICl、AIBr、TiCL4、SnCl4、SbCL、PCls ZnC2)和金属卤氧化物(如POCl,、CrO2Cl、SOCl2、VOCl3)。该类引发剂可以 用于合成高相对分子质量的聚合物 (1)生引发剂一助引发剂体系 使用这类引发剂对要加入共引发剂(或称助尼引发剂)作为质子或碳阳离子的 供给体,L©ws酸能将共引发剂上的未共用电子对通过配位键跃近到它的空轨道上 来,生成加成空物,称为酸一成络合物,或简称络合物。 常见的共引发剂体系举例如下: -H'(BF OH) CHa CH AICL3+H,C-CCI=H,C—C+(AICL,) CHa SnCl,+RCl-±R(snCl5) BF3+(C2Hs)20产C2H5(BF,OC2H与) 关于两种化合物的名称,Kennedy在进一步研究后提出自己的看法,把质子 给体或正离子给体叫做引发剂,而把Lcws酸叫做助引发剂。引发剂和助引发剂 组成一个引发体系,目前这种提法得到了越来越多研究人员的赞同。常见的质子 给体有H2O、HC1、HF、CCl,COOH,常见的正离子给体主要是卤代烃,如(CH3CH2) AICl2、(CH3CH2)2A1C1、A1(CHCH2)3、正氯代丁烷、3-氯-1-丁烯、二苯基氯 甲烷等。 另外,Lwis酸的络合能力很强,能与它们络合的化合物范围很广,如单体、 溶剂等均可与之络合,故使反应复杂化 (2)Lewis酸直接引发 Plesch等人的研究表明,比较强的Lewis酸(如AICl,、AIBr3和TiCl,)可以 单独使用,引发阳离子聚合。按提出的引发机理大致可以分成三种: ①双分子离子化过程: 2AIBr3÷AIBr2(AIBr)

AIBr2*(AIBr2)+M ANBr,M(AIBr) ②单电子离子化过程: TiC4+M→TiCl,M'cI ③烯丙基自行引发机理 Kennedy仔细地研究了阳离子聚合的各种单体的结构,发现含有烯丙基型氢 原子的单体,如异丁烯、异戊二烯、ā.甲基苯乙烯、环戊二烯及茚等化合物,即 使在“极度”干燥下仍能聚合:而不含有烯丙基氢原子的苯乙烯、丁二烯则不能 聚合。从而提出了自行引发机理。 C=C- C-H+MeXn c- +MeXn H(Me掀居原子) 用实验证明自离子化过程是很困难的,因为体系中少量的质子或正离子给体 就会对反应有很大影响,如浓度为103mol/L的水足以使TiCL4和AICl,(在CHC1 中)的引发速率提高10倍。对大部分常规反应体系来说,湿含量常足以导致助引 发作用在引发过程中占压倒的优势。 有文献报道,用立体阻碍大的碱,如吡啶衍生物,可以判定L©wis酸引发的 机理。这种碱具有与质子反应的特性,阻止质子引发,但却不能影响Lcws酸与 单体间的亲电加成。Kennedy及其同事们研究在这种“质子肼”2,6-二叔丁基吡 啶存在下L©wis酸-水的引发反应,结果发现:这种碱明显地降低了单体的转化率, 从几乎100%降至<10%。同时,聚合物的相对分子质量变大,分布变窄。这说明 到目前为止,质子引发反应是主要的形式。 引发剂与共引发剂的不同组合,得到不同引发活性,主要决定于向单体提供 质子的能力。 ④其它引发体系 卤素(常用碘)可以作为活性较大单体的引发剂,如甲氧基苯乙烯,烷基乙 烯基醚,乙烯基咔唑等。反应如下: 2+2 下述组成的阳离子盐也可以作为引发剂: CIO4·BF4 SnCl, (CeHs)C' SbCle C,H,(胰三烯阳离子) 这些阴离子的亲核性很弱,不易核和生长链发生反应,成为无终止反应。 1957年,发现异丁烯在一78C在高能射线(Co0γ射线)作用下,可按阳离

子机理进行聚合,认为射线从单体分子中打出电子,形成单体阳离子自由基: H.C=CICH,y H,G=(CH) 这种引发方法的特点是生长链近旁没有反离子存在,可以研究单独以自由离 子增长的聚合反应机理。 4.2.3链增长反应 链增长反应是生成高聚物的主要基元反应,是一个单体不断插入引发过程所 生成的碳阳离子活性中心和反离子形成的离子对之间的增长过程,即插入增长: CH HC-C+(BF,OH)+H.C=C →H,C-C+…(BFOH) CH, CH, c-cCH CH CH, CHa kp(CH)C-CH-*(BF,OH) kp CH, CH, (CHa)C-CHz-C- (BF:OH) 这个增长反应是否容易进行,取决于碳阳离子的稳定性和烯烃双键的亲核性 (即碱性)。碳阳离子越稳定,烯烃的碱性越强,就越容易加成。阳离子聚合反应 中链增长反应的活化能较低,通常为0.88.0kJ/mol。 单体的结构决定了阳离子聚合的反应性。结构包括取代基的极性和立体阻碍 取代基的推电子作用强,有利于提高双键上电子云的密度,有助于单体亲核结构 的形成,便于进一步与碳阳离子活性中心进行亲电加成。取代基的立体阻碍也影 响着链增长的速率和活性中心的加成方式。在甲苯或二氯甲烷溶剂中,在-79℃, BF3O(CHh引发烷基乙烯基醚聚合,烷基极性对聚合速率的影响顺序为: 叔丁基>异丙基>乙基>正丁基>甲基 此外,反离子对聚合速率的影响能力与它们相应的酸的强度有关。78℃下异 丁烯聚合速率受反离子响,相应的Lewis酸顺序如下 BF3>AlBr3>TiBr4>BBr3>SnCl4 4.2.3.1阳离子聚合中的立构控制 早在1947年,人们己经发现用BF,乙醚络合物在-78℃下引发异丁基乙烯基 醚聚合,得到了结晶性聚合物,后来证明它是全同立构聚合物。并且反应温度降 低,全同结构含量增加:相反,反应温度升高,全同结构含量减少。关于阳离了 聚合中立构规整性聚合物的形成过程有很多种解释,至今未有统一的意见。 4.2.3.2假阳离子聚合 烯烃的阳离子聚合过程中,有时增长活性中心不是碳阳离子,而是共价键结

构,这样的反应称为假阳离子聚合(pseudo cationic polymerization)。最典型的例 子是HC1O:引发苯乙烯在CHC2中的阳离子聚合: -st++CIo -st+CIO, -SIOCIO 自由离子 高羊对 蚧椭健 "CH-CH-O-CIO3 c-a,-o-go, HC=CH 假阳离子聚合与阳离子聚合并不是属于两类截然不同的机理,它们之间没有 根本的区别。不过是不同电离度谱中两端的两类活性中心而已。有些聚合既可以 按假阳离子聚合机理进行,也可以按常见的阳离子聚合方式进行,这完全依赖于 聚合条件。例如:质子酸(如HC1O4)引发或碘引发苯乙烯聚合,当溶剂为二氯 甲烷,聚合温度为-20℃时,聚合过程包括三个连续的过程:第一步为快速、寿命 短的离子聚合:第二步无离子特征:第三步又是离子过程。若温度为-20℃~30℃ 时,无第一步,第三步也很短。另一方面,若温度低至-80℃,则只有第一步。离 子聚合通常得高分子质量的聚合物。而共价键引发聚合得到的聚合物为低分子质 量的齐聚物。用SEC(Size Exclusion Chromatography)可以检测出分子质量和 分布的差别。另有一些假阳离子聚合反应的例子见表4-1。 表4-1假阳离子聚合反应的例了 引发剂 溶剂 HCIO HCIO EINO 养乙烯 CF.COOH H20·snCl CH2Cl2 CeHsCH(CHs)CIO CH2Cl2 对甲氧基苯乙烯 CFCOOH CH2Cl2 苊烯 HCIO4 CH2Cl2 2 N-乙烯基咔味 Haso CHCI 1.1-二-对二甲氧基苯乙桥 CCICOOH C6Ha 1,1-二苯基乙烯 HCISbCla CoHe 4.2.3.3异构化聚合 碳阳离子的活性很大,在链增长过程中活性中心可以发生重排反应,转变成
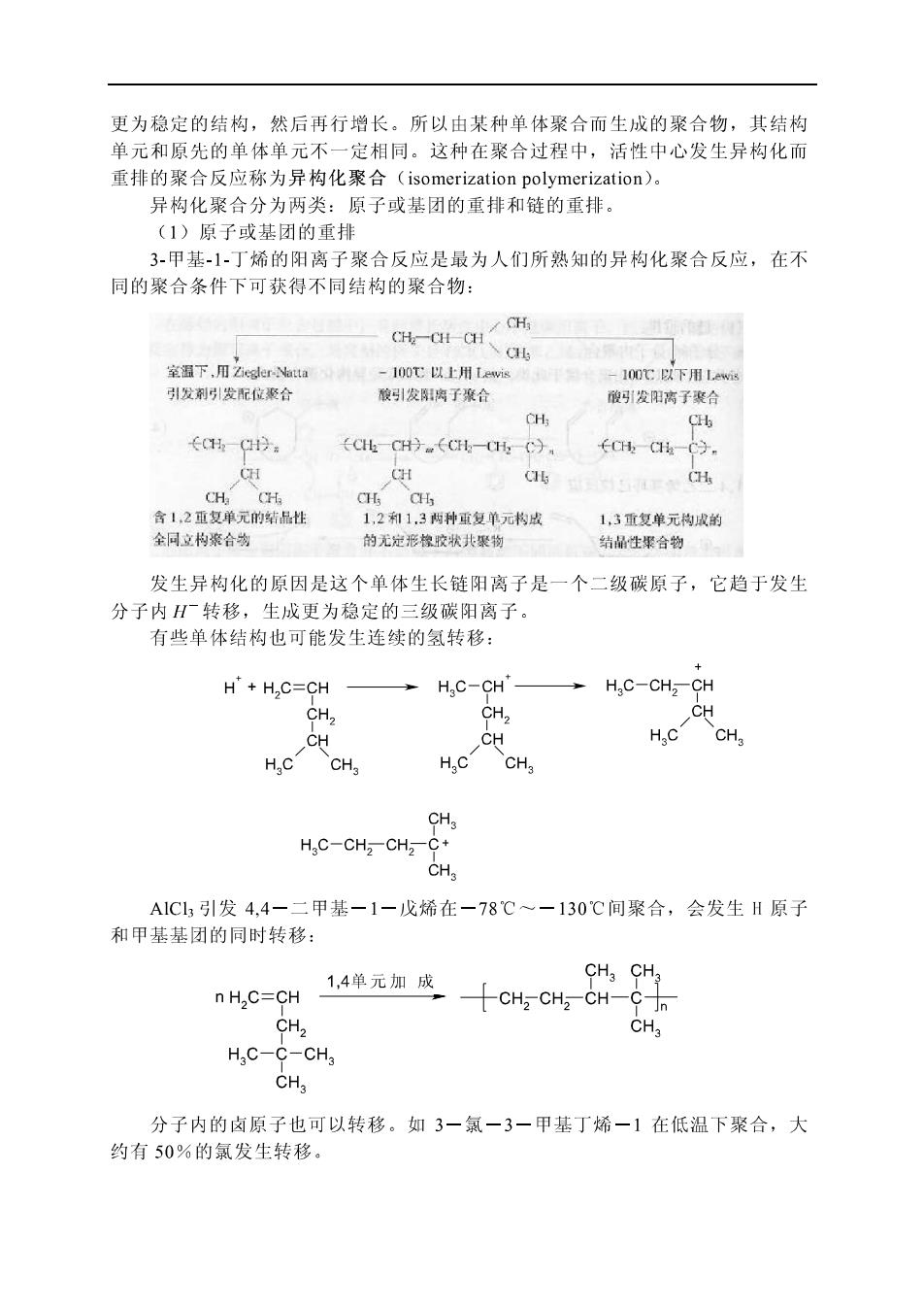
更为稳定的结构,然后再行增长。所以由某种单体聚合而生成的聚合物,其结构 单元和原先的单体单元不一定相同。这种在聚合过程中,活性中心发生异构化而 重排的聚合反应称为异构化聚合(isomerization polymerization)。 异构化聚合分为两类:原子或基团的重排和链的重排。 (】)原子或基团的重非 3甲基-1丁烯的阳离子聚合反应是最为人们所熟知的异构化聚合反应,在不 同的聚合条件下可获得不同结构的聚合物: 室温下乙e 100℃以上用wi H 引发刺引发配位聚合 酸引发阳了合 很雪引发阳高了襄 ←CHC9 (CICH9.(t-,C)。 CH C 全同立构聚合 1,2和1,3两种雪复单元书成 1,3重复单元构成的 的无定形模胶状共聚物 结的生探合物。 发生异构化的原因是这个单体生长链阳离子是一个二级碳原子,它趋于发生 分子内H转移,生成更为稳定的三级碳阳离子。 有些单体结构也可能发生连续的氢转移: H'+H,C=CH H,C-CH' H,C-CH2-CH CH. CH, CH CH CH HCCHa CH, CH H.C-CHz-CHz-C+ A1C1,引发4,4一二甲基-1一戊烯在一78℃一一130C间聚合,会发生H原子 和甲基基团的同时转移: 1,4单元加成 n H2C=CH CH CH2 CH-C CH2 CH3 H C-C-CHa CHa 分子内的卤原子也可以转移。如3一氯一3一甲基丁烯一1在低温下聚合,大 约有50%的氯发生转移