
*16-8多电子原子中电子分布 物理学教程 (第二版) 问:当原子中具有两个以上的电子时,电子在原 子中是如何分布的呢? 一 四个量子数 1.能量量子化和主量子数 氢原子的能量 主量子数 me4 E=n28n2) n=1,2,3,. 2.角动量量子化和角量子数 电子轨道角动量 轨道角量子数 h L=V1(I+1) 2元 1=0,1,2,…,(n-1) 第十六章量子物理
物理学教程 (第二版) 第十六章 量子物理 * 16 – 8 多电子原子中电子分布 问: 当原子中具有两个以上的电子时 , 电子在原 子中是如何分布的呢 ? 一. 四个量子数 1. 能量量子化和主量子数 主量子数 n =1,2,3, 2. 角动量量子化和角量子数 轨道角量子数 l = 0,1,2, ,(n −1) ➢ 氢原子的能量 ) 8 ( 1 2 2 0 4 n 2 h me n E = − ➢ 电子轨道角动量 2π ( 1) h L = l l +
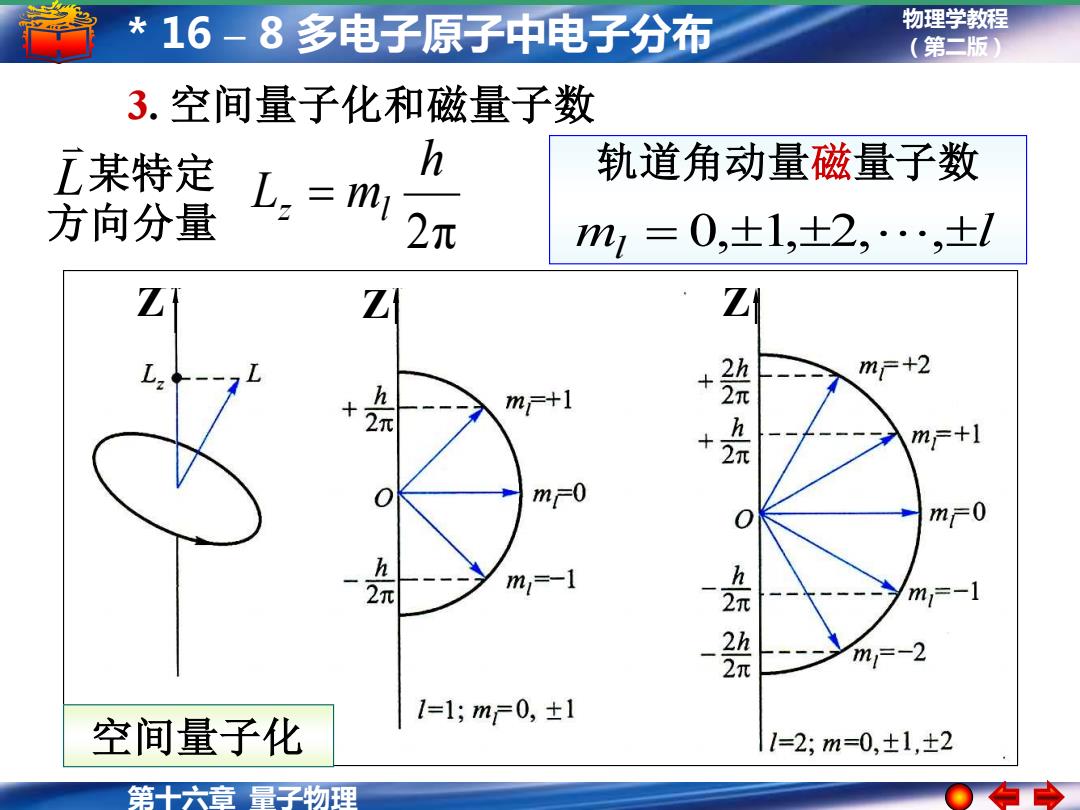
*16-8多电子原子中电子分布 物理学教程 (第二版) 3.空间量子化和磁量子数 某特定 h 轨道角动量磁量子数 方向分量 L:=m 2元 m=0,±1,+2,…,±l Z Z 2h m斤+2 + 元 +2N m示+1 + h m+1 m六0 mF0 m=-1 h 2π m1=-1 2h 元 m=-2 1=1;mF0,±1 空间量子化 =2;m=0,±1,±2 第十六章量子物理
物理学教程 (第二版) 第十六章 量子物理 * 16 – 8 多电子原子中电子分布 Z Z Z 空间量子化 3. 空间量子化和磁量子数 轨道角动量磁量子数 m l 2π l = 0,1,2, , h Lz = ml 某特定 方向分量 L
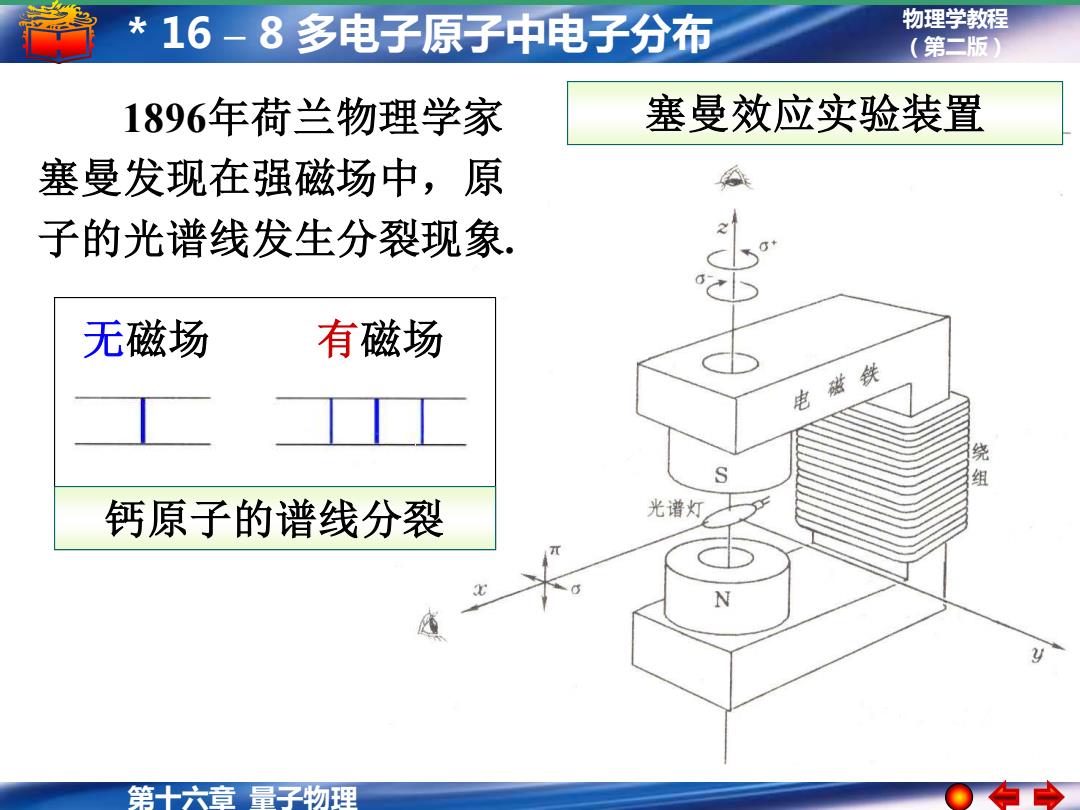
*16-8多电子原子中电子分布 物理学教程 (第二版) 1896年荷兰物理学家 塞曼效应实验装置 塞曼发现在强磁场中,原 子的光谱线发生分裂现象, 无磁场 有磁场 电磁铁 钙原子的谱线分裂 光谱灯 第十六章量子物理
物理学教程 (第二版) 第十六章 量子物理 * 16 – 8 多电子原子中电子分布 1896年荷兰物理学家 塞曼效应实验装置 塞曼发现在强磁场中,原 子的光谱线发生分裂现象. 钙原子的谱线分裂 无磁场 有磁场
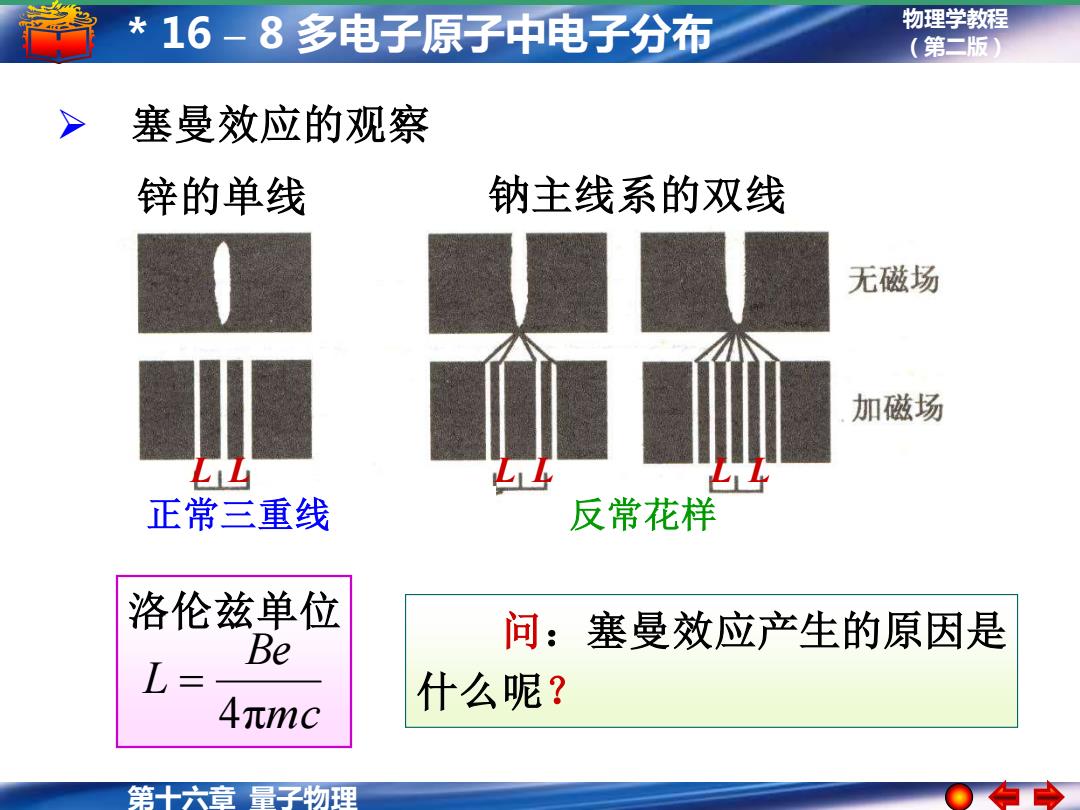
*16-8多电子原子中电子分布 物理学教程 (第二版) 塞曼效应的观察 锌的单线 钠主线系的双线 无磁场 加磁场 正常三重线 反常花样 洛伦兹单位 Be 问:塞曼效应产生的原因是 L= 4元mc 什么呢? 第十六章量子物理
物理学教程 (第二版) 第十六章 量子物理 * 16 – 8 多电子原子中电子分布 ➢ 塞曼效应的观察 钠主线系的双线 反常花样 L L 锌的单线 正常三重线 L L L L 洛伦兹单位 mc Be L 4π = 问:塞曼效应产生的原因是 什么呢?
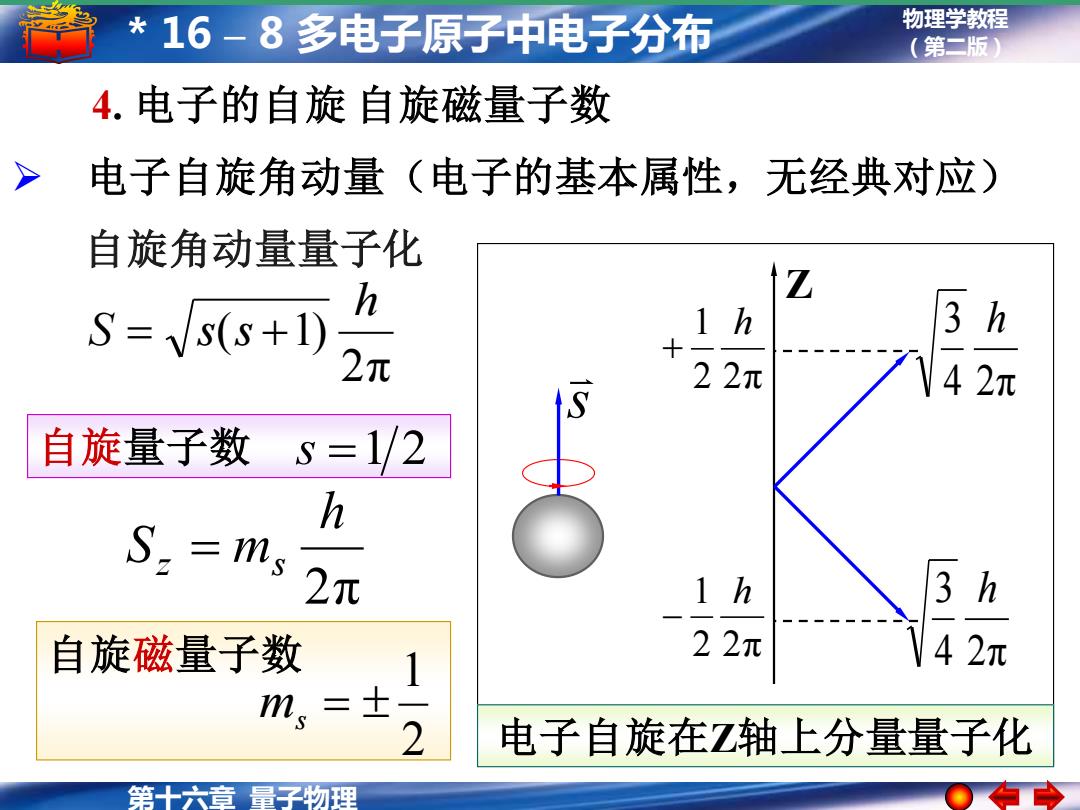
*16-8多电子原子中电子分布 物理学教程 (第二版) 4.电子的自旋自旋磁量子数 > 电子自旋角动量(电子的基本属性,无经典对应) 自旋角动量量子化 h Z S=s(s+1) 3 h 2元 22元 S 42元 自旋量子数s=1/2 h S.=ms 2元 3 h 自旋磁量子数 22元 42元 m,=士 -2 电子自旋在Z轴上分量量子化 第十六章量子物理
物理学教程 (第二版) 第十六章 量子物理 * 16 – 8 多电子原子中电子分布 4. 电子的自旋 自旋磁量子数 s 4 2π 3 h 4 2π 3 h 2 2π 1 h + 2 2π 1 h − Z 电子自旋在Z轴上分量量子化 ➢ 电子自旋角动量(电子的基本属性,无经典对应) 自旋量子数 s =1 2 自旋磁量子数 2 1 ms = 2π h Sz = ms 2π ( 1) h S = s s + 自旋角动量量子化

*16-8多电子原子中电子分布 物理学教程 (第二版 史特恩一盖拉赫实验 屏 1921年史特恩和盖 拉赫首先发现类氢元素 精 锂原子射线束经过非均 匀磁场后分成对称的两 束(银、铜等原子也有 此现象).根据量子力 狭缝 无磁场 学理论,其原因与电子 米原子源 有磁场 的自旋有关 实验装置 笋十六音量子物理
物理学教程 (第二版) 第十六章 量子物理 * 16 – 8 多电子原子中电子分布 ➢ 史特恩 – 盖拉赫实验 1921年史特恩和盖 拉赫首先发现类氢元素 锂原子射线束经过非均 匀磁场后分成对称的两 束(银、铜等原子也有 此现象). 根据量子力 学理论, 其原因与电子 的自旋有关. S 屏 有磁场 无磁场 非 均 匀 磁 场 原子源 狭缝 N 实 验 装 置

*16-8多电子原子中电子分布 物理学教程 (第二版) 二多电子原子中电子的分布 1869年,门捷列夫首先提出元素周期表(按原子 量的次序排列),反映元素性质的周期性变化. 玻尔是第一个给予周期表物理解释,(1916- 1918年)把元素按电子组态的周期性排列成表, 1925年泡利提出不相容原理后,才比较深刻地理 解到,元素的周期性是电子组态周期性的反映.而电 子组态的周期性与特定轨道的可容性相联系, 原子序数:原子中电子数目(原子核电荷数)· 第十六章量子物理
物理学教程 (第二版) 第十六章 量子物理 * 16 – 8 多电子原子中电子分布 ➢ 原子序数: 原子中电子数目(原子核电荷数). 1869年,门捷列夫首先提出元素周期表(按原子 量的次序排列),反映元素性质的周期性变化. 玻尔是第一个给予周期表物理解释,(1916 - 1918年)把元素按电子组态的周期性排列成表. 1925年泡利提出不相容原理后,才比较深刻地理 解到,元素的周期性是电子组态周期性的反映. 而电 子组态的周期性与特定轨道的可容性相联系. 二 多电子原子中电子的分布

*16-8多电子原子中电子分布 物理学教程 (第二版) 描述电子 不变 轨道取向 自旋取向 运动状态的量 量子数 量子数 子数 (n,l,s,m,ms) ,↓ (n,1,m,ms) 泡利不想容原理(1925年) 在一个原子中,不可能有两个 或两个以上的电子具有完全相同的 四个量子数(n,l,m,ms), 泡利(W.Pauli, 即原子中的每一个状态只能容纳一 1900-1959) 个电子. 第十六章量子物理
物理学教程 (第二版) 第十六章 量子物理 * 16 – 8 多电子原子中电子分布 不变 ➢ 泡利不想容原理(1925年) 在一个原子中,不可能有两个 或两个以上的电子具有完全相同的 四个量子数( ), 即原子中的每一个状态只能容纳一 个电子. ml ms n,l, , ( , , , , ) ml ms n l s 轨道取向 量子数 自旋取向 量子数 ( , , , ) ml ms n l ➢ 描述电子 运动状态的量 子数 泡利(W. Pauli, 1900-1959)

*16-8多电子原子中电子分布 物理学教程 (第二版) 决定电子所处状态的准则 (1)泡利不相容原理(每状态允许容纳的电子数) (2)能量最小原理(体系能量最低时,体系最稳定)· > 电子按能量分成许多壳层,能量相同的电子可 视为分布在同一壳层 主量子数n:决定电子能量的主要部分,相同 n的电子在同一壳层. 角量子数l:同一壳层中1=0,1,·,(-1), 不同的形成分壳层 第十六章量子物理
物理学教程 (第二版) 第十六章 量子物理 * 16 – 8 多电子原子中电子分布 ➢ 决定电子所处状态的准则 (1)泡利不相容原理(每状态允许容纳的电子数) (2)能量最小原理(体系能量最低时,体系最稳定). 主量子数 n : 决定电子能量的主要部分,相同 n 的电子在同一壳层. ➢ 电子按能量分成许多壳层,能量相同的电子可 视为分布在同一壳层. 角量子数 l :同一壳层中 l = 0,1, ,(n-1), 不同的 l 形成分壳层.
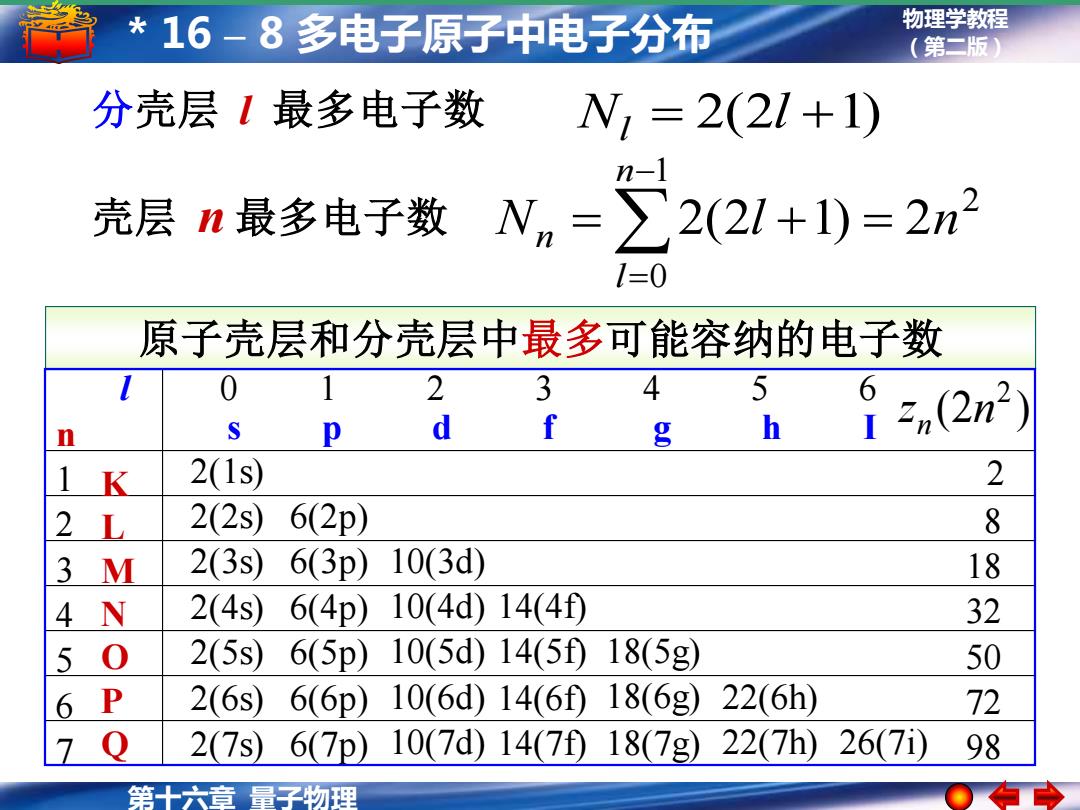
*16-8多电子原子中电子分布 物理学教程 (第二版) 分壳层1最多电子数 W,=2(21+1) n-1 壳层n最多电子数 Nm=>∑2(2l+1)=2n2 1=0 原子壳层和分壳层中最多可能容纳的电子数 0 2 5 n h n(2n2) 2(1s) 2 2 L 2(2S) 6(2p) 8 3 M 2(3s 6(3p)10(3d) 18 4N 2(4s) 6(4p)10(4d)14(4f 32 5 0 2(5s6(5p)10(5d)14(5f18(5g) 50 2(6s6(6p)10(6d)14(6D18(6g) 22(6h) 72 7Q 2(7s6(7p)10(7d)14(7f18(7g)22(7h) 26(7i) 98 第十六章量子物理
物理学教程 (第二版) 第十六章 量子物理 * 16 – 8 多电子原子中电子分布 N = 2(2l +1) 分壳层 l l 最多电子数 2 1 0 N 2(2l 1) 2n n l n = + = − = 壳层 n 最多电子数 原子壳层和分壳层中最多可能容纳的电子数 l 0 1 2 3 4 5 6 n s p d f g h I 1 2 3 4 5 6 7 K L M N O P Q 2(1s) 2(2s) 2(3s) 2(4s) 2(5s) 2(6s) 2(7s) 6(2p) 6(3p) 6(4p) 6(5p) 6(6p) 6(7p) 10(3d) 10(4d) 10(5d) 10(6d) 10(7d) 14(4f) 14(5f) 14(6f) 14(7f) 18(5g) 18(6g) 18(7g) 22(6h) 22(7h) 26(7i) 2 8 18 32 50 72 98 (2 ) 2 z n n