
第8章沉淀滴定法 (Precipitation titrations) 1
第8章 沉淀滴定法 (Precipitation titrations) 1

沉淀滴定法:以沉淀反应为基础的滴定分析方法 沉淀滴定法的条件: (1)沉淀的溶解度必须很小; (2)反应迅速、定量; (3)有适当的指示终点的方法; (4)沉淀的吸附现象不能影响终点的确定。 由于沉淀滴定的条件的限制,目前比较有实际意义的 只有银量法,即:以生成银盐为基础的滴定分析方法。 本章重点—难溶性银盐的沉淀滴定分析 2
沉淀滴定法:以沉淀反应为基础的滴定分析方法 沉淀滴定法的条件: (1)沉淀的溶解度必须很小; (2)反应迅速、定量; (3)有适当的指示终点的方法; (4)沉淀的吸附现象不能影响终点的确定。 由于沉淀滴定的条件的限制,目前比较有实际意义的 只有银量法,即:以生成银盐为基础的滴定分析方法。 本章重点——难溶性银盐的沉淀滴定分析 2

8.1沉淀滴定曲线 例如:cmoL-1AgNO3→Voml,co mol-L-1NaCl 4g+C=AgC1↓Kp=1.8×1010 K=(Km)=1.8×1010)1=5.6×109 (①)滴定前 [CI-]=co pCl=pco (2)Sp前 设加入滴定剂体积为Vml(V<Vo),则 ICr]-or-6xI-a V。+V 1+a a mol.L 当E,=-0.1%,a=99.9%时: [C1]=9×103=c×103 pCl=pc”+3 3
8.1 沉淀滴定曲线 例如:co mol·L-1 AgNO3 → V0 ml, co mol·L-1 NaCl 10 1.8 10 Ag Cl AgCl Ksp + − − + = 1 10 1 9 ( ) (1.8 10 ) 5.6 10 K K sp − − − = = = (1) 滴定前 0 0 0 0 [ ] c V c V Cl V V − − = + 0 3 sp pCl pc = + 0 [ ] Cl c − = 0 pCl pc = (2) sp前 1 0 1 1 a c mol L a − − = + 0 3 3 0 [ ] 10 10 2 c sp Cl c − − − = = 当 E a r = − = 0.1%, 99.9% 时: 设加入滴定剂体积为V ml(V<V0 ),则 3

(3)p点 [CI-]=[Ag"]=K mol.L (4)sp后(V>Vo) [g]=c业=6×a V+Vo mol.L a+1 [C]= [Ag*] 当E,=+0.1%,a=100.1%时: L4g]-=2×10=cgx10 pCl=pKp-pc”-3 滴定突跃范围(△pCI): pc+3~pKp-pc”-3 ·影响突跃的因素: 4
0 sp 0 3 ~ pK 3 sp sp • 滴定突跃范围(ΔpCl ): pc pc + − − • 影响突跃的因素: 0 ; sp c K 1 (3) [ ] [ ] − + − sp点 Cl = Ag = Ks p mol L 0 0 0 0 [ ] c V c V Ag V V + − = + 0 3 3 0 [ ] 10 10 2 c sp Ag c + − − = = 1 0 1 1 a c mol L a − − = + 0 3 sp pCl pK pc = − − sp 当 E a r = + = 0.1%, 100.1% 时: [ ] [ ] K sp Cl Ag − + = (4) sp后 (V>V0 ) 4
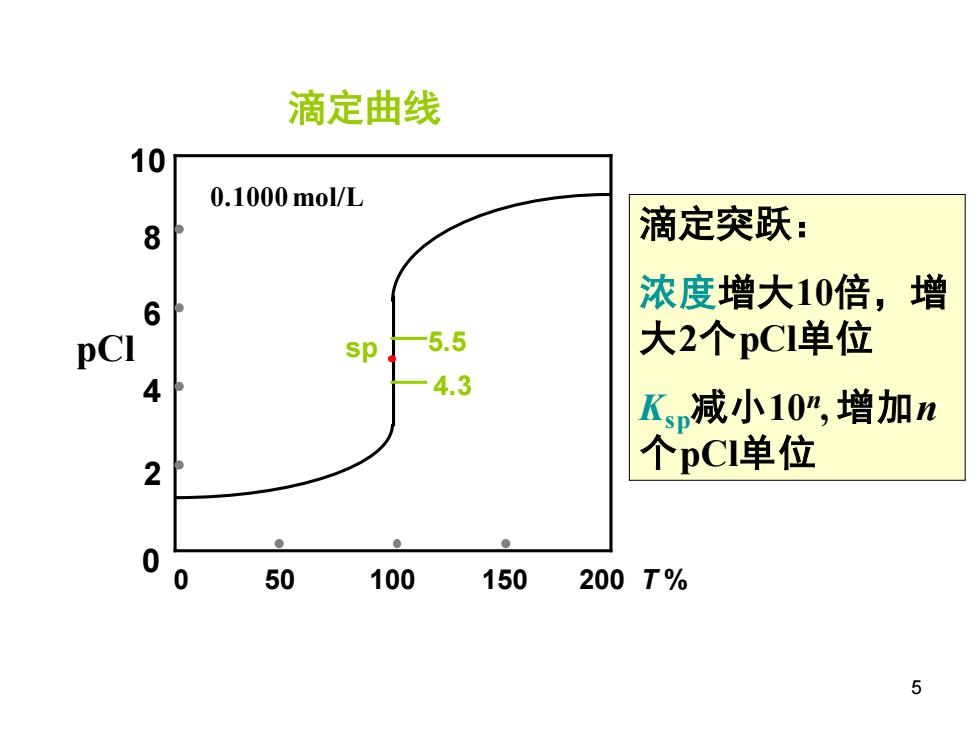
滴定曲线 10 0.1000mol/L 8 滴定突跃: 浓度增大10倍,增 6 sp -5.5 大2个pCl单位 A 4.3 Kp减小10,增加n 2 个pCI单位 0 0 50 100 150 200T% 5
0 50 100 150 200 T % pCl 0.1000 mol/L 5.5 4.3 0 2 4 6 8 10 sp 滴定曲线 滴定突跃: 浓度增大10倍,增 大2个pCl单位 Ksp减小10n , 增加n 个pCl单位 5

8.2Mohr法-K2CrO4指示剂法 >1.原理:指示剂:K2Cr04分步滴定 AgNO3→CI和Br Sp前:Ag*+C1≥AgC1↓(白色) Kp=1.8×10-10 ep:2Ag+CrO}、三Ag,CrO,K砖红色) Kp=1.2×10-2 AgCI的Kp>Ag2CrO4的Kp,为何先生成AgC? 6
8.2 Mohr法- K2CrO4 指示剂法 ➢ 1. 原理:指示剂:K2CrO4 分步滴定 10 1.8 10 sp sp Ag Cl AgCl K + − − + = 前: (白色) → − − AgNO Cl 和Br 3 AgCl的Ksp> Ag2CrO4的Ksp,为何先生成AgCl? 2 4 2 4 12 2 1.2 10 sp ep Ag CrO Ag CrO K + − − + = : (砖红色) 6

AgCI和Ag2CrO,的溶解度大小比较 ·设沉淀溶解度为smol/L AgCl:K=[Ag]x[CF]=sxs s=VK2=V1.8×100=1.34x105mol/L Ag2Cr04:Kp=[Ag*]2×[Cr0,2]=(2s)2×s=4s3 1.2×10-12 =6.7×10-4mol/L 4 AgCI的溶解度<Ag2CrO4的溶解度,先生成AgCN 7
AgCl和 Ag2CrO4的溶解度大小比较 • 设沉淀溶解度为s mol/L 10 5 : [ ] [ ] 1.8 10 1.34 10 / sp sp AgCl K Ag Cl s s s K mol L + − − − = = = = = mol L K s Ag CrO K Ag CrO s s s s p s p 6.7 10 / 4 1.2 10 4 : [ ] [ ] (2 ) 4 4 3 1 2 3 2 2 3 4 2 2 4 − − + − = = = = = = AgCl的溶解度< Ag2CrO4的溶解度, ∴先生成AgCl 7

2.滴定条件 A.指示剂用量:5×10-3moL-1K2Cr04 过高一终点提前;过低一终点滞后 B.溶液酸度:pH=6.5~10.5(中性或弱碱性) 酸性:2Cr02+2H三C50,2+H,0,K=4.3×104 碱性:2Ag*+2OH=Ag,O(黑褐色)↓+H,O NH4+存在时,pH=6.57.2, pH>7.2时,Ag→Ag(NH3)2 注意: 防止沉淀吸附而导致终点提前; 措施—滴定时充分振摇,解吸C1或Br。 8
2.滴定条件 A.指示剂用量: 5×10-3 mol·L-1 K2CrO4 过高——终点提前; 过低——终点滞后 B.溶液酸度:pH = 6.5~10.5(中性或弱碱性) 碱性: 2 2 14 4 2 7 2 2 2 , 4.3 10 CrO H Cr O H O K − + − 酸性: + + = 2Ag + 2OH = Ag2 O( ) +H2 O + − 黑褐色 NH4 +存在时, pH = 6.5~7.2, pH ﹥7.2时,Ag+→Ag(NH3 )2 + 注意: 防止沉淀吸附而导致终点提前; 措施——滴定时充分振摇,解吸Cl- 或 Br-。 8

3.适用范围: ·直接法测C、Br,返滴定法测Ag; 。一般不测厂,SCN。 AgI和AgSCN具有强烈吸附作用,使终点观察不明 显,误差较大。 4.干扰 ·阴离子:P043-、As043、S032-、S2-、C032、C2042 。阳离子:Ba2+、Pb2+ ·有色离子:Cu2+、Co2+、N2+ ·易水解离子:A3+、Fe3+、Bi3+、Sn4+ 9
3. 适用范围: AgI 和 AgSCN 具有强烈吸附作用,使终点观察不明 显,误差较大。 • 直接法测Cl-、 Br-,返滴定法测Ag+; • 一般不测 I - ,SCN-。 4. 干扰 • 阴离子:PO4 3-、AsO4 3-、SO3 2-、S 2-、CO3 2-、C2O4 2- • 阳离子:Ba2+ 、Pb2+ • 有色离子:Cu2+ 、Co2+ 、Ni2+ • 易水解离子:Al3+ 、Fe3+ 、Bi3+ 、Sn4+ 9

8.3 Volhard:法-铁铵矾指示剂法 1.直接滴定法 >原理: 指示剂:NH4F(SO4)2·12H2O, 滴定剂:NH,SCN或KSCN,被滴离子:Ag sp前:Ag*+SCW=AgSCN↓(白色)K,=1.1×10-2 ep:Fe++SCN→FeSCN2+(红色),K=138 6.0×10-6mol.L1 FeSCN2+可看到红色 10
8.3 Volhard法-铁铵矾指示剂法 1.直接滴定法 12 1.1 10 sp sp Ag SCN AgSCN K + − − 前: + = (白色) 6 1 2 6.0 10 mol L FeSCN − − + 可看到红色 4 4 2 2 4 NH Fe SO H O ( ) 12 NH SCN KSCN Ag + 指示剂: , 滴定剂: 或 ,被滴离子: ➢ 原理: 3 2 ep Fe SCN FeSCN K, 138 + − + : + → = (红色) 10