
第十七章 卤素 。17-1卤素的通性 。17-2卤素的单质及其化合物 ·17-3含氧酸的氧化还原性
第十七章 卤素 ⚫ 17-1 卤素的通性 ⚫ 17-2 卤素的单质及其化合物 ⚫ 17-3 含氧酸的氧化还原性

17-1卤素的通性 。F CI Br IAt ●。1.价电子层结构:价电子层结构ns2np5 价电子数最多,半径是同周期中最小,电 子亲和能较大且电负性也较大。故卤素是活 泼的非金属。 Ps16表17-1
17-1 卤素的通性 ⚫ F Cl Br I At ⚫ 1.价电子层结构:价电子层结构 ns2np5 价电子数最多,半径是同周期中最小,电 子亲和能较大且电负性也较大。 故卤素是活 泼的非金属。 P516 表17-1

第二周期F的特殊性 1.主要氧化数:F无正氧化数 2.X-X键解离能:F-FBr>I 5.卤化物热力学稳定性:氟化物最稳定 6.X作配位原子,中心原子配位数(CN):氟化物最 大 AsF AsCl AsBra AsI AsFs AsCl AsCL550℃分解 PbF PbCl PbClR.T.分解
第二周期F的特殊性 1. 主要氧化数: F 无正氧化数 2. X-X键解离能:F-F Br > I 5. 卤化物热力学稳定性: 氟化物最稳定 6. X-作配位原子,中心原子配位数(C.N.):氟化物最 大 AsF3 AsCl3 AsBr3 AsI3 AsF5 AsCl5 ⎯ ⎯ AsCl5 50 ℃分解 PbF4 PbCl4 ⎯ ⎯ PbCl4 R.T.分解

F的结构因素和热力学因素 1.电负性:最大。 2.p0(X2/X):F2/F最大。 3.原子半径r:F最小。 形成共价键化合物,F-F键离解键能最小, 而生成的共价键的键能大。 4.热力学: 离子型卤化物:氟化物晶格能U最大; 共价型卤化物:氟化物△G最负
F的结构因素和热力学因素 1. 电负性:F最大。 2. φ Ø (X2 /X- ) :F2 /F-最大。 3. 原子半径 r : F 最小。 形成共价键化合物,F-F键离解键能最小, 而生成的共价键的键能大。 4. 热力学: 离子型卤化物: 氟化物晶格能U最大; 共价型卤化物: 氟化物△fGØ最负
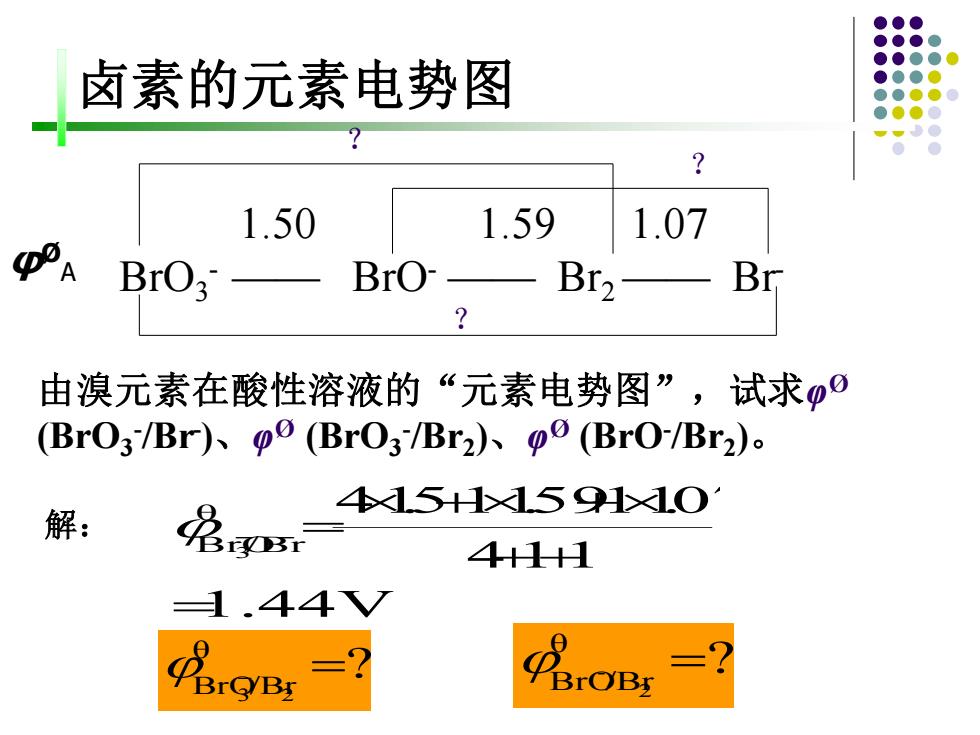
卤素的元素电势图 1.50 1.59 1.07 BrO: BrO B12 Br 由溴元素在酸性溶液的“元素电势图”,试求0 (Br03Br)、p0(BrO3Br2)、p0(Br0/Br2) 15H☒59H1O 解: 25 4+H 1.44V7 PBrOB两
1.50 1.59 1.07 BrO3 - —— BrO- —— Br2 —— Br- 1.44V 4 11 θ 41.511.5911.07 BrO3 /Br = ++ + + 解: − − = ? θ BrO/Br 3 2 − = ? θ BrO/Br2 - = ? 由溴元素在酸性溶液的“元素电势图”,试求φ Ø (BrO3 - /Br- )、φ Ø (BrO3 - /Br2 )、φ Ø (BrO- /Br2 )。 ? ? φØ A 卤素的元素电势图

17-2卤素的单质及其化合物 ·2-1卤素的成键特征 ①与活泼金属形成离子键。 ②大多数形成共价键。 a.共价单键(非金属、极性) b.配位键(X是有孤电子对) 如FeF63-、[CuC2l-、[CuCl4l2
17-2 卤素的单质及其化合物 ⚫ 2-1 卤素的成键特征 ①与活泼金属形成离子键。 ②大多数形成共价键。 a.共价单键(非金属、极性) b.配位键(X是有孤电子对) 如[FeF6 ] 3- 、[CuCl2 ]-、[CuCl4 ] 2-

通性 ③除F外其余X都可有过氧化态+1、+3、+5、 +7。 这是由于第三周期开始具有nd轨道可参加成 键,因X含有一个未成对电子,再拆开一对电子参 与成键,其成键电子就增加2个,所以在增加的基 础上其氧化数总是奇数
通性 ③除F外其余X都可有过氧化态+1、+3、+5、 +7。 这是由于第三周期开始具有nd轨道可参加成 键,因X含有一个未成对电子,再拆开一对电子参 与成键,其成键电子就增加2个,所以在增加的基 础上其氧化数总是奇数

2-2卤素在自然界的分布 冰晶石 薯 萤石 智利硝石
2-2 卤素在自然界的分布 冰 晶 石 萤 石 萤 石 智 利 硝 石

2-3单质 。物理化学性质 氯(C2) 溴(Br2) 碘(2)
2-3 单质 ⚫ 物理化学性质 氯(Cl2) 溴(Br2) 碘(I2)

物理性质(表17-2) L多 颜色变深 0 色散力↑,熔沸点个。 ·I2在极性比较大的溶剂中发生溶剂化反应,故是棕色, 如在水、乙醇、乙醚。KI+H分K紅3 ·L在极性比较小的溶剂中不发生溶剂化反应;故是紫 色。(分子本身的颜色,同蒸气颜色,易升华) ●卤素单质有毒,极强的腐蚀性
物理性质(表17-2) 颜色变深 ⚫ 色散力↑,熔沸点↑。 ⚫ I2在极性比较大的溶剂中发生溶剂化反应,故是棕色, 如在水、乙醇、乙醚。 KI+I2 KI3 ⚫ I2在极性比较小的溶剂中不发生溶剂化反应;故是紫 色。(分子本身的颜色,同蒸气颜色,易升华) ⚫ 卤素单质有毒,极强的腐蚀性。 F2 Cl2 Br2 ⎯ I2→