
第十八章氢和稀有气体 §18-1氢 ·§18-2稀有气体
• §18-1 氢 • §18-2 稀有气体 第十八章 氢和稀有气体

§18-1氢 。1-1氢在自然界的分布 。概述:特殊的元素 IA族?IA族? ●氢的存在: 宇宙中最为丰富的元素。地壳中以质量计第九 位
§18-1 氢 ⚫ 1-1 氢在自然界的分布 ⚫ 概述:特殊的元素 ⅠA族?ⅦA族? ⚫ 氢的存在: 宇宙中最为丰富的元素。地壳中以质量计第九 位
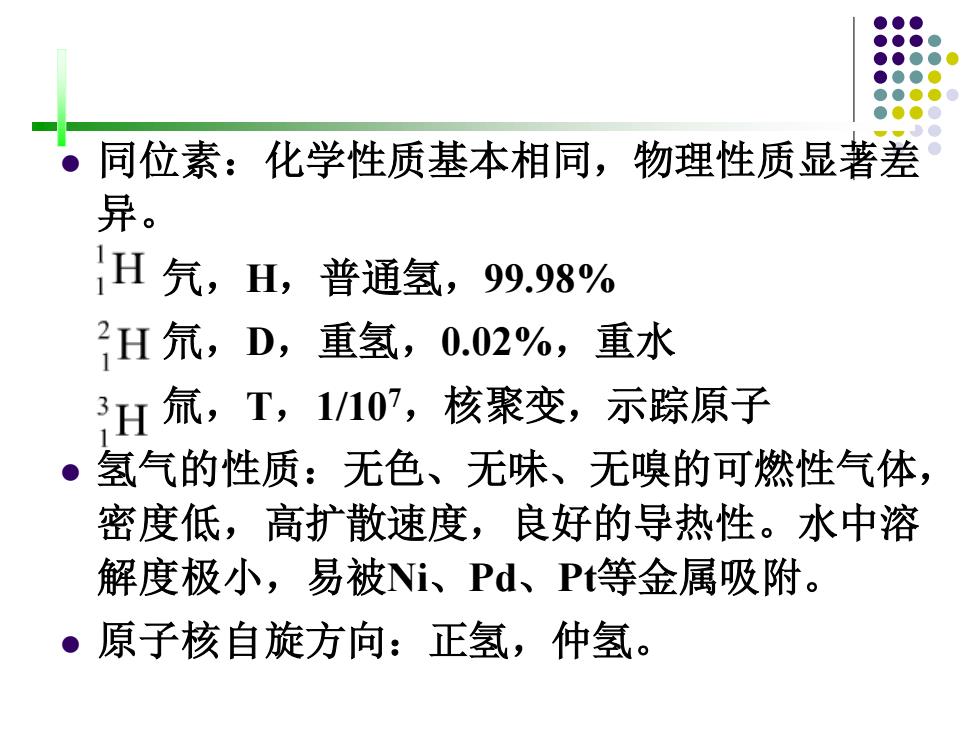
同位素:化学性质基本相同,物理性质显著差 异。 1H气,H,普通氢,99.98% 2H氘,D,重氢,0.02%,重水 H氚,T,1107,核聚变,示踪原子 ●3 氢气的性质:无色、无味、无嗅的可燃性气体, 密度低,高扩散速度,良好的导热性。水中溶 解度极小,易被Ni、Pd、P等金属吸附。 ·原子核自旋方向:正氢,仲氢
⚫ 同位素:化学性质基本相同,物理性质显著差 异。 氕,H,普通氢,99.98% 氘,D,重氢,0.02%,重水 氚,T,1/107,核聚变,示踪原子 ⚫ 氢气的性质:无色、无味、无嗅的可燃性气体, 密度低,高扩散速度,良好的导热性。水中溶 解度极小,易被Ni、Pd、Pt等金属吸附。 ⚫ 原子核自旋方向:正氢,仲氢

1-2 氢的成键特征 (1)配位键:+与其它的原子或分子。如酸中 的水合氢离子。 (2)共价键:与电负性大的非金属元素以共用 电子对结合,如H0。 (3)离子键:和第IA和ⅡA族元素。如NaH。 (4)独特的键型 氢键:N、O、F的氢化物,如水分子。 氢桥键:在缺电子化合物中,如乙硼烷
1-2 氢的成键特征 (1)配位键:H+与其它的原子或分子。如酸中 的水合氢离子。 (2)共价键:与电负性大的非金属元素以共用 电子对结合,如H2O。 (3)离子键:和第ⅠA和ⅡA族元素。 如 NaH。 (4)独特的键型 氢键:N、O、F的氢化物,如水分子。 氢桥键:在缺电子化合物中,如乙硼烷
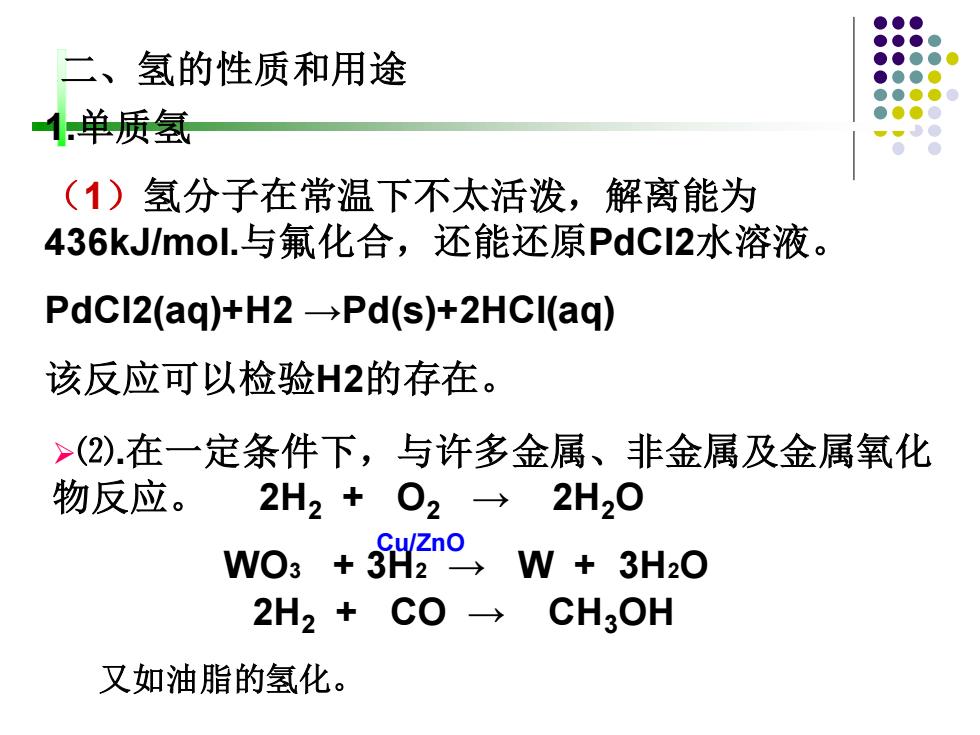
二、氢的性质和用途 1.单质氢 (1)氢分子在常温下不太活泼,解离能为 436 kJ/mol.与氟化合,还能还原PdC2水溶液。 PdCI2(aq)+H2-Pd(s)+2HCI(aq) 该反应可以检验H2的存在。 >(2).在一定条件下,与许多金属、非金属及金属氧化 物反应。 2H2+O2→2H20 Cu/Zno WO3+3H2→W+3H20 2H2+C0→ CH3OH 又如油脂的氢化
二、氢的性质和用途 1.单质氢 (1)氢分子在常温下不太活泼,解离能为 436kJ/mol.与氟化合,还能还原PdCl2水溶液。 PdCl2(aq)+H2 →Pd(s)+2HCl(aq) 该反应可以检验H2的存在。 2H2 + CO → CH3OH ➢⑵.在一定条件下,与许多金属、非金属及金属氧化 物反应。 2H2 + O2 → 2H2O WO3 + 3H2 → W + 3H2O Cu/ZnO 又如油脂的氢化

2.原子氢 原子氢的还原性比氢单质要强得多,在常温下能与GeS1As Sb等单质直接化合。 >与As;S等非金属单质的反应 As+3H→AsH3 S+2H→H2S >与金属氧化物或氯化物的反应 CuCl,2H Cu 2HCI >与含氧酸盐的反应 BaS04+8H→BaS+4H2O
2.原子氢 原子氢的还原性比氢单质要强得多,在常温下能与Ge Sn As Sb等单质直接化合。 ➢ 与As;S等非金属单质的反应 As + 3H → AsH3 S + 2H → H2S ➢ 与金属氧化物或氯化物的反应 CuCl2 + 2H → Cu + 2HCl ➢ 与含氧酸盐的反应 BaSO4 + 8H → BaS + 4H2O
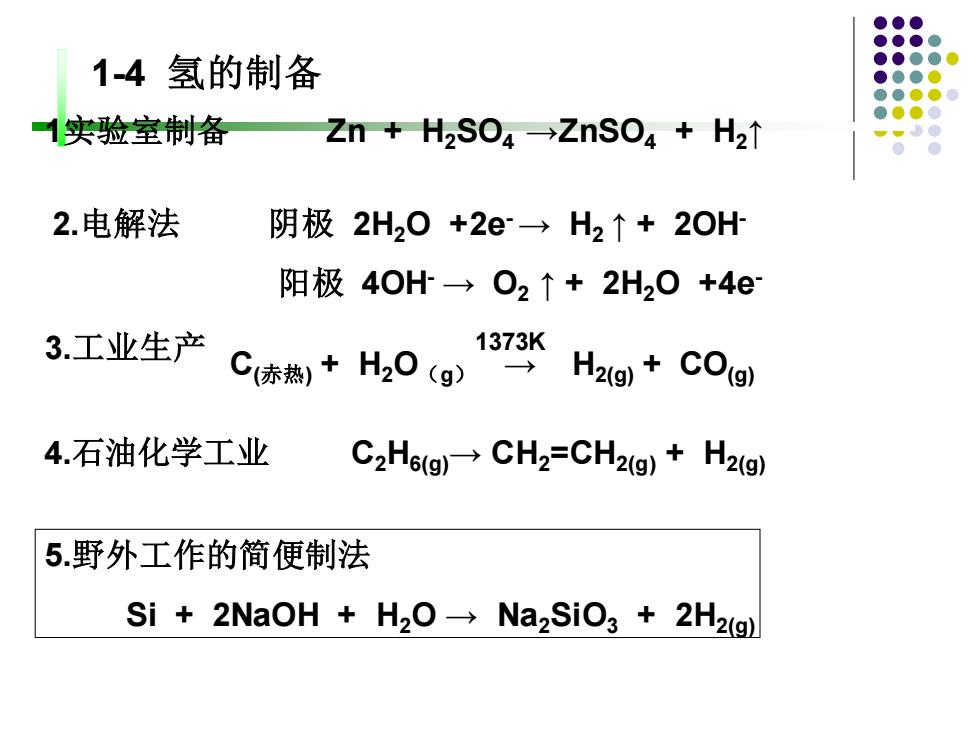
1-4氢的制备 1实验室制备 Zn+H2S04→ZnS04+H2t 2.电解法 阴极2H20+2e→H2↑+2OH 阳极40H→O2↑+2H20+4e 3.工业生产 1373K C(陈热+H20(g)⊙SH2g+C0gl 4.石油化学工业 C2H6(g)CH2=CH2(g)+H2(g) 5.野外工作的简便制法 Si 2NaOH H2O Na2SiO3+2H2(g)
1实验室制备 Zn + H2SO4 →ZnSO4 + H2↑ 2.电解法 阴极 2H2O +2e-→ H2 ↑ + 2OH- 阳极 4OH- → O2 ↑ + 2H2O +4e- 3.工业生产 C(赤热) + H2O(g) → H2(g) + CO(g) 1373K 1-4 氢的制备 4.石油化学工业 C2H6(g)→ CH2=CH2(g) + H2(g) 5.野外工作的简便制法 Si + 2NaOH + H2O → Na2SiO3 + 2H2(g)

1-5氢化物 1、离子型氢化物:如NaH,LiAIH4 2、金属型氢化物:如VHo.56 3、共价型氢化物: 4、金属含氢配合物:[Fe(CO)4H2]NaBH4等、 1-6氢能源 1.来源丰富 2.热值高,相当于同质量的石油的三倍。 3.无污染。 4.可储存,可高效输送
1-5 氢化物 1、离子型氢化物: 如NaH, LiAlH4 2、金属型氢化物: 如VH0.56 3、共价型氢化物: 4、金属含氢配合物:[Fe(CO)4H2] NaBH4等、 1-6 氢能源 1.来源丰富 2.热值高,相当于同质量的石油的三倍。 3.无污染。 4.可储存,可高效输送

§2-2稀有气体 2-1历史的回顾 稀有气体:He Ne Ar Kr Xe Rn 价层电子构型:ns2p6 稀有气体的发现:“第三位小数的胜利” 空气分馏氮:1.2572gL1 Ar 化学法制备氮:1.2505gL1
2-1 历史的回顾 稀有气体:He Ne Ar Kr Xe Rn 价层电子构型:ns 2np 6 稀有气体的发现:“第三位小数的胜利” 空气分馏氮 :1.2572 g•L-1 化学法制备氮:1.2505g•L-1 Ar §2-2 稀有气体

2-2通性和用途 稀有气体的物理性质:表13-2 He Ne Ar Kr Xe Rn I1/kJmo1237220871527135711761043 m.p./℃-272-249-189-157-112 -71 Sml/kgH208.610.533.659.4 108 230 临界温度K5.2544.5150.9209.4289.7378.1
2-2 通性和用途 稀有气体的物理性质:表13-2 He Ne Ar Kr Xe Rn I1 /kJ·mol-1 2372 2087 1527 1357 1176 1043 m.p./℃ -272 -249 -189 -157 -112 -71 S/ml/kg H2O 8.6 10.5 33.6 59.4 108 230 临界温度/K 5.25 44.5 150.9 209.4 289.7 378.1