
第10章氧化还原反应 10.1氧化还原反应和原电池 10.2电池反应的热力学 10.3影响电极电势的因素 10.5图解法讨论电极电势
10.1 氧化还原反应和原电池 10.2 电池反应的热力学 10.3 影响电极电势的因素 10.5 图解法讨论电极电势 第10章 氧化还原反应

10.1氧化还原反应和原电池 化学反应根据不同的特点,可以分为两类: 1、氧化还原反应(氧化数变化或电子得失) 2、非氧化还原反应
10.1 氧化还原反应和原电池 化学反应根据不同的特点,可以分为两类: 1、氧化还原反应(氧化数变化或电子得失) 2、非氧化还原反应

10.1.1化合价和氧化数 1.氧化数是化合物中某元素所带形式电荷的数 值。氧化数是一个经验值,是一个人为的概念。 氧化数反映了元素所处的氧化状态,也称氧 化态(oxidation state)。 >2.引入氧化数概念的意义: >()判断是否发生氧化:氧化数升高、氧化反应、 还原剂;氧化数降低、还原反应、氧化剂。 >(2)配平氧化还原反应方程式 >(3)分类化合物,如Fe(D、D:Cu①)、CuT)
10.1.1 化合价和氧化数 ⚫ 1

3.确定元素原子氧化值的规则 >单质的氧化数为零; >在离子化合物中,元素的氧化数等于离子的正、 负电荷数; >在共价化合物中,将共有电子对指定给电负性大 的原子后,在两原子上形成的电荷数就是它们的 氧化数。 >所有元素氧化数的代数和在多原子分子中为零, 在多原子离子中等于离子所带的电荷数;
3.确定元素原子氧化值的规则 ⚫ 1

规则 >氧在一般化合物中的氧化数为-2;但有例外,如 02(-均)、022(-1)、03(-)02*+均)、 0F,(+2)等; >除了在NaH、CaH2、NaBH4、LiAIH4中氢的氧化 数为-1以外,氢的氧化数为+1: >在配合物中,当自由基或原子团作为配体时,其 氧化数均看作-1,如-CH3、-CH等;当中性分子 作为配体时,若配体中的配位原子提供偶数个电 子,如H2O、CO、NH3、C,H4CH等,其氧化 数为零。但NO作为配体时,氧化数为+1,因为 NO+与CO是等电子体,所以NO作为配体时,可以看作先给出一个电 子到中心体上,然后再提供一对电子占有中心体的空轨道
规则 ⚫ 例
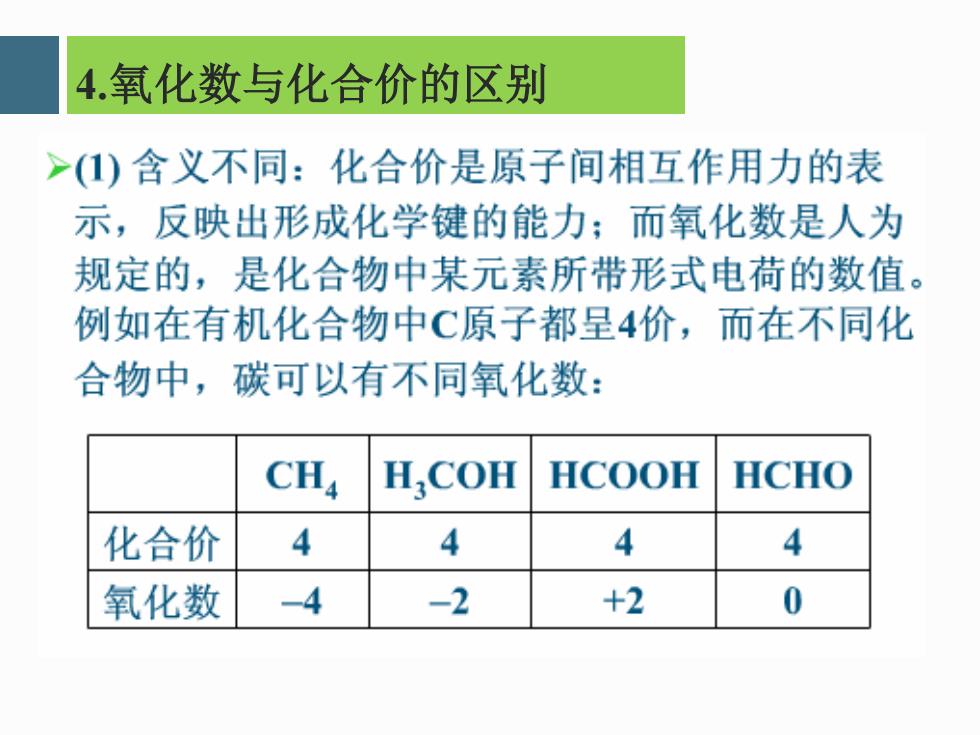
4.氧化数与化合价的区别 >()含义不同:化合价是原子间相互作用力的表 示,反映出形成化学键的能力;而氧化数是人为 规定的,是化合物中某元素所带形式电荷的数值。 例如在有机化合物中C原子都呈4价,而在不同化 合物中,碳可以有不同氧化数: CH4 H,COH HCOOH HCHO 化合价 4 4 4 4 氧化数 -4 -2 +2 0
4.氧化数与化合价的区别 ⚫ 例

区别 >(2)所用的数字范围不同:化合价取整数(一般不 超过+8或-4),如Fe,O4,Fe的化合价为+2,+3。 氧化数可以取零,分数或整数,如Fe,O4的表观 (平均)氧化数为+83,而实际价态为+2、+3。 >(3)表示的符号不同:Pauling建议,氧化数表示 为+m、-n;化合价:在离子化合物中,用m+、 -表示,在共价化合物中,用罗马字母表示,Fe ID、FeID
区别 ⚫ 例

氧化还原半反应式 例如: Cl,+2KI=2KCI+I 0 xidation:2-2e-→I, 半反应(half Reduction:Cl,+2e->2Cl reaction) >氧化(oxidation):氧化数升高的过程,或元素 原子失去电子的过程。 >还原(reduction)::氧化数降低的过程,或元素 原子得到电子的过程。 >氧化和还原总是同时发生的
氧化还原半反应式 ⚫ 例

氧化还原 >在上述反应中,电子由转移到CL,我们说I 被C1,氧化了,则称为C1,为氧化剂,即氧化数 降低的物质叫做氧化剂(oxidizing agent /oxidan);同时,Cl,被还原了,为还原 剂,即氧化数升高的物质叫做还原剂 (reducing agent /reductant). >氧化剂是使另一物质被氧化,自身被还原,它 的反应产物称为还原产物。还原剂则使另外一 种物质被还原,本身被氧化,它的反应产物叫 做氧化产物
氧化还原 ⚫ 例

氧化还原 氧化态+ne三还原态 共轭碱+nH+三共轭酸 凡是有电子转移或电子偏移的反应就是氧化还原反应 (Oxidation/reduction reaction Redox reaction)
氧化还原 ⚫ 例