
第三章 、概述 滴定分析法 二、滴定分析分类 三、滴定分析对化学 第一节 反应的要求 滴定分析概述 四、标准溶液的配制 及浓度的确定 五、标准溶液浓度表示法 六、滴定分析中的计算 下页 带助 感回
第三章 滴定分析法 一、概述 二、滴定分析分类 三、滴定分析对化学 反应的要求 四、标准溶液的配制 及浓度的确定 五、标准溶液浓度表示法 六、滴定分析中的计算 第一节 滴定分析概述
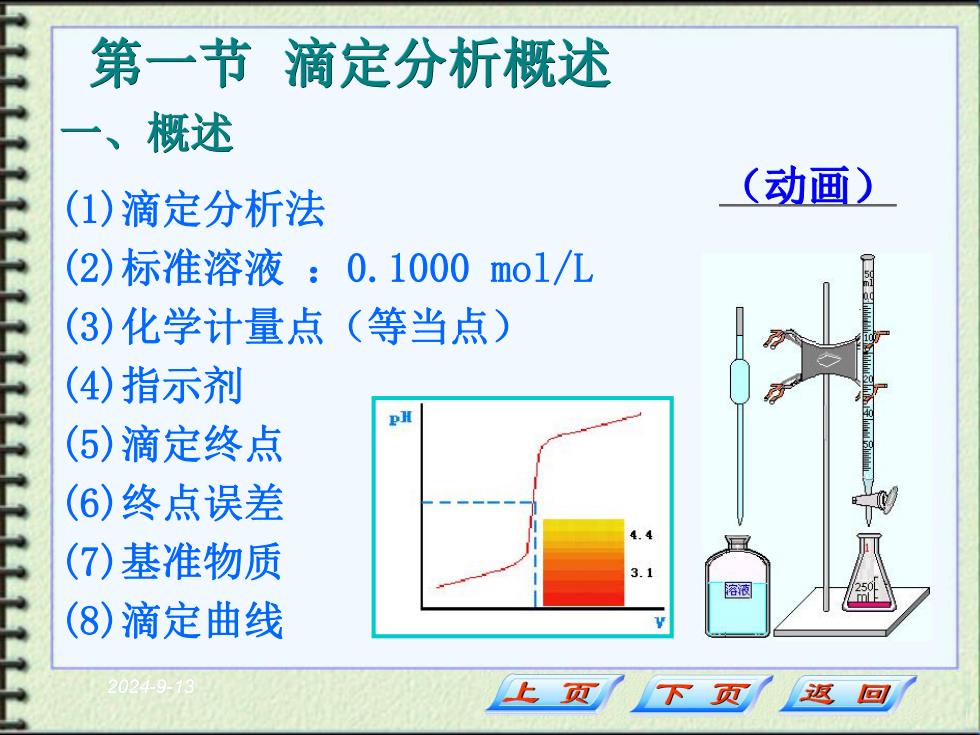
第一节滴定分析概述 一、概述 (1)滴定分析法 (动画) (2)标准溶液:0.1000mo1/L (3)化学计量点(等当点) (4)指示剂 pH (5)滴定终点 (6)终点误差 (7)基准物质 溶液 (8)滴定曲线 20249- 上页 下页 返回
2024-9-13 第一节 滴定分析概述 一、概述 (1)滴定分析法 (2)标准溶液 :0.1000 mol/L (3)化学计量点(等当点) (4)指示剂 (5)滴定终点 (6)终点误差 (7)基准物质 (8)滴定曲线 (动画)

二、滴定分析分类 1.按化学反应类型分类 (1)酸碱滴定法: (2)配位滴定法(络合滴定法): (3)沉淀滴定法: (4)氧化还原滴定法: 四种滴定的共性与差异? 2.按滴定方式分类 (1)直接滴定:例:强酸滴定强碱。 (2)间接滴定:例:氧化还原法测定钙。 (3)返滴定法:例:配位滴定法测定铝。 (4)置换滴定法:例:A1Y·A1F62+Y4 ZnY 页 下页 返回
2024-9-13 二、滴定分析分类 1. 按化学反应类型分类 (1)酸碱滴定法: (2)配位滴定法(络合滴定法): (3)沉淀滴定法: (4)氧化还原滴定法: 四种滴定的共性与差异? 2.按滴定方式分类 (1)直接滴定: 例: 强酸滴定强碱。 (2)间接滴定:例:氧化还原法测定钙。 (3)返滴定法:例:配位滴定法测定铝。 (4)置换滴定法:例:AlY AlF6 2- + Y 4- ZnY

三、滴定分析对化学反应的要求 ()反应定量完成 (KMnO,+Na2S2O3)? (2)无副反应 3)反应完全 (KMw大;KsP小,满足滴定要求) (④反应速度快 (⑤)有比较简便的方法确定反应终点 2024=9-13 上页 下页 返回
2024-9-13 三、滴定分析对化学反应的要求 (1) 反应定量完成 (KMnO4 ,+ Na2S2O3) ? (2)无副反应 (3)反应完全 (K’ MY大;KSp小,满足滴定要求) (4)反应速度快 (5)有比较简便的方法确定反应终点

四、标准溶液的配制及浓度的确定 1.标准溶液和基准物 标准溶液的浓度通过基准物来确定。 基准物应具备的条件: (1)必须具有足够的纯度; (2)组成与化学式完全相同: (3)稳定; (4)具有较大的摩尔质量,为什么? (可降低称量误差)。 常用的基准物有: K2Cr207;NaC204;H2C2042H2; Na2B407.10H20; CaCO3;NaCl;Na2CO3 202469- 页 下页 返回
2024-9-13 四、标准溶液的配制及浓度的确定 1. 标准溶液和基准物 标准溶液的浓度通过基准物来确定。 基准物应具备的条件: (1)必须具有足够的纯度; (2)组成与化学式完全相同; (3)稳定; (4)具有较大的摩尔质量,为什么? (可降低称量误差)。 常用的基准物有: K2Cr2O7; NaC2O4; H2C2O4 .2H2; Na2B4O7 .10H2O; CaCO3;NaCl;Na2CO3

2.标准溶液的配制 直接配制法:直接用容量瓶配制,定容。 可直接配制标准溶液的物质应具备的条件: (1)必须具备有足够的纯度 一般使用基准试剂或优级纯; (2)物质的组成应与化学式完全相等 应避免: (1)结晶水丢失; (2)吸湿性物质潮解; (3)稳定一见光不分解,不氧化 溶 重铬酸钾可直接配制其标准溶液。 20249- 页 返 回
2024-9-13 2.标准溶液的配制 直接配制法:直接用容量瓶配制,定容。 可直接配制标准溶液的物质应具备的条件: (1) 必须具备有足够的纯度 一般使用基准试剂或优级纯; (2)物质的组成应与化学式完全相等 应避免:(1)结晶水丢失; (2)吸湿性物质潮解; (3)稳定——见光不分解,不氧化 重铬酸钾可直接配制其标准溶液
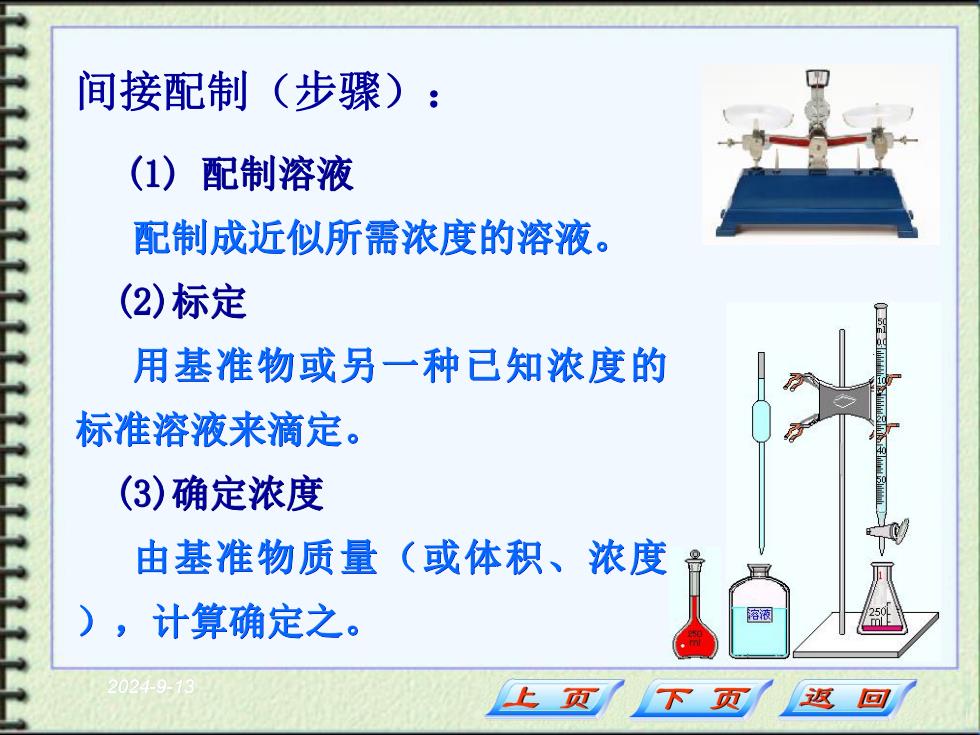
间接配制(步骤): (1 0 配制溶液 配制成近似所需浓度的溶液。 (2)标定 用基准物或另一种已知浓度的 标准溶液来滴定。 (3)确定浓度 由基准物质量(或体积、浓度 ),计算确定之。 溶液 20249-1 上页 下页 返回
2024-9-13 间接配制(步骤): (1) 配制溶液 配制成近似所需浓度的溶液。 (2)标定 用基准物或另一种已知浓度的 标准溶液来滴定。 (3)确定浓度 由基准物质量(或体积、浓度 ),计算确定之

五、 标准溶液浓度表示法 1.物质的量浓度 单位体积溶液中所含溶质的物质的量。 c=n/V单位 mol /L 应指明基本单元:原子、分子、离子、电子等。 2.滴定度 一与每毫升标准溶液相当的待测组分的质量。 表示法:T待测物/滴定剂 单位:g/mL 20249-13 上页 下页 返回
2024-9-13 五、标准溶液浓度表示法 1.物质的量浓度 ——单位体积溶液中所含溶质的物质的量。 c = n / V 单位 mol / L 应指明基本单元:原子、分子、离子、电子等。 2.滴定度 ——与每毫升标准溶液相当的待测组分的质量。 表示法:T待测物/滴定剂 单 位:g / mL

例: 用0.02718mo/L的高锰酸钾标准溶液测定铁含量 其浓度用滴定度表示为: TFe/KMno=0.007590 g/mL 即:表示1 nL KMn04标准溶液相当于0.007590 克铁。测定时,根据滴定所消耗的标准溶液体积可 方便快速确定试样中铁的含量: m Fe=TFe/KMnOVKMnO 通式: TAB=(a/b)·cB'M4·103 20249-13 上 页 下页 返回
2024-9-13 例: 用0.02718mol/L的高锰酸钾标准溶液测定铁含量 ,其浓度用滴定度表示为: T Fe/KMnO4 = 0.007590 g/mL 即:表示1mL KMnO4标准溶液相当于0.007590 克铁。测定时,根据滴定所消耗的标准溶液体积可 方便快速确定试样中铁的含量: m Fe = T Fe / KMnO4 V KMnO4 通式: TA/B= (a / b ) · cB · MA · 10 -3

六、滴定分析中的计算 被测物与滴定剂之间物质的量的关系: 1.直接滴定(涉及一个反应) 滴定剂与被测物之间的反应式为: aA+bB=cC+dD 当滴定到化学计量点时,a摩尔A与b摩尔B作用完全: 则:na/nB=a/b, nA=(a/b).nB (c·V)a=(a/b)(c·V)B 或:(e·V)A=(a/bD)(W/MB 酸碱滴定中,标准溶液浓度通常为:01mol/L左右,滴定剂 消耗体积在20~30mL之间,由此数据可计算称取试样量的上 限和下限。 返 回
2024-9-13 六、滴定分析中的计算 被测物与滴定剂之间物质的量的关系: 1.直接滴定(涉及一个反应) 滴定剂与被测物之间的反应式为: a A + b B = c C + d D 当滴定到化学计量点时,a 摩尔 A 与 b 摩尔 B 作用完全: 则: nA / nB = a / b , nA = (a / b) · nB (c · V )A = (a / b )·(c · V )B 或:(c · V )A = (a / b)·(W / M)B 酸碱滴定中,标准溶液浓度通常为:0.1 mol/L 左右,滴定剂 消耗体积在 20~30mL 之间,由此数据可计算称取试样量的上 限和下限