
第3章化学反应速率 3.1反应速率的定义 3.2反应速率与反应物浓度的关系 3.3反应机理 3.4反应物浓度与时间的关系 3.5反应速率理论简介 3.6温度对化学反应速率的影响 3.7催化剂与催化反应简介
3.1 反应速率的定义 3.2 反应速率与反应物浓度的关系 3.3 反应机理 3.4 反应物浓度与时间的关系 3.5 反应速率理论简介 3.6 温度对化学反应速率的影响 3.7 催化剂与催化反应简介 第3章 化学反应速率

热力学与动力学 热力学只解决了反应进行的可能性问题,而 没有解决现实性问题。 化学动力学是研究化学反应的速率和各种因 素对反应速率的影响、以及探讨反应机理的科学。 研究化学动力学,不但能从理论上认识反应 过程的本质和各类反应的规律,而且对指导化工 实践也具重要意义
热力学与动力学 热力学只解决了反应进行的可能性问题,而 没有解决现实性问题。 化学动力学是研究化学反应的速率和各种因 素对反应速率的影响、以及探讨反应机理的科学。 研究化学动力学,不但能从理论上认识反应 过程的本质和各类反应的规律,而且对指导化工 实践也具重要意义

3.1反应速率的定义 化学反应速率,是指反应进程中某时间间隔 内参加反应的物质的量的变化量,可以用单位时 间内反应物的减少的量或者生成物增加的量来表 示。体积一定时,可用浓度表示。 所以反应速率具有“浓度时间1”的量纲。 浓度常用物质的量浓度(ol/L)表示。时间单 位视反应中反应快慢用秒(s)、分(min)、小时(h) 表示
化学反应速率,是指反应进程中某时间间隔 内参加反应的物质的量的变化量,可以用单位时 间内反应物的减少的量或者生成物增加的量来表 示。体积一定时,可用浓度表示。 所以反应速率具有“浓度•时间-1”的量纲。 浓度常用物质的量浓度(mol/L)表示。时间单 位视反应中反应快慢用秒(s)、分(min)、小时(h) 表示。 3.1 反应速率的定义

3.1.1平均反应速率 不同时间间隔内,反应的平均速率不同 用反应物与生成物表示反应速率,符号不同, 数值也可能不同。为避免,可用如下表达式来表 示化学反应速率。 v= △t △C,=C.5-C4
不同时间间隔内,反应的平均速率不同 用反应物与生成物表示反应速率,符号不同, 数值也可能不同。为避免,可用如下表达式来表 示化学反应速率。 3.1.1 平均反应速率 2 1 i i,t i,t c = c − c t c v i i = ν 1
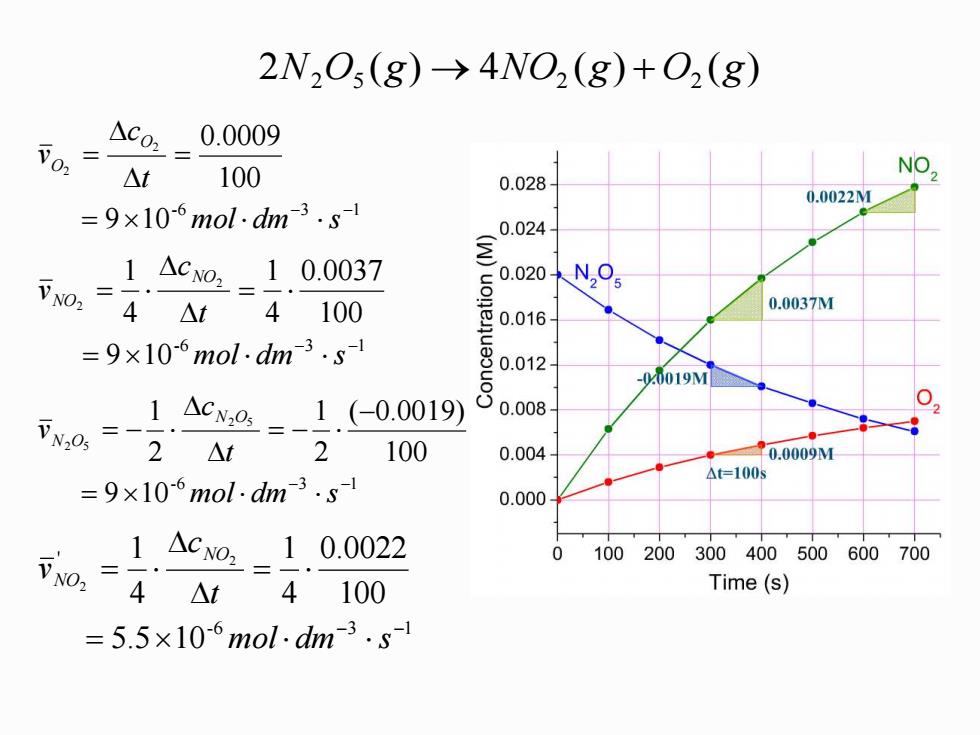
2N,Os(g)->4NO,(g)+0,(g) 0, △co,_0.0009 △t 100 NO 0.028 0.0022M =9×10-6mol.dhm3.s 0.024 1.△c02-1.0.0037 V02= 4△t 4100 0.0037M 0.016 =9×10-6mol.dm3.sl 00m2 00081 -0.0019M N0,= -1.Acx@=-1.(-0.0019) 2 △t 100 0.004 0.0009M △=1005 =9×l0-6mol:dm3.s 0.000 1△co2-10.0022 0100200300400500600700 可o,=4At 4100 Time(s) =5.5×106mol-dm3.s1
2 ( ) 4 ( ) ( ) N2 O5 g → NO2 g + O2 g -6 3 1 9 10 100 2 0.0009 2 − − = = = mol dm s t c v O O -6 3 1 9 10 100 0.0037 4 1 4 1 2 2 − − = = = mol dm s t c v NO NO -6 3 1 9 10 100 ( 0.0019) 2 1 2 1 2 5 2 5 − − = − = − = − mol dm s t c v N O N O -6 3 1 ' 5.5 10 100 0.0022 4 1 4 1 2 2 − − = = = mol dm s t c v NO NO
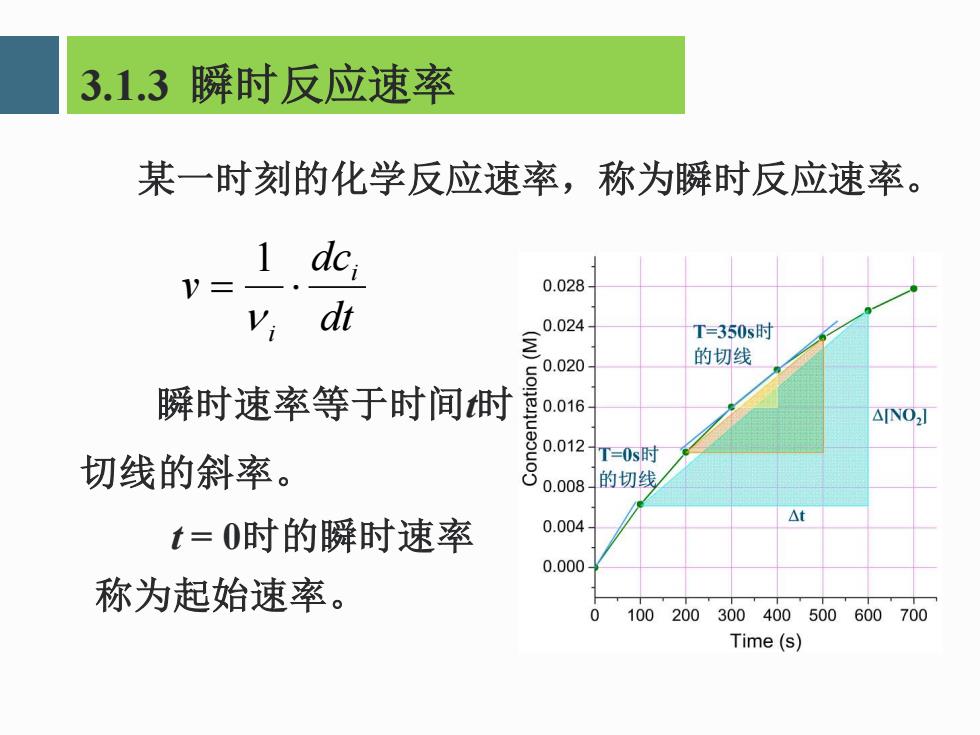
3.1.3瞬时反应速率 某一时刻的化学反应速率,称为瞬时反应速率。 1 dci V=- 0.028 v;dt 0.024 T=350s时 的切线 瞬时速率等于时间时 每0.016 △NO,J 切线的斜率。 复0.012T=0s时 0.008的切线 t=0时的瞬时速率 0.004 △t 0.000 称为起始速率。 0 100200300400500600700 Time(s)
某一时刻的化学反应速率,称为瞬时反应速率。 dt dc v i i = 1 t = 0时的瞬时速率 称为起始速率。 瞬时速率等于时间t时 切线的斜率。 3.1.3 瞬时反应速率

3.2反应速率与反应物浓度的关系 化学反应的速率方程(ate law):反应速 率与反应物浓度直接相关,表示反应速率与浓 度等之间的关系式。 aA+bB→products (a) (b) (c) (d) 9 18 18 36
3.2反应速率与反应物浓度的关系

3.2.1速率方程 对于反应aA+bB=gG+hH v=k[c(A)]imM[c(B)]" 常数k称为反应的速率常数rate contants)。 m称为反应物A的反应级数,n称为反应物B的反 应级数。k,m和n均可由实验测得
对于反应 aA + bB = gG + hH v = k[c(A)]m[c(B)]n 常数k称为反应的速率常数(rate contants)。 m称为反应物A的反应级数,n称为反应物B的反 应级数。k,m和n均可由实验测得。 3.2.1 速率方程
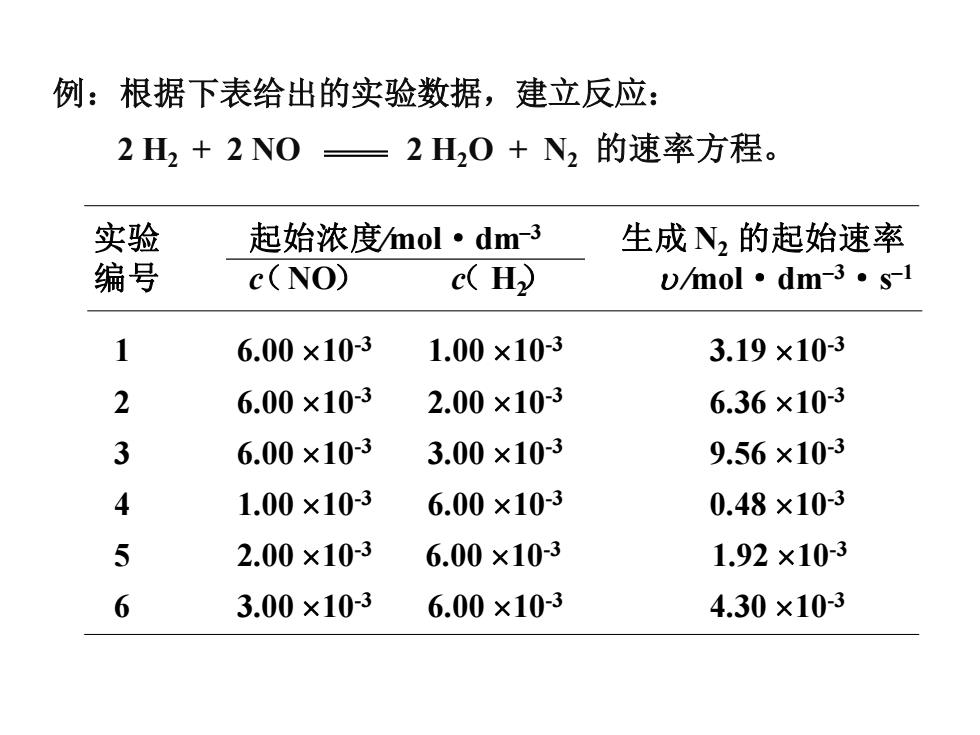
例:根据下表给出的实验数据,建立反应: 2H2+2NO= 2H20+N2的速率方程。 实验 起始浓度mol·dm-3 生成N2的起始速率 编号 c(NO) c(H2 vmol·dm-3·s-l 1 6.00×10-3 1.00×10-3 3.19×10-3 2 6.00×10-3 2.00×10-3 6.36×10-3 3 6.00×10-3 3.00×10-3 9.56×10-3 4 1.00×10-3 6.00×10-3 0.48×103 5 2.00×10-3 6.00×10-3 1.92×10-3 6 3.00×10-3 6.00×10-3 4.30×10-3
例:根据下表给出的实验数据,建立反应: 2 H2 + 2 NO 2 H2O + N2 的速率方程。 实验 起始浓度∕mol·dm–3 生成 N2 的起始速率 编号 c NO c H2 ∕mol·dm–3·s –1 1 6.00 10-3 1.00 10-3 3.19 10-3 2 6.00 10-3 2.00 10-3 6.36 10-3 3 6.00 10-3 3.00 10-3 9.56 10-3 4 1.00 10-3 6.00 10-3 0.48 10-3 5 2.00 10-3 6.00 10-3 1.92 10-3 6 3.00 10-3 6.00 10-3 4.30 10-3 ( ) ( )
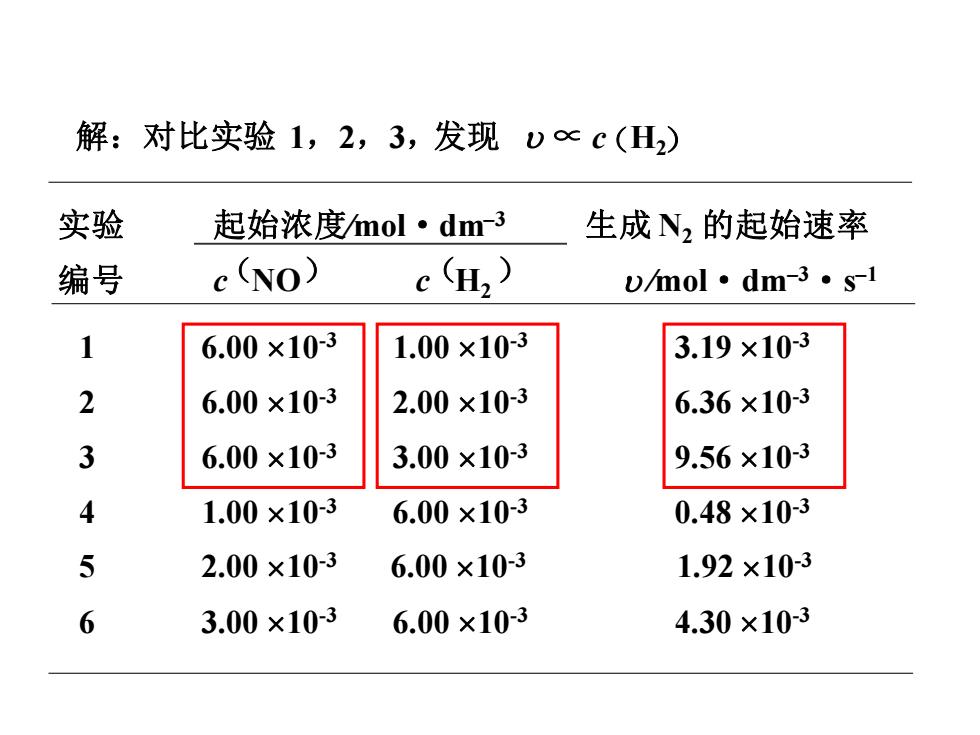
解:对比实验1,2,3,发现D∝c(H2) 实验 起始浓度mol·dm-3 生成N,的起始速率 编号 e (NO) eH2) wmol·dm-3·s-1 1 6.00×10-3 1.00×10-3 3.19×103 2 6.00×10-3 2.00×10-3 6.36×10-3 3 6.00×10-3 3.00×10-3 9.56×103 4 1.00×10-3 6.00×10-3 0.48×10-3 5 2.00×10-3 6.00×10-3 1.92×10-3 6 3.00×10-3 6.00×10-3 4.30×10-3
解:对比实验 1,2,3,发现 ∝ c(H2) 实验 起始浓度∕mol·dm–3 生成 N2 的起始速率 编号 c NO c H2 ∕mol·dm–3·s –1 1 6.00 10-3 1.00 10-3 3.19 10-3 2 6.00 10-3 2.00 10-3 6.36 10-3 3 6.00 10-3 3.00 10-3 9.56 10-3 4 1.00 10-3 6.00 10-3 0.48 10-3 5 2.00 10-3 6.00 10-3 1.92 10-3 6 3.00 10-3 6.00 10-3 4.30 10-3 ( ) ( )