
第5章原子结构和元素 周期律 5.1近代原子结构理论的确立 5.2微观粒子运动的特殊性 5.3核外电子运动状态的描述 5.4核外电子排布 5.5元素周期表 5.6元素基本性质的周期性
第5章 原子结构和元素 周期律 5.1 近代原子结构理论的确立 5.2 微观粒子运动的特殊性 5.3 核外电子运动状态的描述 5.4 核外电子排布 5.5 元素周期表 5.6 元素基本性质的周期性

5.1近代原子结构理论的确立 5.1.1原子结构模型 时间 模型类型 内容 1803年 Dolton学说 “球状模型” 1904年 Thomson模型 “葡萄干布丁” 1911年 Rutherford模型 “有核模型” (α粒子轰击金箔) 1913年 Bohr模型 “电子分层排布模型” (氢原子光谱) (能级概念引入了量子化条件) 1926年 量子力学模型 波粒二象性
5.1.1 原子结构模型 5.1 近代原子结构理论的确立 时间 模型类型 内容 1803年 Dolton学说 “球状模型” 1904年 Thomson模型 “葡萄干布丁” 1911年 Rutherford模型 “有核模型” (α粒子轰击金箔) 1913年 Bohr模型 “电子分层排布模型” (氢原子光谱) (能级概念 引入了量子化条件) 1926年 量子力学模型 波粒二象性
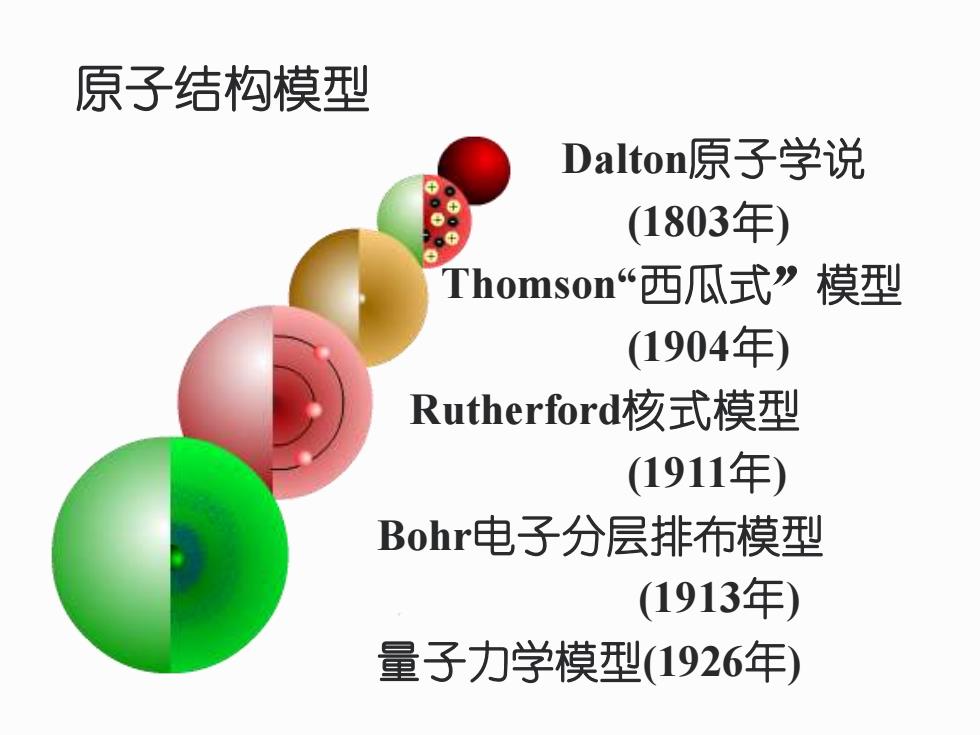
原子结构模型 Dalton原子学说 。e 1803年) Thomson“西瓜式”模型 (1904年) Rutherford核式模型 (1911年) Bohr电子分层排布模型 (1913年) 量子力学模型(1926年)
原子结构模型 Dalton原子学说 (1803年) Thomson“西瓜式”模型 (1904年) Rutherford核式模型 (1911年) Bohr电子分层排布模型 (1913年) 量子力学模型(1926年)

5.1.2氢原子光谱 自然界中的光谱(连续光谱)
5.1.2 氢原子光谱 自然界中的光谱(连续光谱)

连续光谱(实验室)
连续光谱(实验室)
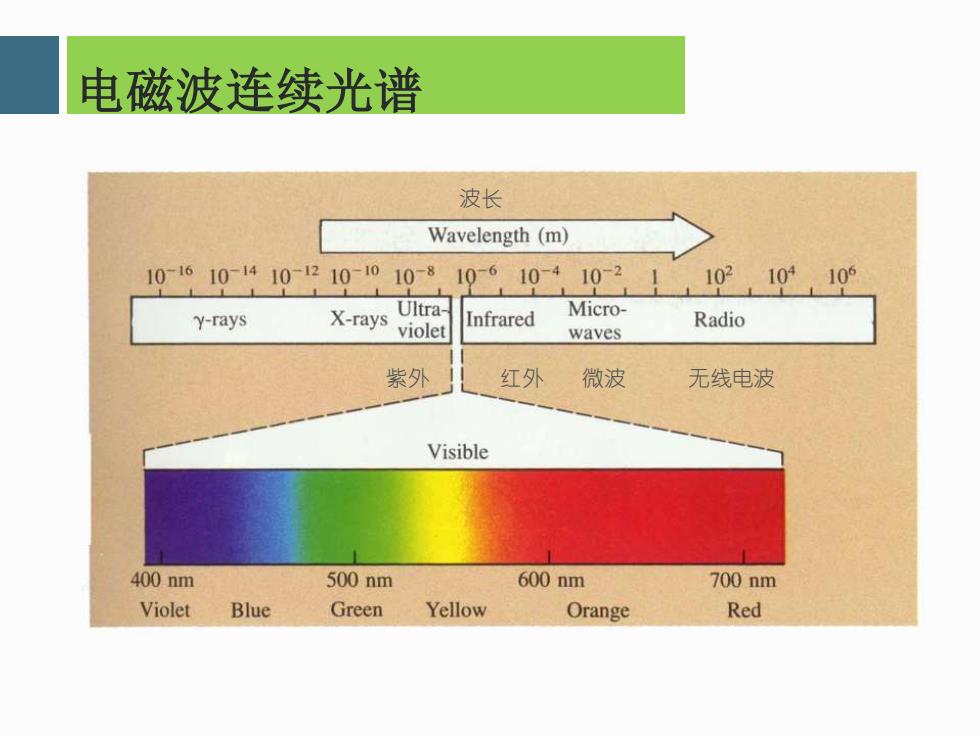
电磁波连续光谱 波长 Wavelength (m) 10-1610-1410-1210-1010-8 10-610-4 10-2 10210,10 Ultra- Micro- Y-rays X-rays Infrared Radio violet waves 紫外 红外 微波 无线电波 Visible 400nm 500nm 600nm 700nm Violet Blue Green Yellow Orange Red
电磁波连续光谱 紫外 红外 微波 无线电波 波长
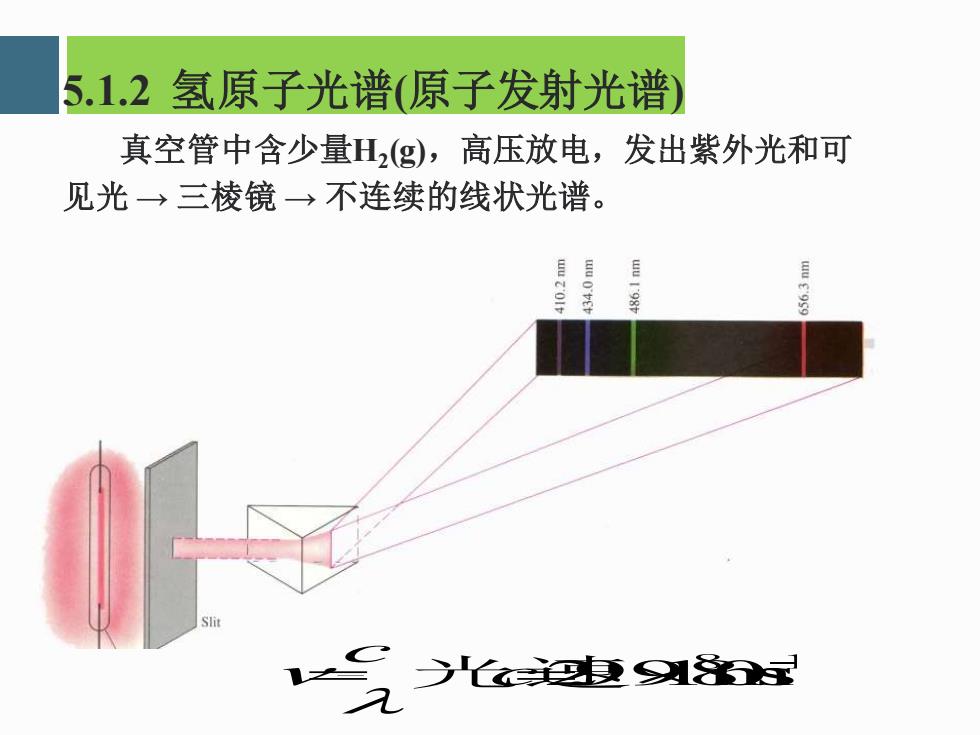
5.1.2氢原子光谱(原子发射光谱 真空管中含少量H(g),高压放电,发出紫外光和可 见光→三棱镜→不连续的线状光谱。 目 Slit 1气光泡9x
5.1.2 氢原子光谱(原子发射光谱) 真空管中含少量H2 (g),高压放电,发出紫外光和可 见光 → 三棱镜 → 不连续的线状光谱。 8 1 2.99810ms − = c= c光速
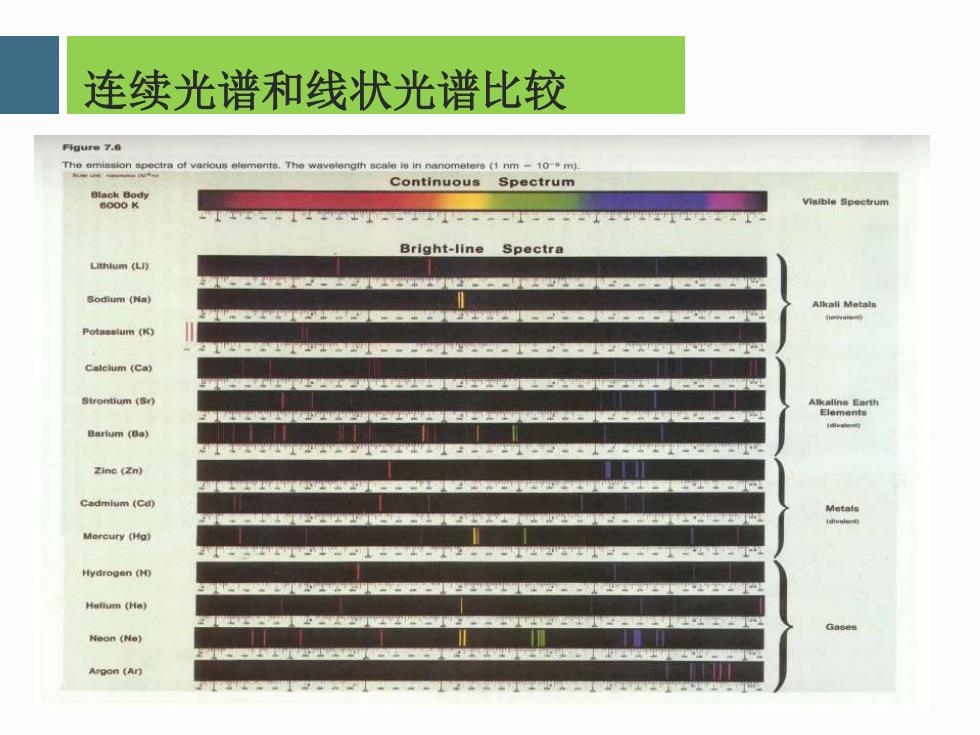
连续光谱和线状光谱比较 马aure7.a Continuous Spectrum BOOK Viaible Spectrum -1-1μ1I Bright-line Spectra Lithium (L) Sodium (Na) Poteesium (K) Calclum (Ca) Strontlum(s) Bartum (Ba) Zine (Zn) Cadmlum(Cd) Mercury(Ho】 Hydrogen (H) Hetlum (He) Neon(Ne) Argon (Ar)
连续光谱和线状光谱比较

氢原子光谱的经验方程 波长:410.2434.0486.1 656.6单位:nm 编号:HHHB Ha 氢原子光谱特征: 1.不连续光谱,即线状光谱; 2.其频率具有一定的规律
氢原子光谱的经验方程 氢原子光谱特征: 1.不连续光谱,即线状光谱; 2.其频率具有一定的规律。 编号:Hδ Hγ Hβ Hα 波长:410.2 434.0 486.1 656.6 单位:nm

氢原子光谱的经验方程 Balmer经验公式: c=1/=1.09677×107(1/22-1/n2)m1 σ为波数,1为波长。 (n=3,4,5,6) 式中,2是什么意义? n、1.09677×107又分别代表什么意义?
Balmer经验公式: σ = 1/λ=1.09677107 (1 / 22 – 1/ n2 )m-1 σ为波数, λ 为波长。 (n = 3, 4, 5, 6) 式中,2是什么意义? n、 1.09677107又分别代表什么意义? 氢原子光谱的经验方程