
生 第7章晶体结构 7.1分子晶体和分子间作用力 7.2离子晶体和离子键 7.3离子极化
第7章 晶体结构 7.1 分子晶体和分子间作用力 7.2 离子晶体和离子键 7.3 离子极化

化学键:如果两个原子(或原子团)之间的作用力 强得足以形成稳定的、可被化学家看做独立物种的 聚集体,它们之间就存在化学键。简单地说,化学 键是指分子内部原子之间的强相互作用。 化学键形成的标志:当聚集体的能量低于原来原子 或离子的能量大约40kJmo1以上时,就认为形成了 化学键。 化学键的基本类型:离子键、共价键、金属键
化学键:如果两个原子(或原子团)之间的作用力 强得足以形成稳定的、可被化学家看做独立物种的 聚集体,它们之间就存在化学键。简单地说,化学 键是指分子内部原子之间的强相互作用。 化学键形成的标志:当聚集体的能量低于原来原子 或离子的能量大约40kJmol-1以上时,就认为形成了 化学键。 化学键的基本类型:离子键、共价键、金属键
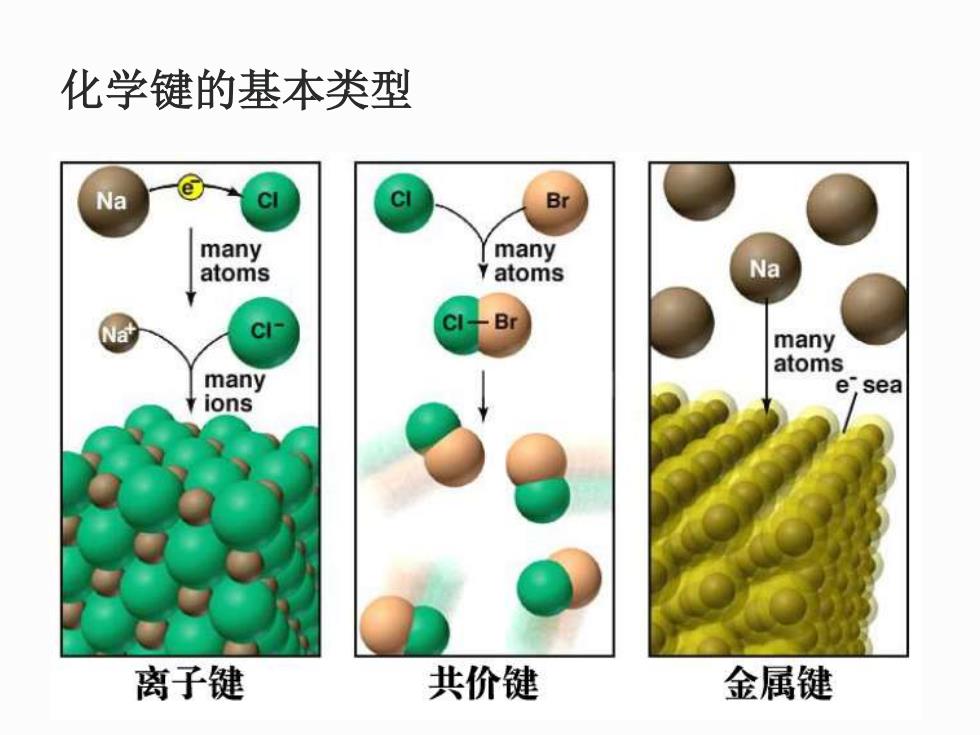
化学键的基本类型 Na Br many many atoms Y atoms Na CI- B many atoms many e sea ions 离子键 共价键 金属键
化学键的基本类型

7.1分子晶体和分子间作用力 分子之间以分子间作用力结合成的晶体称为分 子晶体。 分子间作用力是一种弱相互作用,远小于化学 键的结合强度。 因此,分子晶体一般来说要在较低的温度下才 能形成,而在常温时这些物质多以气体形式存在。 分子晶体导电性能一般较差,因为电子从一个 分子传导到另一个分子很不容易
7.1 分子晶体和分子间作用力 分子之间以分子间作用力结合成的晶体称为分 子晶体。 分子间作用力是一种弱相互作用,远小于化学 键的结合强度。 因此,分子晶体一般来说要在较低的温度下才 能形成,而在常温时这些物质多以气体形式存在。 分子晶体导电性能一般较差,因为电子从一个 分子传导到另一个分子很不容易

7.1.1键的极性与分子的极性 一、键的极性 假设一个共价键的正负电荷可以集中在一个 点上时,形成相应的“正(负)电荷重心”。此正 (负)电荷重心为电偶极子的两极。 偶极矩μ=偶极子电量q×偶极子两极的距离1 1.偶极矩为矢量,方向从正电中心指向负电中心。 2.单位为德拜,数量级常在1030℃·m
7.1.1 键的极性与分子的极性 一、键的极性 假设一个共价键的正负电荷可以集中在一个 点上时,形成相应的“正(负)电荷重心” 。此正 (负)电荷重心为电偶极子的两极。 偶极矩μ = 偶极子电量 q×偶极子两极的距离l 1.偶极矩为矢量,方向从正电中心指向负电中心。 2.单位为德拜,数量级常在10-30C·m

键的极性 1.共价键有极性键和非极性键之分。当=0时,即 正(负)电荷中心重合的时候,为非极性键,当 μ0时,为极性键。 2.同种原子形成的共价键,一般为非极性键;不同 种分子形成的共价键,由于原子的电负性不同,会 导致共用电子对偏向于电负性较大的一边,导致正 (负)电荷中心不重合,形成极性键
键的极性 1.共价键有极性键和非极性键之分。 当μ=0时,即 正(负)电荷中心重合的时候,为非极性键,当 μ≠0时,为极性键。 2.同种原子形成的共价键,一般为非极性键;不同 种分子形成的共价键,由于原子的电负性不同,会 导致共用电子对偏向于电负性较大的一边,导致正 (负)电荷中心不重合,形成极性键

二、分子的极性 假设一个分子的正负电荷可以集中在一个点上 时,也会形成相应的“正(负)电荷重心”。如果 二者重合在一个点上,分子就为非极性分子,如果 二者不重合,分子就是极性分子。极性分子的偶极 矩称为固有偶极(永久偶极)。 双原子分子的极性与其键的极性一致。 多原子分子的极性不仅与其键的极性有关, 还与分子的空间几何构型有关
二、分子的极性 假设一个分子的正负电荷可以集中在一个点上 时,也会形成相应的“正(负)电荷重心” 。如果 二者重合在一个点上,分子就为非极性分子,如果 二者不重合,分子就是极性分子。极性分子的偶极 矩称为固有偶极(永久偶极)。 双原子分子的极性与其键的极性一致。 多原子分子的极性不仅与其键的极性有关, 还与分子的空间几何构型有关

多原子分子的极性 1.由非极性键构成的多原子分子,多为非极性分子。 例外:03 2.由极性键构成的多原子分子,既可能是极性分子, 也可能是非极性分子。具体要看其分子的空间几何 构型是否对称。 3.一个特例C0
多原子分子的极性 1.由非极性键构成的多原子分子,多为非极性分子。 例外:O3 2.由极性键构成的多原子分子,既可能是极性分子, 也可能是非极性分子。具体要看其分子的空间几何 构型是否对称。 3.一个特例CO
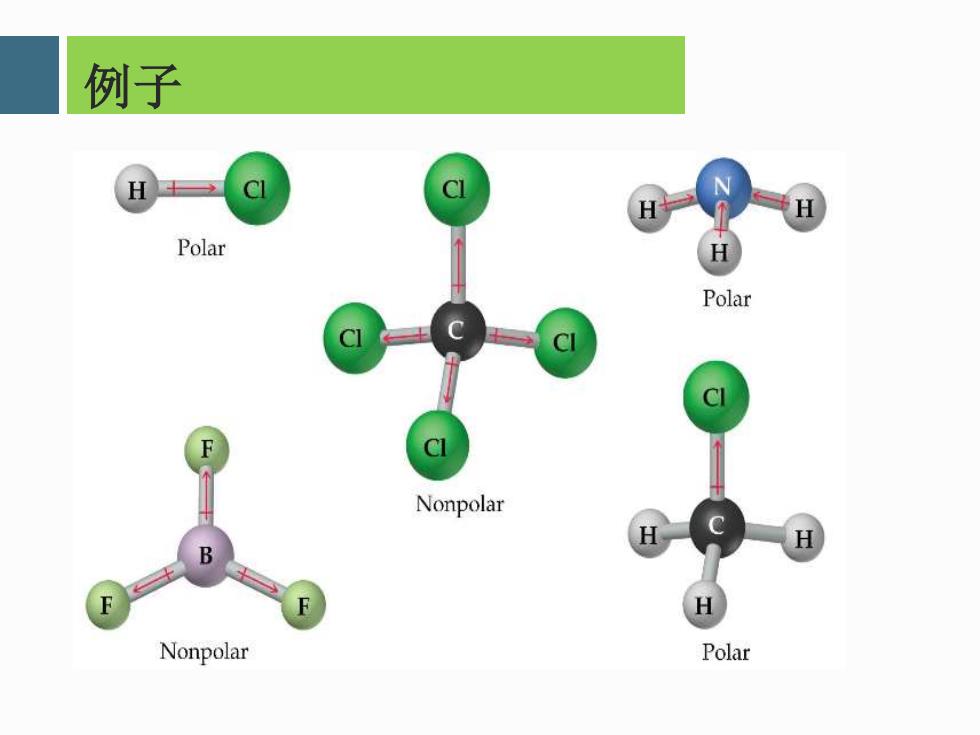
例子 H Polar Polar Nonpolar B Nonpolar Polar
例子

7.1.2范德华力 19世纪后期,范德华发现实际气体的行为偏 离理想气体,范德华方程式中的修正项与分 子间的作用力有关。所以,分子间作用力也 称为范德华力。 范德华力包括三部分:色散力、取向力、诱 导力
7.1.2 范德华力 19世纪后期,范德华发现实际气体的行为偏 离理想气体,范德华方程式中的修正项与分 子间的作用力有关。所以,分子间作用力也 称为范德华力。 范德华力包括三部分:色散力、取向力、诱 导力