
第5章酸碱滴定法 5.1溶液中的酸碱反应与平衡 5.2酸碱组分的平衡浓度与分布分数δ 5.3溶液中H+浓度的计算 5.4对数图解法 5.5酸碱缓冲溶液 5.6酸碱指示剂 5.7酸碱滴定原理 5.8终点误差 59酸碱滴定法的应用 5.10非水溶液中的酸碱滴定
1 第5章 酸碱滴定法 5.1 溶液中的酸碱反应与平衡 5.2 酸碱组分的平衡浓度与分布分数δ 5.3 溶液中H+浓度的计算 5.4 对数图解法 5.5 酸碱缓冲溶液 5.6 酸碱指示剂 5.7 酸碱滴定原理 5.8 终点误差 5.9 酸碱滴定法的应用 5.10 非水溶液中的酸碱滴定
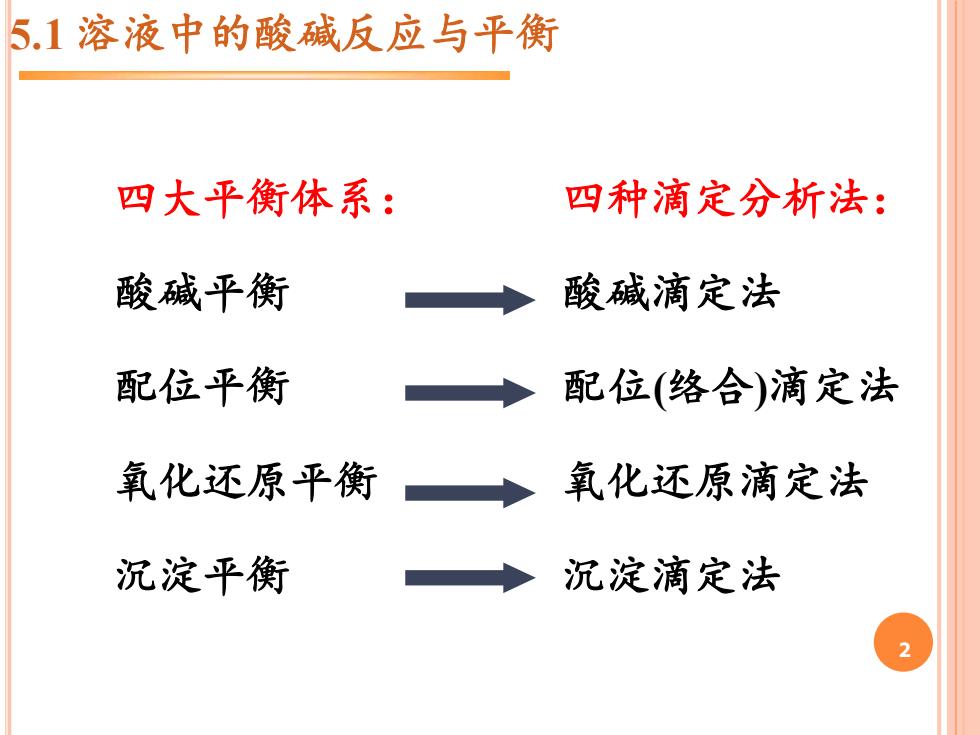
5.1溶液中的酸碱反应与平衡 四大平衡体系: 四种滴定分析法: 酸碱平衡 酸碱滴定法 配位平衡 配位(络合)滴定法 氧化还原平衡 沉淀平衡 二 氧化还原滴定法 沉淀滴定法
2 5.1 溶液中的酸碱反应与平衡 四大平衡体系: 酸碱平衡 配位平衡 氧化还原平衡 沉淀平衡 四种滴定分析法: 酸碱滴定法 配位(络合)滴定法 氧化还原滴定法 沉淀滴定法

5.1.1.离子的活度与活度系数 离子的活度:在化学反应中表现出来的有效浓度, 通常用;表示(activity) 4;=%Ci C:(concentration):第种离子的平衡浓度 gi (activity coefficient).:i离子的活度系数 溶液无限稀时:g=1,a:=c 中性分子:g:=1 3 溶剂活度:a=1
3 5.1.1. 离子的活度与活度系数 ai = gi ci 离子的活度:在化学反应中表现出来的有效浓度, 通常用ai表示 (activity) 溶液无限稀时: g i =1,ai = ci 中性分子: g i =1 溶剂活度: a =1 Ci(concentration):第i种离子的平衡浓度 gi (activity coefficient):i离子的活度系数

Debye-Hiickel公式: (稀溶液<0.1mo/L) -lgg:=0.512z2 1+B/I 离子强度较小时,水化离子大小可不考虑 lg8=0.512z1 商子强度(o),上F号∑cz I: B:常数,(=0.00328,25℃),与温度、介电常数有关, :离子体积参数(约等于水化离子的有效半径,以pm计); :离子电荷数
4 Debye-Hückel公式: (稀溶液 < 0.1 mol/L) I:离子强度(ionic strength), B: 常数, (=0.00328 ,25℃), 与温度、介电常数有关, å:离子体积参数(约等于水化离子的有效半径,以pm计) ; zi:i离子电荷数 -lggi = 0.512zi 2 I 1+Bå I -lggi=0.512zi 2 I n 2 i i i=1 1 I= c z 2 离子强度较小时,水化离子大小可不考虑

已知浓度求活度方法: 1、求1=∑c2☑ 2、求i-gY,=0.512Z[ +a 3、求a: a=yc 注:同样的离子强度对高价离子的影响要大得多
5 已知浓度求活度方法: 1、求 I: 2、求 i : 3、求a : 注:同样的离子强度对高价离子的影响要大得多。 = i i Zi I c 2 2 1 ] 1 å lg 0.512 [ 2 B I I i Zi + − g = a ci = g

例2.计算0.050moL1A1CL3溶液中C和A3+的活度。 解: 1=2∑cZ-0030x3+3x050x)=030ml-L 查附录表3,C的a=300,A13+的8=900;B=0.00328 =0.18 Ycr=0.66ar=Ycr[C1]=0.66×3×0.050=0.099(mo1.L1) -lgy4=0.512×32 √0.30 1+00328×900x030 =0.96 Y4=0.11aA.=y[A1+]=0.11x0.050=0.0055m01E
6 例2.计算0.050 mol·L-1AlCl3溶液中Cl-和Al3+的活度。 解: 查附录表3,Cl- 的å =300,Al3+的å =900;B =0.00328 1 2 2 i i i I c Z = 1 [ ] 0.66 3 0.050 0.099( ) Cl Cl a Cl mol L − − g − − = = = 1 2 2 1 (0.050 3 3 0.050 1 ) 0.30( ) 2 mol L− = + = 2 0.30 lg 0.512 1 0.18 1 0.00328 300 0.30 Cl g − − = = + 0.66 Cl g − = 3 2 0.30 lg 0.512 3 0.96 1 0.00328 900 0.30 Al g + − = = + 3 0.11 Al g + = 3 3 3 1 [ ] 0.11 0.050 0.0055( ) Al Al a Al mol L + + g + − = = =

5.1.2.溶液中的酸碱反应与平衡常数 1酸碱的定义 酸一能电离出H+的物质 。电离理论 碱 电离出OH的物质 酸 凡能接受电子的物质 。电子理论 碱—凡能给出电子的物质 酸一凡能给出质子的物质 。质子理论 碱 凡能接受质子的物质
7 1 酸碱的定义 电离理论 电子理论 质子理论 酸——能电离出H+的物质 碱——电离出OH-的物质 酸——凡能接受电子的物质 碱——凡能给出电子的物质 酸——凡能给出质子的物质 碱——凡能接受质子的物质 5.1.2.溶液中的酸碱反应与平衡常数
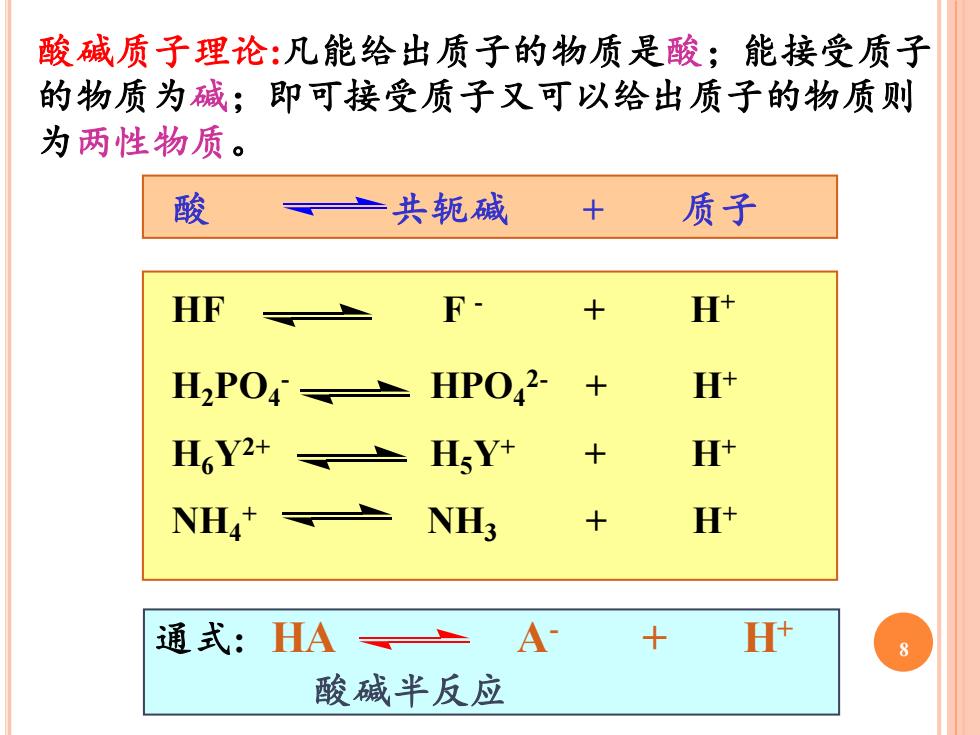
酸碱质子理论:凡能给出质子的物质是酸;能接受质子 的物质为碱;即可接受质子又可以给出质子的物质则 为两性物质。 酸 一共轭碱 质子 HF F H中 H2POHPO2- H+ H6Y2+ HsY+ H+ NH NH; H* 通式:HA=A+ H 酸碱半反应
通式: HA A 8 - + H+ 酸碱半反应 酸 共轭碱 + 质子 HF F - + H+ H2PO4 - HPO4 2- + H+ H6Y2+ H5Y+ + H+ NH4 + NH3 + H+ 酸碱质子理论:凡能给出质子的物质是酸;能接受质子 的物质为碱;即可接受质子又可以给出质子的物质则 为两性物质
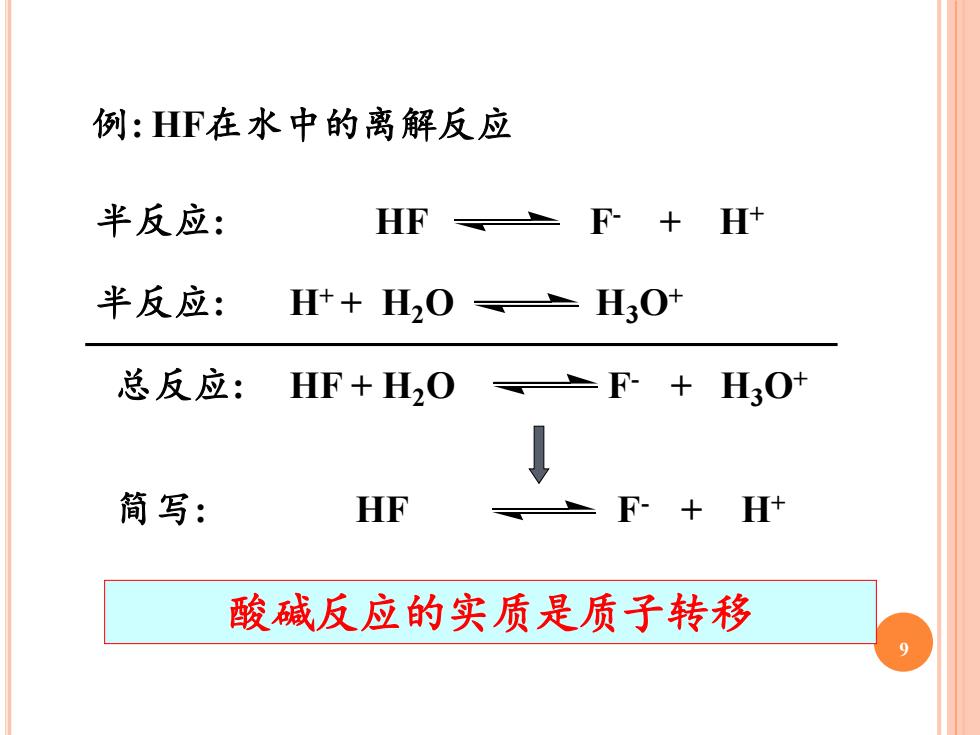
例:HF在水中的离解反应 半反应: HF F-+H+ 半反应: H++H2O H3O 总反应:HF+H2O F+H30+ ↓ 简写: HF F-+H 酸碱反应的实质是质子转移
9 例: HF在水中的离解反应 半反应: HF F- + H+ 半反应: H+ + H2O H3O+ 总反应: HF + H2O F- + H3O+ 简写: HF F- + H+ 酸碱反应的实质是质子转移

例:根据酸碱质子理论:凡能给出质子的粒子都是酸,凡 能与质子结合的微粒都是碱,酸碱不是彼此分开的,而是 统一在对质子的关系上,酸÷碱+质子(H+) 下列微粒既可作酸,又可作为碱的是 A、CH,CH,ONa B、 SO2Na C、NH4+ D、 COOK OH 10
10 例:根据酸碱质子理论:凡能给出质子的粒子都是酸,凡 能与质子结合的微粒都是碱,酸碱不是彼此分开的,而是 统一在对质子的关系上,酸 碱+质子(H+) 下列微粒既可作酸,又可作为碱的是 A、CH2CH2ONa B、 C、NH4 + D