
第11章配位化学基础 11.1配位化合物的基本概念 11.2配位化合物的价键理论 11.3配位化合物的晶体场理论 11.4配位化合物的稳定性
11.1 配位化合物的基本概念 11.2 配位化合物的价键理论 11.3 配位化合物的晶体场理论 11.4 配位化合物的稳定性 第11章 配位化学基础

11.1配位化合物的基本概念 1.由若干能给出电子对或非定域电子的分子或离 子(称“配位体”)与具有可以接受电子的空的价轨道 的中心离子(或中心原子)结合,按一定的组成和空间 构型而形成的结构单元,称为“配合单元”; 2配合单元除少部分不带电荷之外,大部分都带 定量的正、负电荷,称为配离子;(配阴离子、配 阳离子、配分子) 3.含有“配合单元”的物质,称为“配合物”(旧 称“络合物”,Complex)
11.1 配位化合物的基本概念 1.由若干能给出电子对或非定域电子的分子或离 子(称“配位体”)与具有可以接受电子的空的价轨道 的中心离子(或中心原子)结合,按一定的组成和空间 构型而形成的结构单元,称为“配合单元”; 2.配合单元除少部分不带电荷之外,大部分都带 一定量的正、负电荷,称为配离子;(配阴离子、配 阳离子、配分子) 3.含有“配合单元”的物质,称为“配合物”(旧 称“络合物”, Complex)

内界:中心原子或离子与配体以配位键结合在一起。 外界:与内界电荷平衡的相反离子。 中心离子 (central ion) 配体 (ligand) 配位数(coordination number) ICo(NH)C13 K3[Fe(CN) 内界 外界 外界 内界 配合物 配合物
内界:中心原子或离子与配体以配位键结合在一起。 外界:与内界电荷平衡的相反离子

配合物的组成 1.中心离子(原子):具有空价轨道的阳离子或原子, 大多数为过渡金属。少数为高氧化态的非金属。如: Cu2+、Ag+、Zn2+、Ni、Pt。 2配位体:具有孤电子对的离子或原子。 如:X-、NH3、H2O、OH-、 CN-、NSC-、SCN-、 3配位原子:配体中提供孤电子对的原子。 如上述X、N、O、C、S等
配合物的组成 1.中心离子(原子):具有空价轨道的阳离子或原子, 大多数为过渡金属。少数为高氧化态的非金属。如: Cu2+ 、Ag+ 、Zn2+ 、Ni、Pt。 2.配位体:具有孤电子对的离子或原子。 如:X-、NH3、H2O、OH-、 CN-、NSC-、SCN-、 3.配位原子:配体中提供孤电子对的原子。 如上述X、N、O、C、S等

配体分类 按配体所含的配位原子数可分为: 单齿配体:配体只含有一个配位原子,提供一对电 子用于配位。 如:X-、NHL3、H20、OH 双齿配体:配体有两个配位原子同时和一个中心原 子配位。 如:乙二胺NH2-CH2CH2-NH2, 草酸根C2042- 多齿配体:配体有三个以上配位原子同时和一个中 心原子配位。 如:乙二胺四乙酸EDTA
配体分类 按配体所含的配位原子数可分为: 单齿配体:配体只含有一个配位原子,提供一对电 子用于配位。 如: X-、NH3、H2O、OH- 双齿配体:配体有两个配位原子同时和一个中心原 子配位。 如:乙二胺NH2 -CH2 -CH2 -NH2, 草酸根C2O4 2- 多齿配体:配体有三个以上配位原子同时和一个中 心原子配位。 如:乙二胺四乙酸EDTA

配位数与配体数 配体数:配体的个数。 配位数:配合物中心原子周围的配位原子的个数。 当配体是单齿配合物是,二者相等。当配体不 是单齿配体时,配位数=配体数X齿数
配位数与配体数 配体数:配体的个数。 配位数:配合物中心原子周围的配位原子的个数。 当配体是单齿配合物是,二者相等。当配体不 是单齿配体时,配位数=配体数×齿数
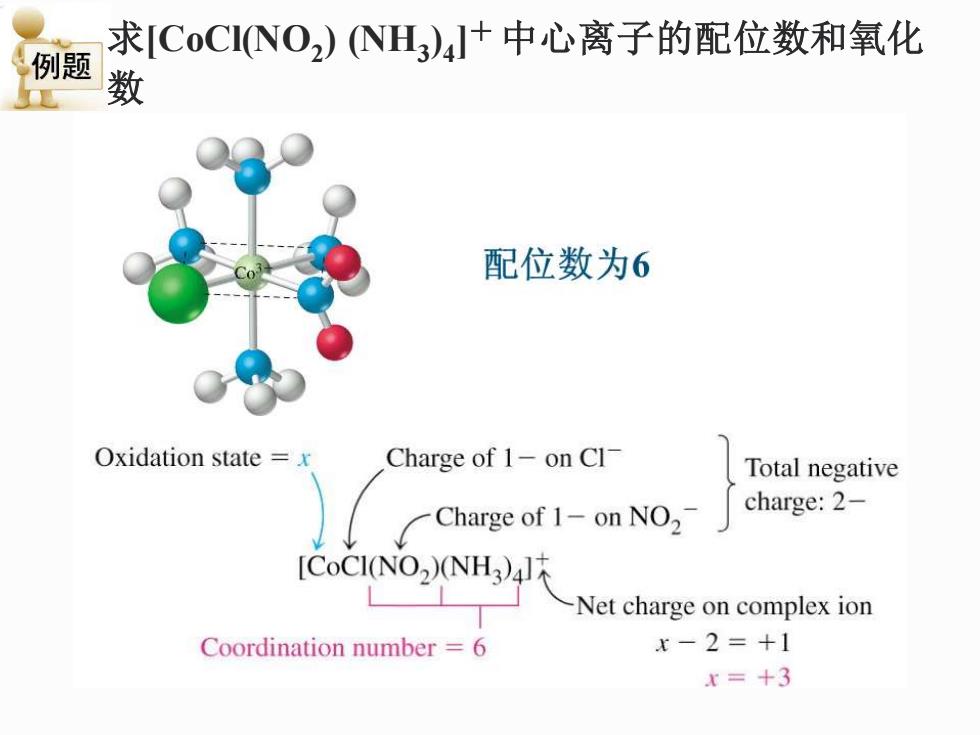
求[CoCI(NO2)NH)4+中心离子的配位数和氧化 例题 数 配位数为6 Oxidation state =x Charge of 1-on Cl Total negative 一Charge of1-onNO2 charge:2- [CoCI(NO2)(NH3)4 -Net charge on complex ion Coordination number 6 x-2=+1 x=+3
求[CoCl(NO2 ) (NH3 ) 4 ]+ 中心离子的配位数和氧化 数

影响配位数C.N的因素 (1)中心离子(原子)的性质: ①电荷数↑,CN个 Ag(NH3)2 C.N=2 PtCl2- C.N=4 Cu(NH3)42+ C.N=4 PtCl2- C.N=6 ②半径↑,C.N↑ 中心离子 C.N.max BF4 第二周期 4 [AIF6J3- 第三、四周期 6 第五、六周期 10 ③外层电子构型:d C.N=6 [AF]3 d C.N=6 [Ti4,0]3 d C.N=4 [Ni(CN)P C.N=4 [Cu(NH)T
影响配位数C.N的因素 (1)中心离子(原子)的性质: ①电荷数↑,C.N↑ Ag(NH3 )2 + C.N=2 PtCl4 2- C.N= 4 Cu(NH3 )4 2+ C.N=4 PtCl6 2- C.N= 6 ②半径r↑,C.N↑ 中心离子 C.N.max [BF4 ] - 第二周期 4 [AlF6 ] 3- 第三、四周期 6 第五、六周期 10 ③外层电子构型: ( ) ( ) ( ) + − + − = = = = 2 3 4 9 2 4 8 3 2 6 1 3 6 0 d C.N 4 [Cu NH ] d C.N 4 [Ni CN ] d C.N 6 [Ti H O ] d C.N 6 [AlF ]

影响配位数CN的因素 (2)配体性质(电荷、半径) ①负电荷数↑,CN.↓(互斥作用↑) [Zn(NH)]2+ [ZnCL]2+ ②半径r个,C.N.(空间位阻) [AIF13- [AICLI (3)配合物生成条件(浓度、温度) ①配体浓度↑,CN↑ Fe3++XSCN-=[Fe(NCS)x](x-3) X=16 ②温度↑,CN.↓(加速配合物离解)
影响配位数C.N的因素 (2)配体性质(电荷、半径) ①负电荷数↑,C.N.↓(互斥作用↑) [Zn(NH3 ) 6 ] 2+ [ZnCl4 ] 2+ ②半径r↑,C.N.↓(空间位阻) [AlF6 ] 3- [AlCl4 ] - (3)配合物生成条件(浓度、温度) ①配体浓度↑,C.N.↑ Fe3+ + XSCN- = [Fe(NCS)X] (X-3)- X=1~6 ②温度↑,C.N.↓(加速配合物离解)

配合物的种类 一、单核配合物 1.简单配合物: [Cu (NH3)4JSO4,K3[Fe(CN)G] 2.螯合物:整合物是由中心离子和多齿配体结合而成的具 有环状结构的配合物。每一个环上含有几个原子则称为几 元环,一般五元、六元较多。 [Cu(en)2]2,[Ca(EDTA)]2 二、多核配合物 NH2 /\ (NH3)Co Co (NH3)4 1/ NH2
配合物的种类 一、单核配合物 1.简单配合物: [Cu (NH3 )4 ]SO4 , K3 [Fe(CN)6 ] 2.螯合物:螯合物是由中心离子和多齿配体结合而成的具 有环状结构的配合物。每一个环上含有几个原子则称为几 元环,一般五元、六元较多。 [Cu(en)2 ] 2+ , [Ca(EDTA)]2+ 二、多核配合物 NH2 / \ (NH3 )4Co Co (NH3 )4 \ / NH2