
第4章化学平衡 4.1化学平衡状态 4.2化学反应进行的方向 4.3标准平衡常数与的关系 4.4化学平衡的移动
第4章 化学平衡 4.1 化学平衡状态 4.2 化学反应进行的方向 4.3 标准平衡常数与的关系 4.4 化学平衡的移动

化学平衡是研究化学反应体系的平衡问题: a.化学反应的方向和限度问题; b.各种状态反应的平衡常数表示式: c.各种条件对化学平衡的影响
化学平衡是研究化学反应体系的平衡问题: a.化学反应的方向和限度问题; b.各种状态反应的平衡常数表示式; c.各种条件对化学平衡的影响
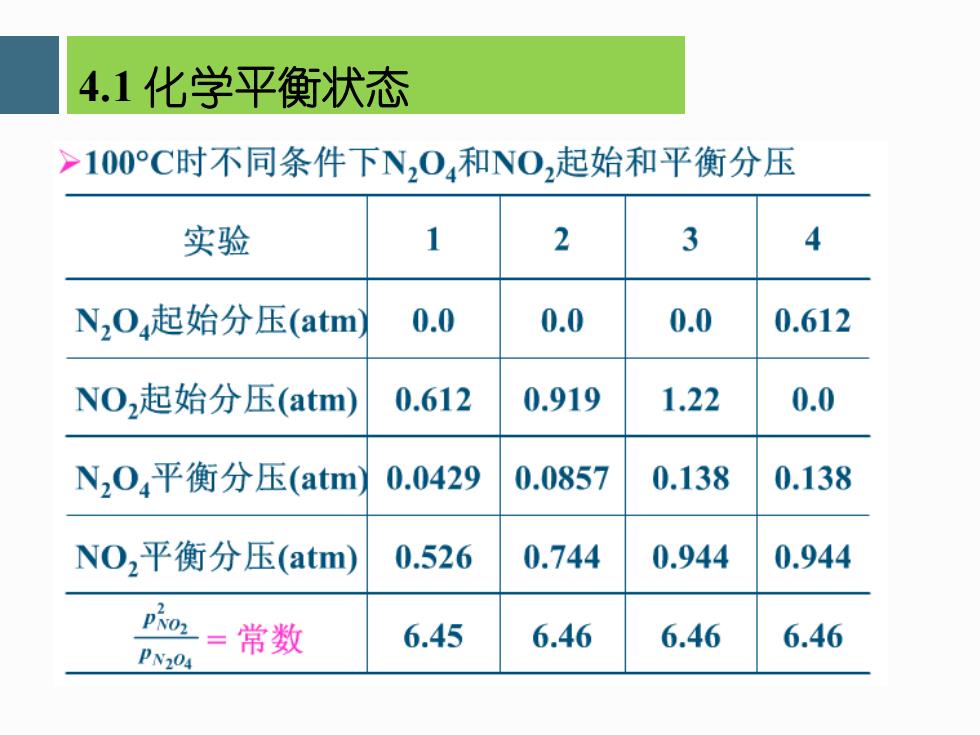
4.1化学平衡状态 >100°C时不同条件下N,0,和NO,起始和平衡分压 实验 2 3 4 N20,起始分压(atm 0.0 0.0 0.0 0.612 NO,起始分压(atm) 0.612 0.919 1.22 0.0 Nz04平衡分压(atm 0.0429 0.0857 0.138 0.138 NO,平衡分压(atm) 0.526 0.744 0.944 0.944 01=常数 6.45 6.46 6.46 6.46 PN204
4.1 化学平衡状态

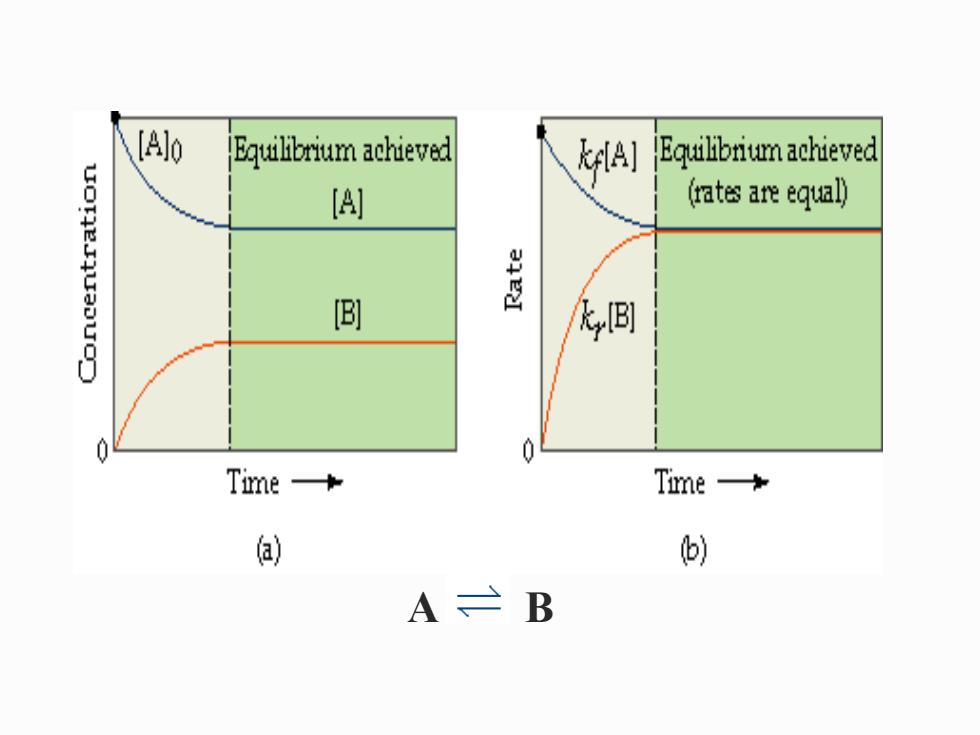
化学平衡状态:系统内发生的化学反应既没 有向正向进行的自发性,也没有向逆向进行的自 发性时的一种状态。(热力学) 正反应速率等于逆反应速率的状态。 (动力 学) 动态平衡
化学平衡状态:系统内发生的化学反应既没 有向正向进行的自发性,也没有向逆向进行的自 发性时的一种状态。(热力学) 正反应速率等于逆反应速率的状态。(动力 学) 动态平衡
[A0 Eqtuilibritumachieved A quiibmacheved A (rates areequa /k间 Time Time (a) b) A-B
A B

只有在恒温条件下,封闭体系中进行的可逆反应, 才能建立化学平衡一一平衡建立的前提; 平衡时动态的,正、逆反应的速率相等一一平衡 建立的条件; 体系自发地趋向平衡,平衡态时各物质的浓度保 持不变一一平衡建立的标志; 达到平衡状态的途径是双向的, 化学平衡是有条件的平衡。一旦维持平衡的外界 条件发生改变,原有的平衡将被破坏直到建立新 的平衡
只有在恒温条件下,封闭体系中进行的可逆反应, 才能建立化学平衡——平衡建立的前提; 平衡时动态的,正、逆反应的速率相等——平衡 建立的条件; 体系自发地趋向平衡,平衡态时各物质的浓度保 持不变——平衡建立的标志; 达到平衡状态的途径是双向的; 化学平衡是有条件的平衡。一旦维持平衡的外界 条件发生改变,原有的平衡将被破坏直到建立新 的平衡

4.1.1经验平衡常数 对于一般可逆纯气相反应: aA(g)+bB(g)=gG(g)+hH(g) 某温度下达平衡时, K。-2CL2a [p(A][p(B)] K,称为分压平衡常数。单位是(压力单位)g+h-a-b)
4.1.1 经验平衡常数 对于一般可逆纯气相反应: a A(g) + b B(g) g G(g) + h H(g) 某温度下达平衡时, Kp称为分压平衡常数。单位是(压力单位) (g+h-a-b)。 ( ) ( ) ( ) ( ) a b g h p p A p B p G p H K =

对于一般可逆纯溶液反应: aA(aq)+b B(aq)gG(aq)+hH(aq) 某温度下达平衡时, K.=le(G)(H) [c(A)][c(B)] K称为浓度平衡常数。单位是(浓度单位)g+h-a-b)
对于一般可逆纯溶液反应: a A(aq) + b B(aq) g G(aq) + h H(aq) 某温度下达平衡时, Kc称为浓度平衡常数。单位是(浓度单位) (g+h-a-b)。 ( ) ( ) ( ) ( ) a b g h c c A c B c G c H K =

书写平衡常数的规则: ()只写反应体系中浓度或分压可变的溶液相 和气相,而纯固态、纯液态及稀溶液中的 水(溶剂水)的浓度都不写入。 Cr20,2-(aq)+H20=2Cr042-(aq)+2Ht(aq) Kc=Cr0]P旧+]P [Cro CaCO3(s)Cao(s)+COz(g) K二Pc02
书写平衡常数的规则: (1) 只写反应体系中浓度或分压可变的溶液相 和气相,而纯固态、纯液态及稀溶液中的 水(溶剂水)的浓度都不写入。 Cr2O7 2 - (aq)+ H2O 2 CrO4 2 - (aq) + 2 H+ (aq) [CrO ] [CrO ] [H ] 2 7 2 2 2 4 C − − + K = CaCO3 ( s ) CaO ( s ) + CO2 ( g ) K =p CO2

2)但在非水体系中进行的反应,如有水参与 反应,则水的浓度必须出现在平衡常数表达式中。 例如:C,H,OH+CH COOH台CH,COOC2H,+H2O Ke-T CH;COOC,Hs]H,O C,H OH CH,COOH 3)对气相反应,即可用浓度表示,也可用分 压表示。 NH3 (g)+3 H2 (g)2 NH3 (g) Kc=- NHI2 (PH,) N2]H21 (P2)(pH,)3
(2) 但在非水体系中进行的反应,如有水参与 反应,则水的浓度必须出现在平衡常数表达式中。 例如: (3) 对气相反应,即可用浓度表示,也可用分 压表示。 C2 H5 OH +CH3 COOH CH3 COOC2 H5 + H2 O C H OH CH COOH CH COOC H H O Kc 2 5 3 3 2 5 2 = NH3 (g) + 3 H2 (g) 2 NH3 (g) 3 2 2 2 3 C [N ] [H ] [NH ] K = 3 N H 2 NH p ( ) ( ) ( ) 2 2 3 p p p K =