
生 第2章化学热力学基础 2.1热力学第一定律 2.2热化学 2.3化学反应的方向
2.1 热力学第一定律 2.2 热化学 2.3 化学反应的方向 第2章 化学热力学基础

概述 任何一个化学反应都要牵涉到三个方面的问题: 1.反应进行的方向一属于化学热力学研究的范畴; 2.反应进行的程度一属于化学平衡研究的范畴; 3.反应进行的快慢一属于化学动力学研究的范畴
任何一个化学反应都要牵涉到三个方面的问题: 1.反应进行的方向——属于化学热力学研究的范畴; 2.反应进行的程度——属于化学平衡研究的范畴; 3.反应进行的快慢——属于化学动力学研究的范畴。 概述

热力学 热力学就是研究能量相互转换过程中应遵循 的规律的科学。是物理学的一个分支。 热力学有三个基本定律: 热力学第一定律:能量转化过程中的数量守恒; 热力学第二定律:能量转化过程中进行的方向和 限度; 热力学第三定律:低温下物质运动状态,并为 各种物质的热力学函数的计算提供科学方法
热力学就是研究能量相互转换过程中应遵循 的规律的科学。是物理学的一个分支。 热力学有三个基本定律: 热力学第一定律:能量转化过程中的数量守恒; 热力学第二定律:能量转化过程中进行的方向和 限度; 热力学第三定律:低温下物质运动状态,并为 各种物质的热力学函数的计算提供科学方法。 热力学

化学热力学 把热力学中的基本原理用来研究化学现象及与化学有关 的物理现象一一化学热力学。 口化学变化中的能量的转变,反应的热效应一一热力学 第一定律的应用。 口化学变化的方向和限度一一 热力学第二定律的应用。 热力学研究方法的特点和局限性: 口研究大量粒子的宏观系统的宏观性质之间的关系及变 化规律; 不考虑微观粒子的微观结构; 口不涉及反应的速度和机理
化学热力学 把热力学中的基本原理用来研究化学现象及与化学有关 的物理现象——化学热力学。 ❑ 化学变化中的能量的转变,反应的热效应——热力学 第一定律的应用。 ❑ 化学变化的方向和限度——热力学第二定律的应用。 热力学研究方法的特点和局限性: ❑ 研究大量粒子的宏观系统的宏观性质之间的关系及变 化规律; ❑ 不考虑微观粒子的微观结构; ❑ 不涉及反应的速度和机理

优点和局限性 热力学只研究系统的始终态 根据始终态的性质而得到可靠的结果;不 考虑变化中的细节;不考虑物质内部的结构因 素; 口不考虑时间因素; 冬不能解释变化发生的原因; 冬只能处理平衡态; 不能解决过程的速率问题
优点和局限性 ❑ 热力学只研究系统的始终态 根据始终态的性质而得到可靠的结果;不 考虑变化中的细节;不考虑物质内部的结构因 素; ❑ 不考虑时间因素; ❖ 不能解释变化发生的原因; ❖ 只能处理平衡态; ❖ 不能解决过程的速率问题

2.1热力学第一定律 2.1.1热力学的基本概念和常用术语 1、体系(系统)与环境 体系:人为划分的研究对象。 环境:系统以外与系统密切相关的其它部分叫环境。 系统分为:敞开系统,封闭系统,孤立系统
2.1 热力学第一定律 2.1.1 热力学的基本概念和常用术语 1、体系(系统)与环境 体系:人为划分的研究对象。 环境:系统以外与系统密切相关的其它部分叫环境。 系统分为:敞开系统,封闭系统,孤立系统
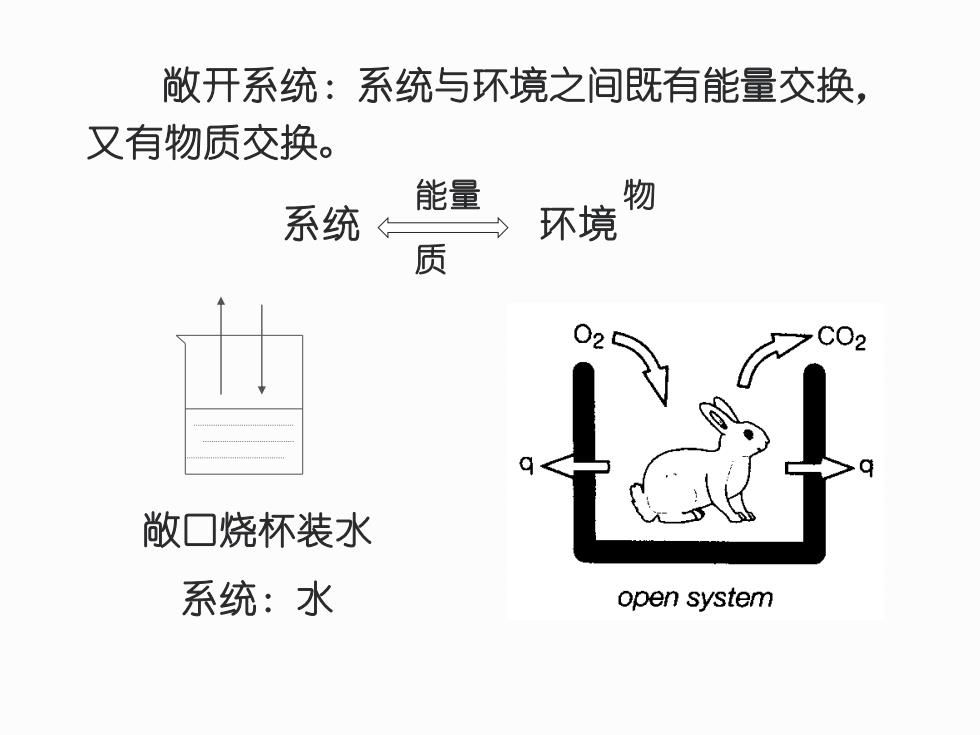
敞开系统:系统与环境之间既有能量交换, 又有物质交换。 能量 物 系统 环境 质 C02 敞口烧杯装水 系统:水 open system
敞开系统:系统与环境之间既有能量交换, 又有物质交换。 敞口烧杯装水 系统:水 系统 环境 能量 物 质
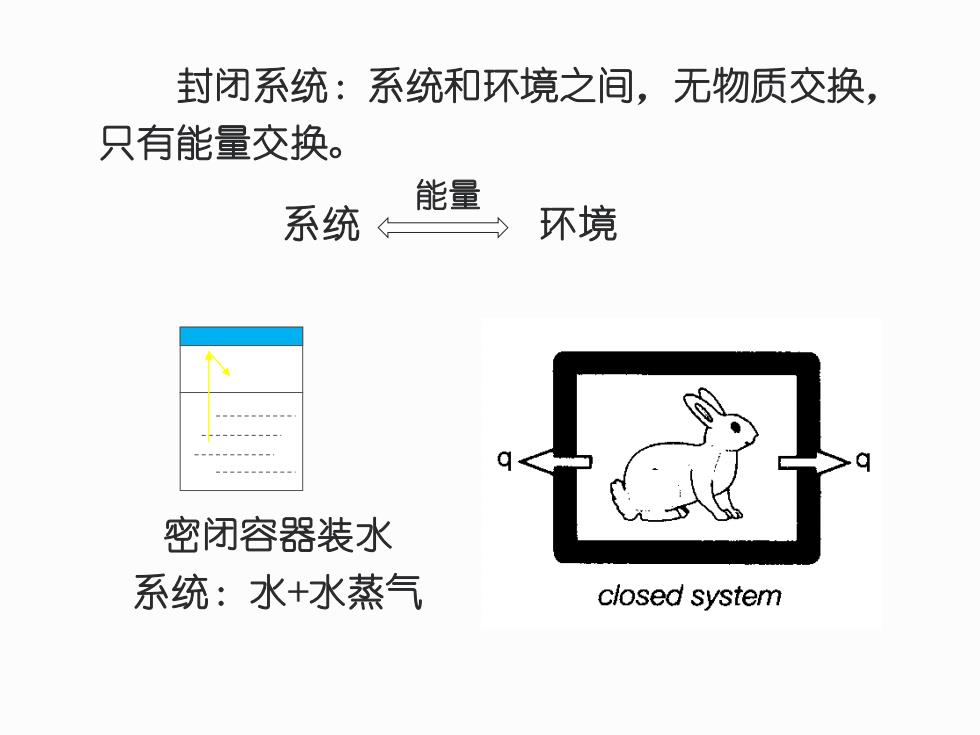
封闭系统:系统和环境之间,无物质交换, 只有能量交换。 能量 系统 环境 密闭容器装水 系统:水+水蒸气 closed system
封闭系统:系统和环境之间,无物质交换, 只有能量交换。 密闭容器装水 系统:水+水蒸气 系统 环境 能量
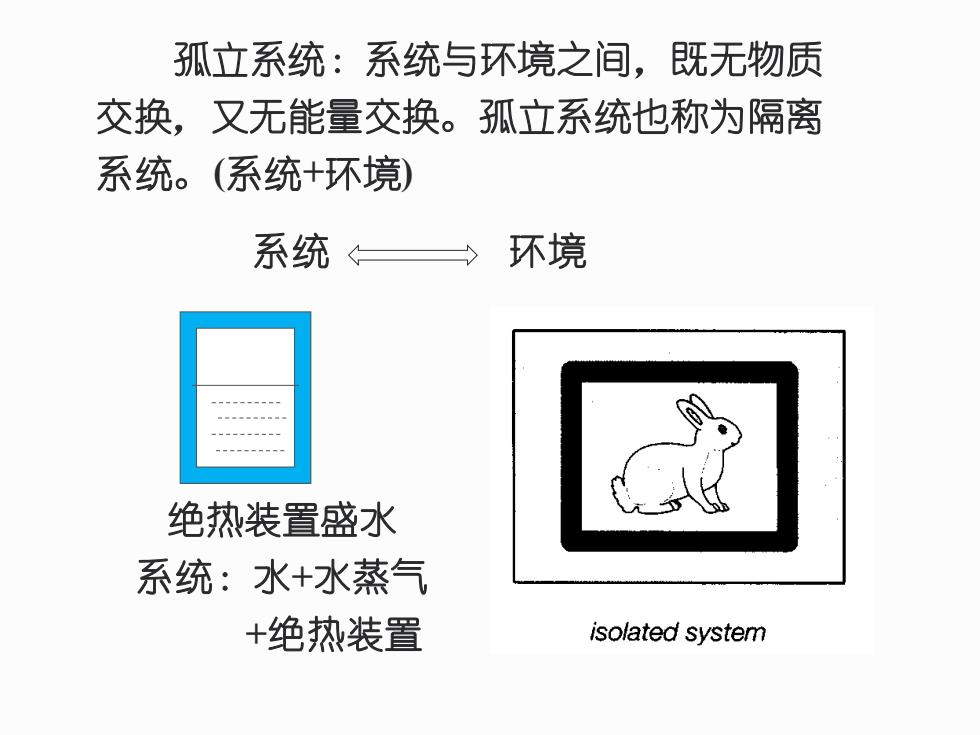
孤立系统:系统与环境之间,既无物质 交换,又无能量交换。孤立系统也称为隔离 系统。(系统+环境) 系统 环境 绝热装置盛水 系统:水+水蒸气 +绝热装置 isolated system
孤立系统:系统与环境之间,既无物质 交换,又无能量交换。孤立系统也称为隔离 系统。(系统+环境) 绝热装置盛水 系统:水+水蒸气 +绝热装置 系统 环境

2、状态和状态函数 状态:由一系列表征体系性质的物理量所确 定下来的体系的存在形式称为体系的状态。 状态函数:借以确定体系状态的物理量称为 体系的状态函数。 例如质量、温度、压力、体积、密度、组成 等,当这些性质都有确定值时,系统就处于一定 的状态
2、状态和状态函数 状态:由一系列表征体系性质的物理量所确 定下来的体系的存在形式称为体系的状态。 状态函数:借以确定体系状态的物理量称为 体系的状态函数。 例如质量、温度、压力、体积、密度、组成 等,当这些性质都有确定值时,系统就处于一定 的状态