
实验一、乳酸菌饮料中乳酸菌的微生物检验 一、实验目的 1.了解酸乳中乳酸菌分离原理 2. 学习并掌握乳酸菌饮料中乳酸菌菌数的检测方法。 二、实验 原理 活性酸奶需要控制各种乳酸菌的比例,有些国家将乳酸菌的活菌数含量作为区分产 品品种和质量的依据。 由于乳酸菌对营养有复杂的要求,生长需要碳水化合物、氨基酸、肽类、脂肪酸、 酯类、核酸衍生物、维生素和矿物质等,一般的肉汤培养基难以满足其要求。测定乳酸 菌时必须尽量将试样中所有活的乳酸菌检测出来。要提高检出率,关键是选用特定良好 的培养基。采用稀释平板菌落计数法,检测酸奶中的各种乳酸菌可获得满意的结果。 三、实验材料 1.培养基 改良 MC 培养基(Modified Chalmers 培养基) 2.仪器和器具 无菌移液管(25ml,1ml),无菌水(225ml 带玻璃珠三角瓶,9ml 试管),无菌培养 皿,旋涡均匀器。 恒温培养箱。 四、实验方法 流程:酸奶→稀释→制平板→培养→检查计数 1.样品稀释 先将酸奶样品搅拌均匀,用无菌移液管吸取样品 25ml 加入盛有 225ml 无菌水的三 角瓶中,在旋涡均匀器上充分振摇,务必使样品均匀分散,即为 10-1 的样品稀释液,然 后根据对样品含菌量的估计,将样品稀释至适当的稀释度。 2.制平板 选用 2~3 个适合的稀释度,培养皿贴上相应的标签,分别吸取不同稀释度的稀释 液 1ml 置于平皿内,每个稀释度作 2 个重复。然后用溶化冷却至 46℃左右的 改良 MC 培养基倒平皿,迅速转动平皿使之混合均匀,冷却成平板
实验一、乳酸菌饮料中乳酸菌的微生物检验 一、实验目的 1.了解酸乳中乳酸菌分离原理 2. 学习并掌握乳酸菌饮料中乳酸菌菌数的检测方法。 二、实验 原理 活性酸奶需要控制各种乳酸菌的比例,有些国家将乳酸菌的活菌数含量作为区分产 品品种和质量的依据。 由于乳酸菌对营养有复杂的要求,生长需要碳水化合物、氨基酸、肽类、脂肪酸、 酯类、核酸衍生物、维生素和矿物质等,一般的肉汤培养基难以满足其要求。测定乳酸 菌时必须尽量将试样中所有活的乳酸菌检测出来。要提高检出率,关键是选用特定良好 的培养基。采用稀释平板菌落计数法,检测酸奶中的各种乳酸菌可获得满意的结果。 三、实验材料 1.培养基 改良 MC 培养基(Modified Chalmers 培养基) 2.仪器和器具 无菌移液管(25ml,1ml),无菌水(225ml 带玻璃珠三角瓶,9ml 试管),无菌培养 皿,旋涡均匀器。 恒温培养箱。 四、实验方法 流程:酸奶→稀释→制平板→培养→检查计数 1.样品稀释 先将酸奶样品搅拌均匀,用无菌移液管吸取样品 25ml 加入盛有 225ml 无菌水的三 角瓶中,在旋涡均匀器上充分振摇,务必使样品均匀分散,即为 10-1 的样品稀释液,然 后根据对样品含菌量的估计,将样品稀释至适当的稀释度。 2.制平板 选用 2~3 个适合的稀释度,培养皿贴上相应的标签,分别吸取不同稀释度的稀释 液 1ml 置于平皿内,每个稀释度作 2 个重复。然后用溶化冷却至 46℃左右的 改良 MC 培养基倒平皿,迅速转动平皿使之混合均匀,冷却成平板
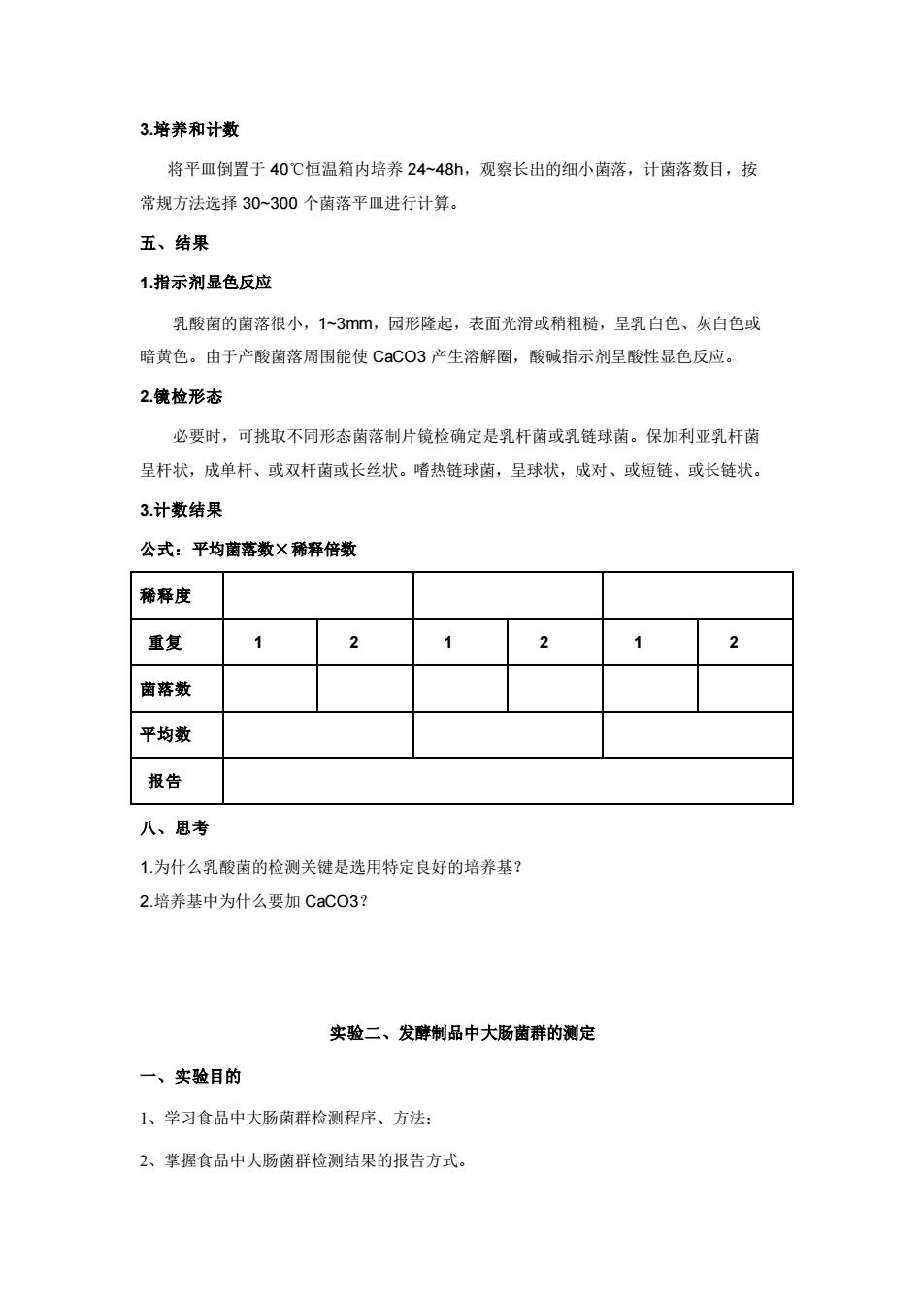
3.培养和计数 将平皿倒置于 40℃恒温箱内培养 24~48h,观察长出的细小菌落,计菌落数目,按 常规方法选择 30~300 个菌落平皿进行计算。 五、结果 1.指示剂显色反应 乳酸菌的菌落很小,1~3mm,园形隆起,表面光滑或稍粗糙,呈乳白色、灰白色或 暗黄色。由于产酸菌落周围能使 CaCO3 产生溶解圈,酸碱指示剂呈酸性显色反应。 2.镜检形态 必要时,可挑取不同形态菌落制片镜检确定是乳杆菌或乳链球菌。保加利亚乳杆菌 呈杆状,成单杆、或双杆菌或长丝状。嗜热链球菌,呈球状,成对、或短链、或长链状。 3.计数结果 公式:平均菌落数×稀释倍数 稀释度 重复 1 2 1 2 1 2 菌落数 平均数 报告 八、思考 1.为什么乳酸菌的检测关键是选用特定良好的培养基? 2.培养基中为什么要加 CaCO3? 实验二、发酵制品中大肠菌群的测定 一、实验目的 1、学习食品中大肠菌群检测程序、方法; 2、掌握食品中大肠菌群检测结果的报告方式
3.培养和计数 将平皿倒置于 40℃恒温箱内培养 24~48h,观察长出的细小菌落,计菌落数目,按 常规方法选择 30~300 个菌落平皿进行计算。 五、结果 1.指示剂显色反应 乳酸菌的菌落很小,1~3mm,园形隆起,表面光滑或稍粗糙,呈乳白色、灰白色或 暗黄色。由于产酸菌落周围能使 CaCO3 产生溶解圈,酸碱指示剂呈酸性显色反应。 2.镜检形态 必要时,可挑取不同形态菌落制片镜检确定是乳杆菌或乳链球菌。保加利亚乳杆菌 呈杆状,成单杆、或双杆菌或长丝状。嗜热链球菌,呈球状,成对、或短链、或长链状。 3.计数结果 公式:平均菌落数×稀释倍数 稀释度 重复 1 2 1 2 1 2 菌落数 平均数 报告 八、思考 1.为什么乳酸菌的检测关键是选用特定良好的培养基? 2.培养基中为什么要加 CaCO3? 实验二、发酵制品中大肠菌群的测定 一、实验目的 1、学习食品中大肠菌群检测程序、方法; 2、掌握食品中大肠菌群检测结果的报告方式

二、实验原理 大肠菌群系指一群能发酵乳糖、产酸产气、需氧和兼性厌氧的革兰氏阴性无芽胞杆菌。 该菌主要来源于人畜粪便,故以此作为粪便污染指标来评价食品的卫生质量,推断食品中有 否污染肠道致病菌的可能。 三、实验材料 1、设备和材料 温箱、水浴锅、天平、显微镜、均质器或乳钵、温度计、平皿、试管、发酵管、吸管、载玻 片、接种针 2、培养基及试剂 乳糖—胆盐发酵管、乳糖发酵管、蛋白胨水、靛基质试剂、麦康凯、伊红美蓝琼脂(EMB)、 远腾氏琼脂、革兰氏染色液 3、样品 发酵香肠 四、实验方法与步骤 1、采样及稀释 ①以无菌操作将检样 25g 放于含有 225ml 灭菌生理盐水,用均质器,以 8 000~10000r/min 的速度处理 1min,做成 1∶10 的均匀稀释液。 ②用 1ml 灭菌吸管吸取 1:10 稀释液 1ml,注入含有 9ml 灭菌生理盐水或其他稀释液的试管 内,振摇混匀,做成 1:100 的稀释液,换用 1 支 1ml 灭菌吸管,按上述操作依次作 10 倍 递增稀释液 ③根据食品卫生要求或对检验样品污染情况估计,选择三个稀释度,每个稀释度接种 3 管。 也可直接用样品接种。 2. 乳糖初发酵试验 即通常所说的假定试验。其目的在于检查样品中有无发酵乳糖产生气体的细菌。 将待检样品接种于乳糖胆盐发酵管内,接种量在 1ml 以上者,用双料乳糖胆盐发酵管; 1ml 及 1ml 以下者,用单料乳糖发酵管。每一个稀释度接种 3 管,置(36±1)0C 温箱内, 培养(24±2)h,如所有乳糖胆盐发酵管都不产气,则可报告为大肠菌群阴性,如有产生者, 则按下列程续进行 3.分离培养
二、实验原理 大肠菌群系指一群能发酵乳糖、产酸产气、需氧和兼性厌氧的革兰氏阴性无芽胞杆菌。 该菌主要来源于人畜粪便,故以此作为粪便污染指标来评价食品的卫生质量,推断食品中有 否污染肠道致病菌的可能。 三、实验材料 1、设备和材料 温箱、水浴锅、天平、显微镜、均质器或乳钵、温度计、平皿、试管、发酵管、吸管、载玻 片、接种针 2、培养基及试剂 乳糖—胆盐发酵管、乳糖发酵管、蛋白胨水、靛基质试剂、麦康凯、伊红美蓝琼脂(EMB)、 远腾氏琼脂、革兰氏染色液 3、样品 发酵香肠 四、实验方法与步骤 1、采样及稀释 ①以无菌操作将检样 25g 放于含有 225ml 灭菌生理盐水,用均质器,以 8 000~10000r/min 的速度处理 1min,做成 1∶10 的均匀稀释液。 ②用 1ml 灭菌吸管吸取 1:10 稀释液 1ml,注入含有 9ml 灭菌生理盐水或其他稀释液的试管 内,振摇混匀,做成 1:100 的稀释液,换用 1 支 1ml 灭菌吸管,按上述操作依次作 10 倍 递增稀释液 ③根据食品卫生要求或对检验样品污染情况估计,选择三个稀释度,每个稀释度接种 3 管。 也可直接用样品接种。 2. 乳糖初发酵试验 即通常所说的假定试验。其目的在于检查样品中有无发酵乳糖产生气体的细菌。 将待检样品接种于乳糖胆盐发酵管内,接种量在 1ml 以上者,用双料乳糖胆盐发酵管; 1ml 及 1ml 以下者,用单料乳糖发酵管。每一个稀释度接种 3 管,置(36±1)0C 温箱内, 培养(24±2)h,如所有乳糖胆盐发酵管都不产气,则可报告为大肠菌群阴性,如有产生者, 则按下列程续进行 3.分离培养
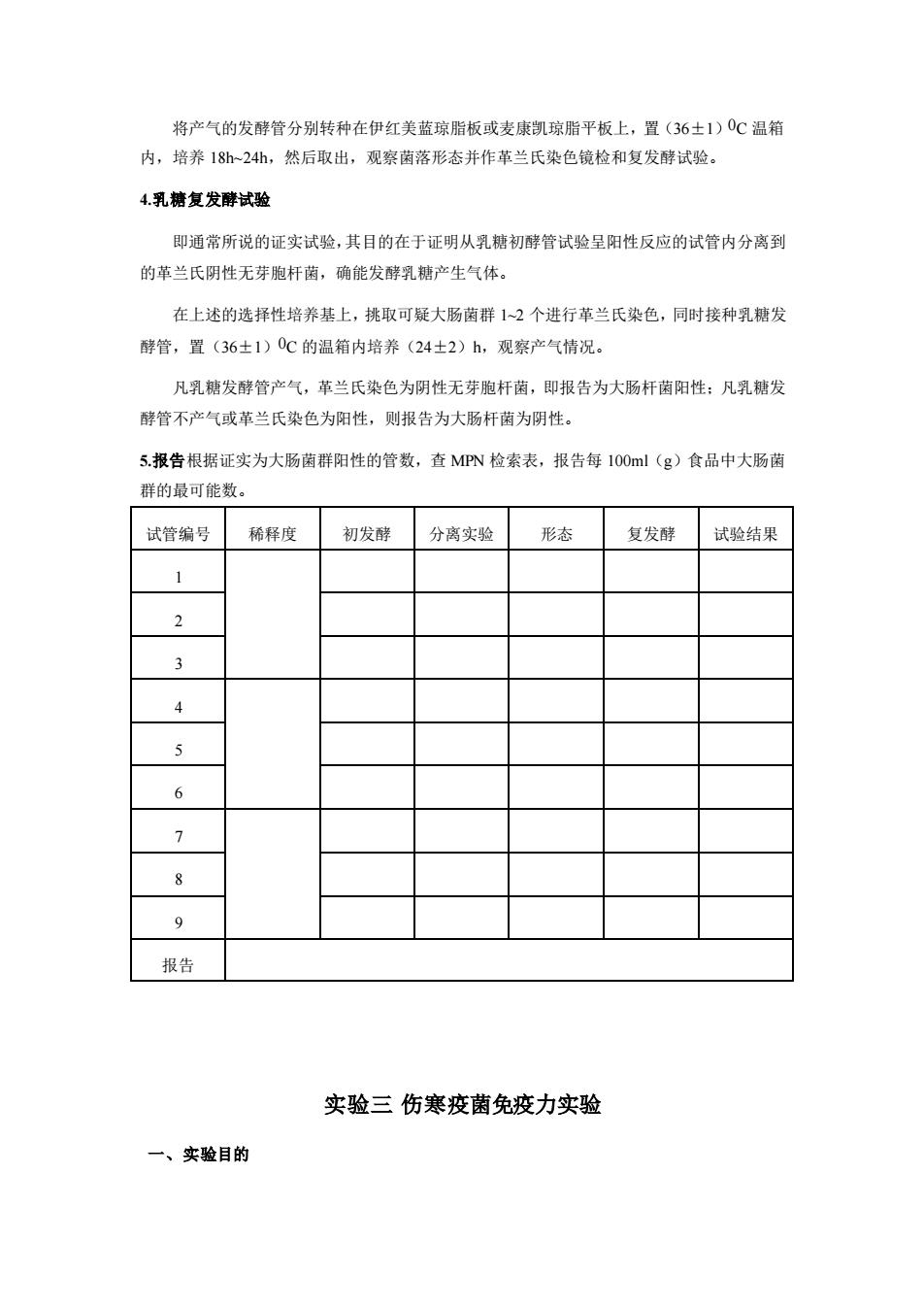
将产气的发酵管分别转种在伊红美蓝琼脂板或麦康凯琼脂平板上,置(36±1)0C 温箱 内,培养 18h~24h,然后取出,观察菌落形态并作革兰氏染色镜检和复发酵试验。 4.乳糖复发酵试验 即通常所说的证实试验,其目的在于证明从乳糖初酵管试验呈阳性反应的试管内分离到 的革兰氏阴性无芽胞杆菌,确能发酵乳糖产生气体。 在上述的选择性培养基上,挑取可疑大肠菌群 1~2 个进行革兰氏染色,同时接种乳糖发 酵管,置(36±1)0C 的温箱内培养(24±2)h,观察产气情况。 凡乳糖发酵管产气,革兰氏染色为阴性无芽胞杆菌,即报告为大肠杆菌阳性;凡乳糖发 酵管不产气或革兰氏染色为阳性,则报告为大肠杆菌为阴性。 5.报告根据证实为大肠菌群阳性的管数,查 MPN 检索表,报告每 100ml(g)食品中大肠菌 群的最可能数。 试管编号 稀释度 初发酵 分离实验 形态 复发酵 试验结果 1 2 3 4 5 6 7 8 9 报告 实验三 伤寒疫菌免疫力实验 一、实验目的
将产气的发酵管分别转种在伊红美蓝琼脂板或麦康凯琼脂平板上,置(36±1)0C 温箱 内,培养 18h~24h,然后取出,观察菌落形态并作革兰氏染色镜检和复发酵试验。 4.乳糖复发酵试验 即通常所说的证实试验,其目的在于证明从乳糖初酵管试验呈阳性反应的试管内分离到 的革兰氏阴性无芽胞杆菌,确能发酵乳糖产生气体。 在上述的选择性培养基上,挑取可疑大肠菌群 1~2 个进行革兰氏染色,同时接种乳糖发 酵管,置(36±1)0C 的温箱内培养(24±2)h,观察产气情况。 凡乳糖发酵管产气,革兰氏染色为阴性无芽胞杆菌,即报告为大肠杆菌阳性;凡乳糖发 酵管不产气或革兰氏染色为阳性,则报告为大肠杆菌为阴性。 5.报告根据证实为大肠菌群阳性的管数,查 MPN 检索表,报告每 100ml(g)食品中大肠菌 群的最可能数。 试管编号 稀释度 初发酵 分离实验 形态 复发酵 试验结果 1 2 3 4 5 6 7 8 9 报告 实验三 伤寒疫菌免疫力实验 一、实验目的

学习如何进行伤寒疫菌免疫力测定. 二、实验原理 伤寒是一种由伤寒杆菌感染所致的、使人衰弱并威胁生命的肠道传染病。伤寒患者会有 持续发热、疲倦、食欲不振、严重头痛、脾脏胀大、便秘或腹泻的情况出现。副伤寒的病征 与伤寒相似,但程度一般较轻,它是由另一类的沙门氏菌所引起的。 伤寒及副伤寒的传播途径是经由一些受到病者或带菌者的粪便或尿液所沾染的饮食而 传播。带菌者是一些经感染后而康复的人士,但在体内仍存着病菌。若食物及饮品曾由一些 不断排放病菌的人员处理、或饮用和冲洗食物的水受到污水所污染,便有机会传播伤寒及副 伤寒病。该疾病在缺少充分的排污系统和环境卫生设施的发展中国家比较多见。据美国疾病 控制和预防中心报道,全世界每年约有 1600 万人发生伤寒,其中大约 60 万人死于该疾病。 三、实验材料 小鼠 毒菌 伤寒 疫苗 四、实验步骤 将经 56℃30 分钟加温杀菌(或用其他方法杀菌),不加防腐剂的菌液稀释为每 1ml 含伤寒菌 2.5×108。用该菌液免疫体重为 14~16g 小鼠至少 30 只,每只皮下注射 0.5ml, 注射 2 次,间隔 7 天,末次免疫后 9~11 天进行毒菌攻击。免疫组小鼠每只腹腔注射 1 MLD 的毒菌(含于 0.5ml 中),同时应用同批饲养或体重与免疫组相同的小鼠 3 组(每组至少 5 只)作对照,分别于腹腔注射 2、1 及 1/2 MLD 的毒菌(各含于 0.5ml 中)。观察 3 天, 对照组小鼠感染 2 MLD 及 1 MLD 者应全部死亡,感染 1/2 MLD 者要有部分死亡。免疫 组至少保护 70%小鼠活存。 五、实验结果: 实验四 光化学荧光分析法测定氨苄青霉素 一 实验目的 学会氨苄青霉素的测定方法 二、实验原理 氨苄青霉素(Ampicillin) 为临床上常用控制细菌感染的一类重要的青霉素类抗生素, 属广谱抗菌素,对大多数 G+菌的抗菌作用不及青霉素 G,对阴性杆菌的作用超过青霉素。作 用机制同青霉素。 但肠球菌对氨苄青霉素较为敏感,对 G-杆菌作用较卡那霉素,庆大霉素弱
学习如何进行伤寒疫菌免疫力测定. 二、实验原理 伤寒是一种由伤寒杆菌感染所致的、使人衰弱并威胁生命的肠道传染病。伤寒患者会有 持续发热、疲倦、食欲不振、严重头痛、脾脏胀大、便秘或腹泻的情况出现。副伤寒的病征 与伤寒相似,但程度一般较轻,它是由另一类的沙门氏菌所引起的。 伤寒及副伤寒的传播途径是经由一些受到病者或带菌者的粪便或尿液所沾染的饮食而 传播。带菌者是一些经感染后而康复的人士,但在体内仍存着病菌。若食物及饮品曾由一些 不断排放病菌的人员处理、或饮用和冲洗食物的水受到污水所污染,便有机会传播伤寒及副 伤寒病。该疾病在缺少充分的排污系统和环境卫生设施的发展中国家比较多见。据美国疾病 控制和预防中心报道,全世界每年约有 1600 万人发生伤寒,其中大约 60 万人死于该疾病。 三、实验材料 小鼠 毒菌 伤寒 疫苗 四、实验步骤 将经 56℃30 分钟加温杀菌(或用其他方法杀菌),不加防腐剂的菌液稀释为每 1ml 含伤寒菌 2.5×108。用该菌液免疫体重为 14~16g 小鼠至少 30 只,每只皮下注射 0.5ml, 注射 2 次,间隔 7 天,末次免疫后 9~11 天进行毒菌攻击。免疫组小鼠每只腹腔注射 1 MLD 的毒菌(含于 0.5ml 中),同时应用同批饲养或体重与免疫组相同的小鼠 3 组(每组至少 5 只)作对照,分别于腹腔注射 2、1 及 1/2 MLD 的毒菌(各含于 0.5ml 中)。观察 3 天, 对照组小鼠感染 2 MLD 及 1 MLD 者应全部死亡,感染 1/2 MLD 者要有部分死亡。免疫 组至少保护 70%小鼠活存。 五、实验结果: 实验四 光化学荧光分析法测定氨苄青霉素 一 实验目的 学会氨苄青霉素的测定方法 二、实验原理 氨苄青霉素(Ampicillin) 为临床上常用控制细菌感染的一类重要的青霉素类抗生素, 属广谱抗菌素,对大多数 G+菌的抗菌作用不及青霉素 G,对阴性杆菌的作用超过青霉素。作 用机制同青霉素。 但肠球菌对氨苄青霉素较为敏感,对 G-杆菌作用较卡那霉素,庆大霉素弱

与四环素相仿,对伤寒杆菌,大肠杆菌的抗菌作用较强,绿脓杆菌和金葡菌对本品耐药.主要用 于治疗敏感细菌所致的败血症、尿路感染、肺部感染、胆道感染等;治疗伤寒、副伤寒疗效 与氯霉素相仿。本品在脑膜炎症时,脑脊液浓度较高,也适用于治疗由肺炎球菌、脑膜炎双 球菌及流感杆菌引起的脑膜炎。与其他半合成青霉素类、氨基糖甙类及氯霉素等合用可增强 疗效。 鉴于其特殊的药理作用,其质量控制就显得更为重要。目前国内外主要通过高效液相 色谱法来测定氨苄青霉素的含量, 本实验采用光化学荧光分析法来测定其粉针剂中氨苄青 霉素的含量。 三、实验材料 氨苄青霉素药物(市售) RF-5000 型荧光分光光度计 YE-1 型荧光分光光度计 125W 高压汞灯(破除玻璃外壳) TOA 型 Ph 计 2%甲醛溶液 四、 实验步骤: 将药物样品稀释,制定溶液,移取一定量的药物溶液于 25ml 干燥烧杯中,加入 2.0ml,Ph=5.6 缓冲溶液,加入至 20.0ml 混匀,移取 2.00ml 于 10ml 容量瓶中,加入 1.00ml 2% 甲醛,用 2mol/L NaOH 溶液定容至刻度,摇匀,避光放置 40min,后于 426nm 处测量荧光相 对强度。 五、 实验结果: 测量该药物中氨苄青霉素含量为
与四环素相仿,对伤寒杆菌,大肠杆菌的抗菌作用较强,绿脓杆菌和金葡菌对本品耐药.主要用 于治疗敏感细菌所致的败血症、尿路感染、肺部感染、胆道感染等;治疗伤寒、副伤寒疗效 与氯霉素相仿。本品在脑膜炎症时,脑脊液浓度较高,也适用于治疗由肺炎球菌、脑膜炎双 球菌及流感杆菌引起的脑膜炎。与其他半合成青霉素类、氨基糖甙类及氯霉素等合用可增强 疗效。 鉴于其特殊的药理作用,其质量控制就显得更为重要。目前国内外主要通过高效液相 色谱法来测定氨苄青霉素的含量, 本实验采用光化学荧光分析法来测定其粉针剂中氨苄青 霉素的含量。 三、实验材料 氨苄青霉素药物(市售) RF-5000 型荧光分光光度计 YE-1 型荧光分光光度计 125W 高压汞灯(破除玻璃外壳) TOA 型 Ph 计 2%甲醛溶液 四、 实验步骤: 将药物样品稀释,制定溶液,移取一定量的药物溶液于 25ml 干燥烧杯中,加入 2.0ml,Ph=5.6 缓冲溶液,加入至 20.0ml 混匀,移取 2.00ml 于 10ml 容量瓶中,加入 1.00ml 2% 甲醛,用 2mol/L NaOH 溶液定容至刻度,摇匀,避光放置 40min,后于 426nm 处测量荧光相 对强度。 五、 实验结果: 测量该药物中氨苄青霉素含量为