
项目5发酵工艺控制及优化 在还没有搞清生产菌控制其代谢活动的机制之前,发酵过程的控制主要依赖 于能反映发酵过程变化的参数的控制。因此,建立各种监测系统,对于发现和分 析发酵过程中出现的问愿,及时对发酵过程实施人工控制,是发酵过程高产和稳 产的重要条件。 反映发酵过程变化的参数可以分为两类:一类是可以直接采用特定的传感器 监测的参数。它们包括各种反映物理环境和化学环境变化的参数,如:温度、压 力、搅拌功率、转速、泡沫、发酵液粘度、浊度、pH、离子浓度、溶解度、基 质浓度等,又被称为直接参数。另一类参数是到目前为止还没有可供使用的传感 器监测的参数,它们包括细胞生长速率、产物合成速率和积累速率、呼吸商等。 这些参数需要根据一些直接监测出来的参数,借助于电脑快速运算的功能和特定 的数学模型才能得到。因此这类参数又被称为间接参数。 一.发酵过程中的直接参数的检测 (物理环境参数的监测 1温度的影响及检测 在发酵过程中,需要维持生产菌的适宜的培养条件,其中比较重要的就是保 持菌生长和合成产物所需要的最适温度。因为微生物的生长及产物的合成都是在 各种酶催化下进行的,而温度恰恰是保证酶活性的重要因素,所以在发酵系统中 必须保证稳定而合适的温度环境。 ()影响发酵温度的因素 发酵过程中,由于菌体对培养基利用而发生的生物反应及搅拌时产生的摩擦 等等,都会产生一定的热量。同时罐壁的散热、水分的蒸发等也带走了一部分热 量,发酵过程中释放出来的净热量称为发酵热: 卫发酵=Q生物+2#-Q蒸发一2显一Q短射 a.生物热(Q生物):它是生产菌在生长繁殖过程中,本身所产生的大量的热。 生物热主要是培养基中的碳水化合物、脂肪和蛋白质被微生物分解成CO、N 水以及其他物质时释放出来的。释放出来的能量部分用来合成高能化合物,供微 生物合成和代谢活动的需要,部分用来合成产物,其余部分则以热的形式散发出
项目 5 发酵工艺控制及优化 在还没有搞清生产菌控制其代谢活动的机制之前,发酵过程的控制主要依赖 于能反映发酵过程变化的参数的控制。因此,建立各种监测系统,对于发现和分 析发酵过程中出现的问题,及时对发酵过程实施人工控制,是发酵过程高产和稳 产的重要条件。 反映发酵过程变化的参数可以分为两类:一类是可以直接采用特定的传感器 监测的参数。它们包括各种反映物理环境和化学环境变化的参数,如:温度、压 力、搅拌功率、转速、泡沫、发酵液粘度、浊度、pH、离子浓度、溶解度、基 质浓度等,又被称为直接参数。另一类参数是到目前为止还没有可供使用的传感 器监测的参数,它们包括细胞生长速率、产物合成速率和积累速率、呼吸商等。 这些参数需要根据一些直接监测出来的参数,借助于电脑快速运算的功能和特定 的数学模型才能得到。因此这类参数又被称为间接参数。 一. 发酵过程中的直接参数的检测 ㈠物理环境参数的监测 ⒈温度的影响及检测 在发酵过程中,需要维持生产菌的适宜的培养条件,其中比较重要的就是保 持菌生长和合成产物所需要的最适温度。因为微生物的生长及产物的合成都是在 各种酶催化下进行的,而温度恰恰是保证酶活性的重要因素,所以在发酵系统中 必须保证稳定而合适的温度环境。 ⑴影响发酵温度的因素 发酵过程中,由于菌体对培养基利用而发生的生物反应及搅拌时产生的摩擦 等等,都会产生一定的热量。同时罐壁的散热、水分的蒸发等也带走了一部分热 量,发酵过程中释放出来的净热量称为发酵热: Q发酵 = Q生物 + Q搅拌 −Q蒸发 −Q显 −Q辐射 a.生物热( Q生物 ):它是生产菌在生长繁殖过程中,本身所产生的大量的热。 生物热主要是培养基中的碳水化合物、脂肪和蛋白质被微生物分解成 CO2、NH3、 水以及其他物质时释放出来的。释放出来的能量部分用来合成高能化合物,供微 生物合成和代谢活动的需要,部分用来合成产物,其余部分则以热的形式散发出

来。生物热大量产生于菌体的对数生长期,这一阶段所产生的大量热成为发酵过 程热平衡的主要因素。 b.搅拌热Q#:在好气性培养的发酵设备中都有大功率的搅拌。搅拌器带动 发酵液作机械运动,造成液体与设备之间、液体与液体之间的摩擦,产生数量可 现的热。从电机的电能消耗中扣除部分其他形式的能的散失,可得到搅拌热的估 算值。 ©.蒸发热Q发:蒸发热是随发酵罐排出的尾气带走的水蒸发的热量。其温度 和湿度随控制条件和季节的不同而各异。水的蒸发以及排出的气体还夹带着部分 显热(Q显)散失到外界。 d.辐射热Q谢:因罐内外温度不同,发酵液中有部分热通过罐体向外辐射。 辐射热在一年四季是不同的,冬天影响大些,因罐内外温差大。 由于Q生物、?发和Q在发酵过程中是随时间变化的,因此发酵热在整个发酵 过程中也随时间变化。为了使发酵保持在一定温度下进行,必须采取措施,如在 夹套层或蛇管内通入冷水来控制,对小型发酵罐,散热较快,需用热水保湿。 乃0(上册),发酵热的测定方法。 (2)温度对发酵的影响 由于微生物反应是由各种生物酶参加的反应,所以从酶动力学来看,温度升 高,反应速度加大,生长代谢加快,产物生产期提前。但酶本身很易因热而失去 活性,温度越高,酶的失活也越快。它表现在菌体易于衰老,发酵周期缩短,产 物产量减少。 温度除了直接影响发酵过程中各种反应速率外,还会通过改变发酵液的物理 性质,间接影响菌的生物合成。如温度会影响基质和氧在发酵液中的溶氧和传递 速率,菌体对某些物质的分解吸收速率等。 此外,温度还会影响生物合成或代谢调节的方向和最终产物。这点不难理解, 因为温度会影响生物体内的酶的活性。如,金色链莓菌能同时产生四环素和金霉 素。在30℃以下时,该菌主要合成金霉素。35℃时,该菌只产生四环素而停止 生成金霉素
来。生物热大量产生于菌体的对数生长期,这一阶段所产生的大量热成为发酵过 程热平衡的主要因素。 b.搅拌热 Q搅拌 :在好气性培养的发酵设备中都有大功率的搅拌。搅拌器带动 发酵液作机械运动,造成液体与设备之间、液体与液体之间的摩擦,产生数量可 现的热。从电机的电能消耗中扣除部分其他形式的能的散失,可得到搅拌热的估 算值。 c.蒸发热 Q蒸发 :蒸发热是随发酵罐排出的尾气带走的水蒸发的热量。其温度 和湿度随控制条件和季节的不同而各异。水的蒸发以及排出的气体还夹带着部分 显热( Q显 )散失到外界。 d.辐射热 Q辐射 :因罐内外温度不同,发酵液中有部分热通过罐体向外辐射。 辐射热在一年四季是不同的,冬天影响大些,因罐内外温差大。 由于 Q生物 、Q蒸发 和 Q显 在发酵过程中是随时间变化的,因此发酵热在整个发酵 过程中也随时间变化。为了使发酵保持在一定温度下进行,必须采取措施,如在 夹套层或蛇管内通入冷水来控制,对小型发酵罐,散热较快,需用热水保湿。 P240 (上册),发酵热的测定方法。 ⑵温度对发酵的影响 由于微生物反应是由各种生物酶参加的反应,所以从酶动力学来看,温度升 高,反应速度加大,生长代谢加快,产物生产期提前。但酶本身很易因热而失去 活性,温度越高,酶的失活也越快。它表现在菌体易于衰老,发酵周期缩短,产 物产量减少。 温度除了直接影响发酵过程中各种反应速率外,还会通过改变发酵液的物理 性质,间接影响菌的生物合成。如温度会影响基质和氧在发酵液中的溶氧和传递 速率,菌体对某些物质的分解吸收速率等。 此外,温度还会影响生物合成或代谢调节的方向和最终产物。这点不难理解, 因为温度会影响生物体内的酶的活性。如,金色链霉菌能同时产生四环素和金霉 素。在 30℃以下时,该菌主要合成金霉素。35℃时,该菌只产生四环素而停止 生成金霉素

(3)最适温度的选择 所谓的最适温度就是最适于菌体生长和产物合成的温度。不同的菌体,不同 的培养条件,不同的酶反应,不同的生长阶段,最适温度应是不同的,而且菌体 生长的最适温度不一定等于产物合成的最适温度。如青霉素生产菌的最适生长温 度是30℃,而最适青霉素合成温度为20℃。乙醇生产菌的最适生长温度为30℃, 最适合成温度为33℃。所以在接种的初始阶段,应考虑生长菌体为主,优先调 节适于生长的温度,待到产物合成阶段,即调节最适合成温度,以满足生物合成 的需要。 此外,根据环境条件的优劣,可以通过调节温度来加以弥补。如通气条件较 差或溶氧较低时,可适当降低温度,因为降低温度可以提高氧的溶解度。又如培 养基浓度较低或较易被菌体利用的培养基,提高培养基温度会使养分提前耗竭, 菌体生长过盛,易发生自溶,使产物产量降低。 温度可以通过水银温度计、热电铝、热敏电阻和金属电阻温度计监测发酵系 统中的温度,并通过与其相偶联的执行机构(如改变冷却水阀门的开度)对发酵 温度进行自动控制。 2.泡沫的控制 (1)泡沫的产生及其影响 在微生物深层培养过程中,由于通气、搅拌、代谢气体的产生等原因以及培 养基中蛋白质、糖份、代谢物等能够稳定泡沫的表面活性物质,使发酵液产生泡 沫,这是大多数发酵过程出现的正常现象。有时,这些泡沫是需要的,因为它可 以增加气液接触面积,导致氧传递速率的增加。但有些好气性发酵中,在发酵旺 盛期产生的大量泡沫,会引起“逃液”,给发酵造成困难,带来很多负作用,如 (1)降低了发酵罐的填料系数。一般的发酵过程,填料系数0.6~0.7,其余部分容 纳泡沫,而通常的情况,泡沫只占培养基的10%左右。(②)泡沫的存在增加了微 生物菌群的非均一性。由于泡沫液位的变化,以及不同生长周期微生物随泡沫漂 浮,粘在罐壁,影响了菌体浓度以及整体效果。(3)增加了污染杂菌的机会,培养 基随泡沫溅到轴封处容易染菌。(④)导致产物损失。大量起泡引起“逃液”,如降 低通气量或加消泡剂,将干扰工艺过程,尤其是加消泡剂会给提取工艺带来困难。 对泡沫起决定性因素的是培养基的物理化学性质。尤其是培养液中所含的蛋
⑶最适温度的选择 所谓的最适温度就是最适于菌体生长和产物合成的温度。不同的菌体,不同 的培养条件,不同的酶反应,不同的生长阶段,最适温度应是不同的,而且菌体 生长的最适温度不一定等于产物合成的最适温度。如青霉素生产菌的最适生长温 度是 30℃,而最适青霉素合成温度为 20℃。乙醇生产菌的最适生长温度为 30℃, 最适合成温度为 33℃。所以在接种的初始阶段,应考虑生长菌体为主,优先调 节适于生长的温度,待到产物合成阶段,即调节最适合成温度,以满足生物合成 的需要。 此外,根据环境条件的优劣,可以通过调节温度来加以弥补。如通气条件较 差或溶氧较低时,可适当降低温度,因为降低温度可以提高氧的溶解度。又如培 养基浓度较低或较易被菌体利用的培养基,提高培养基温度会使养分提前耗竭, 菌体生长过盛,易发生自溶,使产物产量降低。 温度可以通过水银温度计、热电铝、热敏电阻和金属电阻温度计监测发酵系 统中的温度,并通过与其相偶联的执行机构(如改变冷却水阀门的开度)对发酵 温度进行自动控制。 2.泡沫的控制 ⑴泡沫的产生及其影响 在微生物深层培养过程中,由于通气、搅拌、代谢气体的产生等原因以及培 养基中蛋白质、糖份、代谢物等能够稳定泡沫的表面活性物质,使发酵液产生泡 沫,这是大多数发酵过程出现的正常现象。有时,这些泡沫是需要的,因为它可 以增加气液接触面积,导致氧传递速率的增加。但有些好气性发酵中,在发酵旺 盛期产生的大量泡沫,会引起“逃液”,给发酵造成困难,带来很多负作用,如 ⑴降低了发酵罐的填料系数。一般的发酵过程,填料系数 0.6~0.7,其余部分容 纳泡沫,而通常的情况,泡沫只占培养基的 10%左右。⑵泡沫的存在增加了微 生物菌群的非均一性。由于泡沫液位的变化,以及不同生长周期微生物随泡沫漂 浮,粘在罐壁,影响了菌体浓度以及整体效果。⑶增加了污染杂菌的机会,培养 基随泡沫溅到轴封处容易染菌。⑷导致产物损失。大量起泡引起“逃液”,如降 低通气量或加消泡剂,将干扰工艺过程,尤其是加消泡剂会给提取工艺带来困难。 对泡沫起决定性因素的是培养基的物理化学性质。尤其是培养液中所含的蛋

白质、微生物菌体等具有稳定泡沫的作用。起泡剂一般都是表面活性物质,这些 物质具有亲水基团和疏水基团。分子带极性的一端向着水溶液,非极性的一端向 着空气,并在表面作定向排列,增加了泡沫的强度。培养液的温度、pH、浓度 和泡沫的表面积对泡沫的稳定性都具有一定的影响, (2)泡沫的控制 泡沫控制的方法有两类:机械消泡和消泡剂消泡。但近年来也注意从微生物 本身的特性入手,筛选生长期不产泡沫的菌体突变株,防止泡沫的形成,最简单 的当属单细胞蛋白生产。或者可利用几种微生物的混合培养,即通过一种微生物 产生的泡沫形成物质被另一种协作菌同化的作用来控制培养过程中产生的泡沫。 (i)机械消泡 一个理想的生物反应器,应具有优化工艺系统,使气体、培养基成分、代谢 物、微生物具有较好的分散度和湍流程度,尽量增加装置,而能量消耗小。那么, 在反应器中装一个耗能小的消泡系统,不仅要求保证不含“逃液”,使设备保持 无菌,而且菌体不能受到机械损伤。 机械消泡是根据物理学的原理,即靠机械作用引起压力变化(挤压)或强烈 振动,促使泡沫破裂,这种消泡装置可放在罐内或罐外。在罐内最简单的是在搅 拌轴上方装一个消泡桨,它可使泡沫被旋风离心压制破碎。罐外消泡法,是把泡 沫引出罐外,通过喷咀的喷射加速作用或离心力消除泡沫。 机械消泡的好处是,不需引进其他物质,如消泡剂,这样可以减少培养液性 质上的微小改变。也可节省原材料,减少污染机会。但缺点是不能从根本上消除 引起稳定泡沫的因素。 (2)消泡剂消泡 化学消泡的机理有两种: 如果泡沫的表层带有极性的表面活性物质形成双电层时,可以加入一种具 有相反电荷的表面活性剂,以降低泡沫的机械强度:或加入某些具有强极性的物 质与发泡物质争夺液膜上的空间,降低液膜强度,使泡沫破碎。 b.如果泡沫液膜的表面强度较大,可加些分子内聚力较小的物质,以降低液 膜的表面粘度,使液膜的液体流失,使泡沫破碎。 有的消泡剂能同时降低液膜的机械强度和液膜的表面粘度,这是比较好的消
白质、微生物菌体等具有稳定泡沫的作用。起泡剂一般都是表面活性物质,这些 物质具有亲水基团和疏水基团。分子带极性的一端向着水溶液,非极性的一端向 着空气,并在表面作定向排列,增加了泡沫的强度。培养液的温度、pH、浓度 和泡沫的表面积对泡沫的稳定性都具有一定的影响。 ⑵泡沫的控制 泡沫控制的方法有两类:机械消泡和消泡剂消泡。但近年来也注意从微生物 本身的特性入手,筛选生长期不产泡沫的菌体突变株,防止泡沫的形成,最简单 的当属单细胞蛋白生产。或者可利用几种微生物的混合培养,即通过一种微生物 产生的泡沫形成物质被另一种协作菌同化的作用来控制培养过程中产生的泡沫。 ( 1 )机械消泡 一个理想的生物反应器,应具有优化工艺系统,使气体、培养基成分、代谢 物、微生物具有较好的分散度和湍流程度,尽量增加装置,而能量消耗小。那么, 在反应器中装一个耗能小的消泡系统,不仅要求保证不含“逃液”,使设备保持 无菌,而且菌体不能受到机械损伤。 机械消泡是根据物理学的原理,即靠机械作用引起压力变化(挤压)或强烈 振动,促使泡沫破裂,这种消泡装置可放在罐内或罐外。在罐内最简单的是在搅 拌轴上方装一个消泡桨,它可使泡沫被旋风离心压制破碎。罐外消泡法,是把泡 沫引出罐外,通过喷咀的喷射加速作用或离心力消除泡沫。 机械消泡的好处是,不需引进其他物质,如消泡剂,这样可以减少培养液性 质上的微小改变。也可节省原材料,减少污染机会。但缺点是不能从根本上消除 引起稳定泡沫的因素。 ( 2 )消泡剂消泡 化学消泡的机理有两种: a.如果泡沫的表层带有极性的表面活性物质形成双电层时,可以加入一种具 有相反电荷的表面活性剂,以降低泡沫的机械强度;或加入某些具有强极性的物 质与发泡物质争夺液膜上的空间,降低液膜强度,使泡沫破碎。 b.如果泡沫液膜的表面强度较大,可加些分子内聚力较小的物质,以降低液 膜的表面粘度,使液膜的液体流失,使泡沫破碎。 有的消泡剂能同时降低液膜的机械强度和液膜的表面粘度,这是比较好的消

泡剂。同时还应具有较小的表面张力和溶解度,以利于附着在泡沫表面上。消泡 剂还应对菌体无毒性,对发酵、提取过程以及产品质量无影响,成本低,来源 源 工业上使用的消泡剂种类较多,有天然油脂类,如玉米油、豆油、棉子油 米糠油、猪油、鱼油等。使用时应注意油脂的新鲜程度,否则对菌的生长和产物 的合成有抑制作用。聚醚类:如聚氧丙烯甘油(GP)和聚氧乙烯氧丙稀甘油(泡 敌)。此类消泡剂用量少,0.03一0.035%,而消泡能力却大于植物油10倍以上。 高级醇类:最常用的是十八醇,还有聚二醇,它具有消泡效果持久的特点,对霉 菌类效果最佳。硅酮类:这类消泡剂主要是聚二甲基硅氧烷及其衍生物。它常与 分散剂(微晶S,0,)一起使用,或与水配成10%的纯硅酮乳液。它适用于细菌 和放线菌的发酵。 对于消泡剂的应用应注意在使用之前作比较试验,找出消泡剂对微生物生理 特性影响最小,消泡效率最大的条件。其次,在使用天然油脂时一次不能加得太 多,过多的油脂会被脂肪酶分解为有机酸、脂肪酸、降低pH、使DO下降,影 响发酵的正常进行。 常用安装在发酵罐中的电导式或电容式泡沫探头监测泡沫,并与消泡装置或 消泡剂添加装置联接控制泡沫。 3.压力:可用相当简单的薄膜式压力计测量,这种压力计能经得起灭菌处理。 测得的气动信号可直接或通过一简单的装置转换为电信号,启动装在发酵罐上的 罐压调节阀以调节压。 4,轴输入功率:目前有两种用来测量轴功率的装置,即扭力(功率)计和应变 仪。由于扭力计系统只能放在罐外测量,其测定值包含轴封摩擦力的损失。用应 变仪测量则可以避免这一缺点,虽然仪器较贵,但是其精度较高,还是值得应用 的。仪器的应变片安装在发酵罐内的搅拌轴上,导线从轴向孔中引出罐外,电讯 号通过旋转轴上的滑动环传出。 5.搅拌器转速:发酵罐的搅拌器的转速,依罐的大小而异。小罐的搅拌 器转速要比大罐的快些。但是所有发酵罐搅拌器的叶尖的线速度ND,在一般 情况下几乎是恒定的值,即为150~300米/份。下表是不同大小的通用型发酵 罐搅拌器转速范围
泡剂。同时还应具有较小的表面张力和溶解度,以利于附着在泡沫表面上。消泡 剂还应对菌体无毒性,对发酵、提取过程以及产品质量无影响,成本低,来源广 等。 工业上使用的消泡剂种类较多,有天然油脂类,如玉米油、豆油、棉子油、 米糠油、猪油、鱼油等。使用时应注意油脂的新鲜程度,否则对菌的生长和产物 的合成有抑制作用。聚醚类:如聚氧丙烯甘油(GP)和聚氧乙烯氧丙稀甘油(泡 敌)。此类消泡剂用量少,0.03~0.035%,而消泡能力却大于植物油 10 倍以上。 高级醇类:最常用的是十八醇,还有聚二醇,它具有消泡效果持久的特点,对霉 菌类效果最佳。硅酮类:这类消泡剂主要是聚二甲基硅氧烷及其衍生物。它常与 分散剂(微晶 SiO2 )一起使用,或与水配成 10%的纯硅酮乳液。它适用于细菌 和放线菌的发酵。 对于消泡剂的应用应注意在使用之前作比较试验,找出消泡剂对微生物生理 特性影响最小,消泡效率最大的条件。其次,在使用天然油脂时一次不能加得太 多,过多的油脂会被脂肪酶分解为有机酸、脂肪酸、降低 pH、使 DO 下降,影 响发酵的正常进行。 常用安装在发酵罐中的电导式或电容式泡沫探头监测泡沫,并与消泡装置或 消泡剂添加装置联接控制泡沫。 3.压力:可用相当简单的薄膜式压力计测量,这种压力计能经得起灭菌处理。 测得的气动信号可直接或通过一简单的装置转换为电信号,启动装在发酵罐上的 罐压调节阀以调节罐压。 4.轴输入功率:目前有两种用来测量轴功率的装置,即扭力(功率)计和应变 仪。由于扭力计系统只能放在罐外测量,其测定值包含轴封摩擦力的损失。用应 变仪测量则可以避免这一缺点,虽然仪器较贵,但是其精度较高,还是值得应用 的。仪器的应变片安装在发酵罐内的搅拌轴上,导线从轴向孔中引出罐外,电讯 号通过旋转轴上的滑动环传出。 5.搅拌器转速:发酵罐的搅拌器的转速,依罐的大小而异。小罐的搅拌 器转速要比大罐的快些。但是所有发酵罐搅拌器的叶尖的线速度 ND ,在一般 情况下几乎是恒定的值,即为 150~300 米 分 。下表是不同大小的通用型发酵 罐搅拌器转速范围
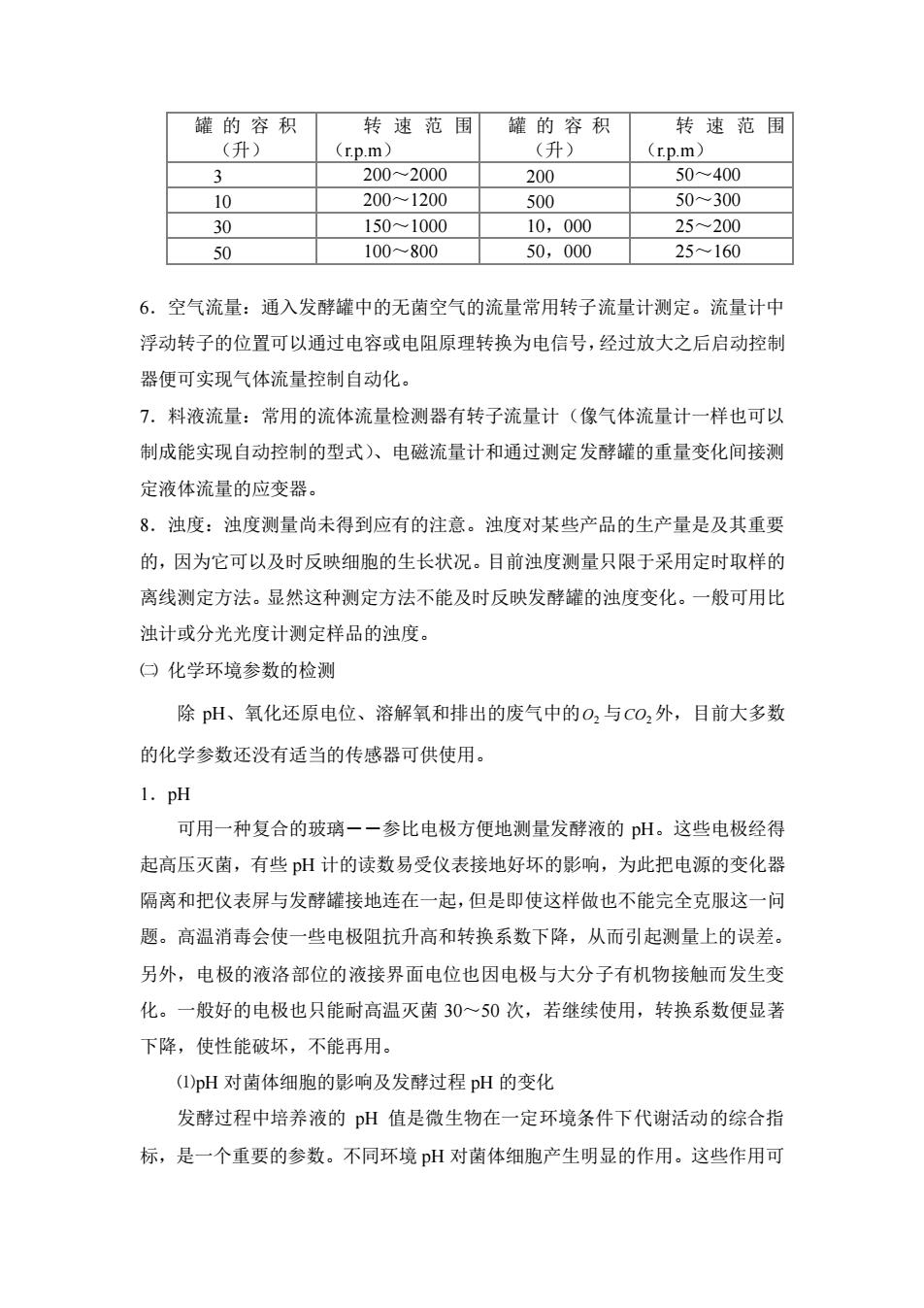
罐的容积 转速范围罐的容积 转速范围 (升) (rp.m (升) (rp.m) 3 200-2000 200 50~400 10 2001200 500 50300 30 1501000 10.000 25200 50 100-800 50,000 25~160 6.空气流量:通入发酵罐中的无菌空气的流量常用转子流量计测定。流量计中 浮动转子的位置可以通过电容或电阻原理转换为电信号,经过放大之后启动控制 器便可实现气体流量控制自动化。 7.料液流量:常用的流体流量检测器有转子流量计(像气体流量计一样也可以 制成能实现自动控制的型式)、电磁流量计和通过测定发酵罐的重量变化间接测 定液体流量的应变器。 8.浊度:浊度测量尚未得到应有的注意。浊度对某些产品的生产量是及其重要 的,因为它可以及时反映细胞的生长状况。目前浊度测量只限于采用定时取样的 离线测定方法。显然这种测定方法不能及时反映发酵罐的浊度变化。一般可用比 浊计或分光光度计测定样品的浊度。 口化学环境参数的检测 除pH、氧化还原电位、溶解氧和排出的废气中的O,与CO,外,目前大多数 的化学参数还没有适当的传感器可供使用。 1.pH 可用一种复合的玻璃一一参比电极方便地测量发酵液的pH。这些电极经得 起高压灭菌,有些pH计的读数易受仪表接地好坏的影响,为此把电源的变化器 隔离和把仪表屏与发酵罐接地连在一起,但是即使这样做也不能完全克服这一问 题。高温消毒会使一些电极阻抗升高和转换系数下降,从而引起测量上的误差。 另外,电极的液洛部位的液接界面电位也因电极与大分子有机物接触而发生变 化。一般好的电极也只能耐高温灭菌30~50次,若继续使用,转换系数便显著 下降,使性能破坏,不能再用。 (Q)pH对菌体细胞的影响及发酵过程pH的变化 发酵过程中培养液的pH值是微生物在一定环境条件下代谢活动的综合指 标,是一个重要的参数。不同环境pH对菌体细胞产生明显的作用。这些作用可
罐 的 容 积 (升) 转速范围 (r.p.m) 罐 的 容 积 (升) 转速范围 (r.p.m) 3 200~2000 200 50~400 10 200~1200 500 50~300 30 150~1000 10,000 25~200 50 100~800 50,000 25~160 6.空气流量:通入发酵罐中的无菌空气的流量常用转子流量计测定。流量计中 浮动转子的位置可以通过电容或电阻原理转换为电信号,经过放大之后启动控制 器便可实现气体流量控制自动化。 7.料液流量:常用的流体流量检测器有转子流量计(像气体流量计一样也可以 制成能实现自动控制的型式)、电磁流量计和通过测定发酵罐的重量变化间接测 定液体流量的应变器。 8.浊度:浊度测量尚未得到应有的注意。浊度对某些产品的生产量是及其重要 的,因为它可以及时反映细胞的生长状况。目前浊度测量只限于采用定时取样的 离线测定方法。显然这种测定方法不能及时反映发酵罐的浊度变化。一般可用比 浊计或分光光度计测定样品的浊度。 ㈡ 化学环境参数的检测 除 pH、氧化还原电位、溶解氧和排出的废气中的 O2 与 CO2 外,目前大多数 的化学参数还没有适当的传感器可供使用。 1.pH 可用一种复合的玻璃――参比电极方便地测量发酵液的 pH。这些电极经得 起高压灭菌,有些 pH 计的读数易受仪表接地好坏的影响,为此把电源的变化器 隔离和把仪表屏与发酵罐接地连在一起,但是即使这样做也不能完全克服这一问 题。高温消毒会使一些电极阻抗升高和转换系数下降,从而引起测量上的误差。 另外,电极的液洛部位的液接界面电位也因电极与大分子有机物接触而发生变 化。一般好的电极也只能耐高温灭菌 30~50 次,若继续使用,转换系数便显著 下降,使性能破坏,不能再用。 ⑴pH 对菌体细胞的影响及发酵过程 pH 的变化 发酵过程中培养液的 pH 值是微生物在一定环境条件下代谢活动的综合指 标,是一个重要的参数。不同环境 pH 对菌体细胞产生明显的作用。这些作用可

以表现在许多方面。例如,各种微生物都有最适生长pH值,超过这个pH范围 微生物生长就受到影响甚至停止。有的适宜于酸性培养,有的中性,有的宜于碱 性。一般来说,霉菌和酵母菌的最适pH为3~6,大多数细菌和放线菌适于中性 和微碱性pH6.37.6。 发酵过程pH的变化会引起ATP生产率的减少,因此引起细胞产量的减少, 倍增时间增加.如葡萄糖进行酒精发酵时,当pH从7.2变为5.01时,每100mgol 葡萄糖形成的ATP从224 ngmol降到153 ngmol,相当于菌体从2.58g降到1.77g 倍增时间从2小时增到4小时。 pH变化对细胞壁的机械强度也有明显的作用,膨胀或收缩改变了内部的渗 透压,如青霉菌在pH>7时,菌丝体膨胀,细胞壁强度降低。 有时,离子毒性作用也由于pH的变化而间接形成。即在环境H条件下, 一些不离解的分子透过细胞壁,在中性的细胞内部发生离解,从而改变了细胞内 部的组成。一般在使用有机酸缓冲液时的抑制作用就是这种效应的结果。 由此可见,尽管H变化对茵种细胞影响是多种多样的,其最后的作用结果 也各不相同,但菌体细胞对pH的变化是异常敏感的,所以pH值是发酵过程中 很重要的参数。 然而,在发酵过程中,由于微生物生命活动的结果,使培养液环境的pH发 生不断变化,如果不加以控制调节的话,就要影响过程的进行。培养液pH变化 是在特定环境条件下微生物生命活动的综合结果,在同一时间也许既存在着pH 上升的因素,又存在着使p州降低的可能,最后趋势则决定于这些因素的综合结 果。 从具体过程来说,微生物生命活动对环境pH的影响主要在两种情况下发生。 其一就是酸性或碱性代谢产物的形成,使培养液的pH发生变化,如在通风发酵 中,许多微生物在过量的糖存在下,产生有机酸等代谢物,使pH值降低。其二: 当菌体自溶时,蛋白质分解或其他含氮化合物产生氨或产生其他碱性物质。其次 就是菌体对培养基中生理酸性或生理碱性物质的利用,使环境的pH发生变化。 所谓生理酸性或生理碱性物质也是相对而言的,有些物质可能是生理酸性物质, 也可能在另一条件下表现为生理碱性物质,主要由菌的生理特性所决定。如氨基 酸作为主要或唯一碳源进行好气性培养时,引起氨的产生,当其量超过菌体需氮
以表现在许多方面。例如,各种微生物都有最适生长 pH 值,超过这个 pH 范围, 微生物生长就受到影响甚至停止。有的适宜于酸性培养,有的中性,有的宜于碱 性。一般来说,霉菌和酵母菌的最适 pH 为 3~6,大多数细菌和放线菌适于中性 和微碱性 pH6.3~7.6。 发酵过程 pH 的变化会引起 ATP 生产率的减少,因此引起细胞产量的减少, 倍增时间增加。如葡萄糖进行酒精发酵时,当 pH 从 7.2 变为 5.01 时,每 100mgmol 葡萄糖形成的 ATP 从 224mgmol降到 153mgmol,相当于菌体从 2.58g 降到 1.77g, 倍增时间从 2 小时增到 4 小时。 pH 变化对细胞壁的机械强度也有明显的作用,膨胀或收缩改变了内部的渗 透压,如青霉菌在 pH>7 时,菌丝体膨胀,细胞壁强度降低。 有时,离子毒性作用也由于 pH 的变化而间接形成。即在环境 pH 条件下, 一些不离解的分子透过细胞壁,在中性的细胞内部发生离解,从而改变了细胞内 部的组成。一般在使用有机酸缓冲液时的抑制作用就是这种效应的结果。 由此可见,尽管 pH 变化对菌种细胞影响是多种多样的,其最后的作用结果 也各不相同,但菌体细胞对 pH 的变化是异常敏感的,所以 pH 值是发酵过程中 很重要的参数。 然而,在发酵过程中,由于微生物生命活动的结果,使培养液环境的 pH 发 生不断变化,如果不加以控制调节的话,就要影响过程的进行。培养液 pH 变化 是在特定环境条件下微生物生命活动的综合结果,在同一时间也许既存在着 pH 上升的因素,又存在着使 pH 降低的可能,最后趋势则决定于这些因素的综合结 果。 从具体过程来说,微生物生命活动对环境 pH 的影响主要在两种情况下发生。 其一就是酸性或碱性代谢产物的形成,使培养液的 pH 发生变化,如在通风发酵 中,许多微生物在过量的糖存在下,产生有机酸等代谢物,使 pH 值降低。其二: 当菌体自溶时,蛋白质分解或其他含氮化合物产生氨或产生其他碱性物质。其次 就是菌体对培养基中生理酸性或生理碱性物质的利用,使环境的 pH 发生变化。 所谓生理酸性或生理碱性物质也是相对而言的,有些物质可能是生理酸性物质, 也可能在另一条件下表现为生理碱性物质,主要由菌的生理特性所决定。如氨基 酸作为主要或唯一碳源进行好气性培养时,引起氨的产生,当其量超过菌体需氮

量时,就会引起H值的上升。如果以氨基酸进行厌氧代谢,在脱氨作用时,即 产生碱也产生酸。 对于这些由于菌体代谢所引起的pH变化,如果不加以控制的话,必然要干 扰微生物反应的正常进行。因此,需要对pH进行控制。 (2)电极及其测量系统 用电极电位法测量溶液的pH值,可以获得较准确的结果。配合自动电位差 计后,就能实现自动记录和监控。 电极电位法的原理是用两个电极插在被测溶液中,电极1为指示电极(如 pH玻璃电极),它的电位随着被测溶液的pH变化而变化。电极2为参比电极(如 甘汞电极,氯化银电极),其电位固定不变。这两个电极在溶液中构成一组原电 池,该电池产生的电动势的大小与溶液的pH值有关,电动势与pH值的变化关 系可用下式表示: 因此,只要准确地测量两个电极间的电动势,就可以测得溶液中的pH值。 根据电极法原理构成的测量装置,既为实验室或工业用的pH计(或叫酸度 计)。该装置是由发送器(即电极部分)和测量仪器(如电位差或高阻转换器等) 两大部分所组成。对溶液H值的测量,实际上是由发送器所得的毫伏信号经测 量仪表放大指示pH值,此毫伏信号实际上就是由指示电极、参比电极和被测溶 液所组成的原电池的电动势, 作为指示电极的玻璃电极是由一种非常薄的球形薄膜玻璃做成。薄膜的厚度 般为0.2mm,极易破碎。玻璃电极内充有pH值恒定的标准溶液,成为内缓 冲溶液。在玻璃电极中插入一根作为电极引出导线用的内电极,一般为AgC1电 极(银丝或铂丝镀银后再镀AgC1),此电极为内参比电极。图 作为参比电极的甘汞电极,它的外壳是一个玻璃管,里面有一根小玻璃管, 顶部伸出测量电极电位的引线(或接线柱),引线的下端浸没在汞中。汞的下面 有糊状甘汞(g,C,),汞和甘汞用棉花堵住,只有离子才能通过,而汞和甘汞 不会掉下来。图小管的外面充以C1液。末端用多孔陶瓷作为KCI液与被测溶液 沟通点,叫“液洛部”。使用时,要拔去电极上P的橡皮塞,使电极中有少量C 溶液通过多孔陶瓷渗入到被测液中,实现电极引线和溶液间的电的连通
量时,就会引起 pH 值的上升。如果以氨基酸进行厌氧代谢,在脱氨作用时,即 产生碱也产生酸。 对于这些由于菌体代谢所引起的 pH 变化,如果不加以控制的话,必然要干 扰微生物反应的正常进行。因此,需要对 pH 进行控制。 ⑵电极及其测量系统 用电极电位法测量溶液的 pH 值,可以获得较准确的结果。配合自动电位差 计后,就能实现自动记录和监控。 电极电位法的原理是用两个电极插在被测溶液中,电极 1 为指示电极(如 pH 玻璃电极),它的电位随着被测溶液的 pH 变化而变化。电极 2 为参比电极(如 甘汞电极,氯化银电极),其电位固定不变。这两个电极在溶液中构成一组原电 池,该电池产生的电动势的大小与溶液的 pH 值有关,电动势与 pH 值的变化关 系可用下式表示: 因此,只要准确地测量两个电极间的电动势,就可以测得溶液中的 pH 值。 根据电极法原理构成的测量装置,既为实验室或工业用的 pH 计(或叫酸度 计)。该装置是由发送器(即电极部分)和测量仪器(如电位差或高阻转换器等) 两大部分所组成。对溶液 pH 值的测量,实际上是由发送器所得的毫伏信号经测 量仪表放大指示 pH 值,此毫伏信号实际上就是由指示电极、参比电极和被测溶 液所组成的原电池的电动势。 作为指示电极的玻璃电极是由一种非常薄的球形薄膜玻璃做成。薄膜的厚度 一般为 0.2 mm,极易破碎。玻璃电极内充有 pH 值恒定的标准溶液,成为内缓 冲溶液。在玻璃电极中插入一根作为电极引出导线用的内电极,一般为 AgCl 电 极(银丝或铂丝镀银后再镀 AgCl ),此电极为内参比电极。图 作为参比电极的甘汞电极,它的外壳是一个玻璃管,里面有一根小玻璃管, 顶部伸出测量电极电位的引线(或接线柱),引线的下端浸没在汞中。汞的下面 有糊状甘汞( Hg2Cl2 ),汞和甘汞用棉花堵住,只有离子才能通过,而汞和甘汞 不会掉下来。图小管的外面充以 KCl 液。末端用多孔陶瓷作为 KCl 液与被测溶液 沟通点,叫“液洛部”。使用时,要拔去电极上 P 的橡皮塞,使电极中有少量 KCl 溶液通过多孔陶瓷渗入到被测液中,实现电极引线和溶液间的电的连通

电极电位产生于汞和甘汞的界面,其电极反应为: Cl-+HgHg:Cl +e 甘汞电极的缺点是其电位随温度的变化而变化,易受温度的影响。常温时电 位的稳定性也较差,这方面的性能不及氯化银电极。 AgC1电极的结构和原理都和甘汞电极相似。在一根铂丝(或银丝)上涂纯 银,然后使其表面覆盖一层AgCI膜,将它浸没在盛有KCI溶液的具有毛细孔的 玻璃管内。电极电位产生于银与AgC1的界面,其电极反应为: CI+Ag→AgCI+e 电极电位是由kC!的浓度决定,与被测离子浓度无关。此电极的优点是在较 高温度时,电极电位较稳定,一般可以用于250℃以下。 (3)发酵液pH测量玻璃电极 A.发酵过程对pH测量电极的要求 a.耐高温灭菌消毒b.长时间稳定性c.一定的液洛部流通要求。在发 酵液的pH测量过程中,参比电极的kC溶液不断通过液洛部渗到发酵液中,构 成测量系统,为防止杂菌夹带造成污染,微孔直径要小于菌体(一般在3μ左右)。 但太小则造成液流不畅。d.结构要紧凑。指示pH电极与参比电极组成单根装 置,便于生产或实验现场装置,这种电极为复合电极 B.复合玻璃电极 把氯化银参比电极和玻璃电极组合在一起,形成单根的玻璃装置,使用安装 就很方便。如果改变球泡玻璃的组成配方,使能耐高温蒸煮(达135℃),就可 以成为一个在发酵工业上广泛使用的pH电极发送器。 它的基本构造和性能在做pH电极校正实验时涉及,不再重复。 (④)发酵的pH控制 在微生物发酵过程中,是否需要对pH进行控制?用什么介质来控制pH? 控制规律如何?要解决这些问题,首先还是发酵工艺问题。 如前所述,由于微生物的生命活动结果,致使周围环境pH发生变化,从工 艺角度考虑,要调节控制pH的方案可以有很多种。 。配置合适的培养基,选用不同的生理酸性和生理碱性物质,并使培养基
电极电位产生于汞和甘汞的界面,其电极反应为: Cl + Hg − Hg Cl + e 2 2 2 1 甘汞电极的缺点是其电位随温度的变化而变化,易受温度的影响。常温时电 位的稳定性也较差,这方面的性能不及氯化银电极。 AgCl 电极的结构和原理都和甘汞电极相似。在一根铂丝(或银丝)上涂纯 银,然后使其表面覆盖一层 AgCl 膜,将它浸没在盛有 KCl 溶液的具有毛细孔的 玻璃管内。电极电位产生于银与 AgCl 的界面,其电极反应为: Cl + Ag → AgCl + e − 电极电位是由 KCl 的浓度决定,与被测离子浓度无关。此电极的优点是在较 高温度时,电极电位较稳定,一般可以用于 250℃以下。 ⑶发酵液 pH 测量玻璃电极 A.发酵过程对 pH 测量电极的要求 a.耐高温灭菌消毒 b.长时间稳定性 c.一定的液洛部流通要求。在发 酵液的 pH 测量过程中,参比电极的 KCl 溶液不断通过液洛部渗到发酵液中,构 成测量系统,为防止杂菌夹带造成污染,微孔直径要小于菌体(一般在 3μ左右)。 但太小则造成液流不畅。 d.结构要紧凑。指示 pH 电极与参比电极组成单根装 置,便于生产或实验现场装置,这种电极为复合电极。 B.复合玻璃电极 把氯化银参比电极和玻璃电极组合在一起,形成单根的玻璃装置,使用安装 就很方便。如果改变球泡玻璃的组成配方,使能耐高温蒸煮(达 135℃),就可 以成为一个在发酵工业上广泛使用的 pH 电极发送器。 它的基本构造和性能在做 pH 电极校正实验时涉及,不再重复。 ⑷发酵的 pH 控制 在微生物发酵过程中,是否需要对 pH 进行控制?用什么介质来控制 pH? 控制规律如何?要解决这些问题,首先还是发酵工艺问题。 如前所述,由于微生物的生命活动结果,致使周围环境 pH 发生变化,从工 艺角度考虑,要调节控制 pH 的方案可以有很多种。 a.配置合适的培养基,选用不同的生理酸性和生理碱性物质,并使培养基

具有缓冲pH作用。 b.在培养过程中加入酸性或碱性物质,这些酸或碱仅起pH调节作用,不作 为菌体基质消耗。 ©.在培养过程中流加酸碱性的基质,例谷氨基酸发酵中的通氨,既是菌体 消耗的基质,也是pH调节试剂。 d.流加生理酸性或碱性基质,通过菌体代谢活动达到pH控制。 ,也有的把pH控制与代谢调节结合起来,也就是说把pH参数变化作为反 映菌体代谢情况的依据之一,通过加入基质来控制pH,即达到控制代谢调 节,达到最高产量的目的。 2.溶解氧: 在好气性微生物的发酵过程中,必须连续地通入无菌空气,氧由气相溶解到 液相,然后经过液流传给细胞壁进入细胞质,以维持菌的生长和产物的生物合成。 所以培养液中溶解氧浓度是一个重要的参数。 溶解氧浓度可用化学滴定法,也可用以电化学为基础的电极法及其他的物理 方法来测量。 化学滴定法与电极法相比较,溶氧电极法测量有很大的优点:操作简单, 受溶液中其他离子干扰小,可以快速连续就地测量,以满足发酵罐等设备中氧浓 度的控制要求。因此,D0电极测量在许多领域中,如微生物学、医药生理学、 化学工程、机械工程、海洋学、环境保护学等得到广泛应用,出现各种不同用途 类型的D0电极。如在发酵罐中使用可蒸汽灭菌的溶氧电极,测量生物组织中氧 含量的D0微电极,气体分析中的快速响应氧电极,锅炉给水中的微量氧测量电 极等等 在生物工程中,由D0电极所获得的测试数据不仅可以给出微生物生理生 化信息与动态信息,而且还可作为发酵罐放大,发酵中间控制等的基础。 目前市场上已经可以买到可进行高温灭菌的溶氧探头。大多数商品的氧电 极都是银一铅电极。如图。每个电极的阴极表面覆盖有一层聚合物膜(如聚四氟 乙烯薄膜),阴极和膜之间含有电解质溶液。这类复膜电极的响应时间较慢(90% 的响应为20一200秒),适用于长期监测发酵液的溶氧水平,不适用于氧的浓度 快速变化的场所。如果用这些探头测量氧吸收速率的变化,必须用动态法作响应
具有缓冲 pH 作用。 b.在培养过程中加入酸性或碱性物质,这些酸或碱仅起 pH 调节作用,不作 为菌体基质消耗。 c.在培养过程中流加酸碱性的基质,例谷氨基酸发酵中的通氨,既是菌体 消耗的基质,也是 pH 调节试剂。 d.流加生理酸性或碱性基质,通过菌体代谢活动达到 pH 控制。 e.也有的把 pH 控制与代谢调节结合起来,也就是说把 pH 参数变化作为反 映菌体代谢情况的依据之一,通过加入基质来控制 pH,即达到控制代谢调 节,达到最高产量的目的。 2. 溶解氧: 在好气性微生物的发酵过程中,必须连续地通入无菌空气,氧由气相溶解到 液相,然后经过液流传给细胞壁进入细胞质,以维持菌的生长和产物的生物合成。 所以培养液中溶解氧浓度是一个重要的参数。 溶解氧浓度可用化学滴定法,也可用以电化学为基础的电极法及其他的物理 方法来测量。 化学滴定法与电极法相比较,溶氧电极法测量有很大的优点:操作简单, 受溶液中其他离子干扰小,可以快速连续就地测量,以满足发酵罐等设备中氧浓 度的控制要求。因此,DO 电极测量在许多领域中,如微生物学、医药生理学、 化学工程、机械工程、海洋学、环境保护学等得到广泛应用,出现各种不同用途 类型的 DO 电极。如在发酵罐中使用可蒸汽灭菌的溶氧电极,测量生物组织中氧 含量的 DO 微电极,气体分析中的快速响应氧电极,锅炉给水中的微量氧测量电 极等等。 在生物工程中,由 DO 电极所获得的测试数据不仅可以给出微生物生理生 化信息与动态信息,而且还可作为发酵罐放大,发酵中间控制等的基础。 目前市场上已经可以买到可进行高温灭菌的溶氧探头。大多数商品的氧电 极都是银-铅电极。如图。每个电极的阴极表面覆盖有一层聚合物膜(如聚四氟 乙烯薄膜),阴极和膜之间含有电解质溶液。这类复膜电极的响应时间较慢(90% 的响应为 20~200 秒),适用于长期监测发酵液的溶氧水平,不适用于氧的浓度 快速变化的场所。如果用这些探头测量氧吸收速率的变化,必须用动态法作响应