
全程设计 实验活动4 简单的电镀实验
实验活动4 简单的电镀实验

一、实验准备 (一)实验目的 1.认识电解原理及其在工业生产中的应用。 2.了解电镀的原理。 (二)实验原理 利用在铁制品上镀铜实验加深对电解原理的认识。 (三)实验用品 烧杯、砂纸、导线、2~3V的直流电源、电流表。 铁制镀件、铜片、电镀液(以CuSO,溶液为主配制、1 moL1的NaOH溶液、20%盐酸、蒸馏水
一、实验准备 (一)实验目的 1.认识电解原理及其在工业生产中的应用。 2.了解电镀的原理。 (二)实验原理 利用在铁制品上镀铜实验加深对电解原理的认识。 (三)实验用品 烧杯、砂纸、导线、2~3 V的直流电源、电流表。 铁制镀件、铜片、电镀液(以CuSO4溶液为主配制)、1 mol·L-1的NaOH溶液、20%盐酸、蒸馏水

二、探究过程 (一)实验步骤 1.用砂纸把铁制镀件打磨干净,放入1moL1NaOH溶液中 除去油污,然后用蒸馏水洗净。再放入20%盐酸中除锈,几分 钟后取出,并用蒸馏水洗净
二、探究过程 (一)实验步骤 1.用砂纸把铁制镀件打磨干净,放入1 mol·L-1 NaOH溶液中 除去油污,然后用蒸馏水洗净。再放入20%盐酸中除锈,几分 钟后取出,并用蒸馏水洗净
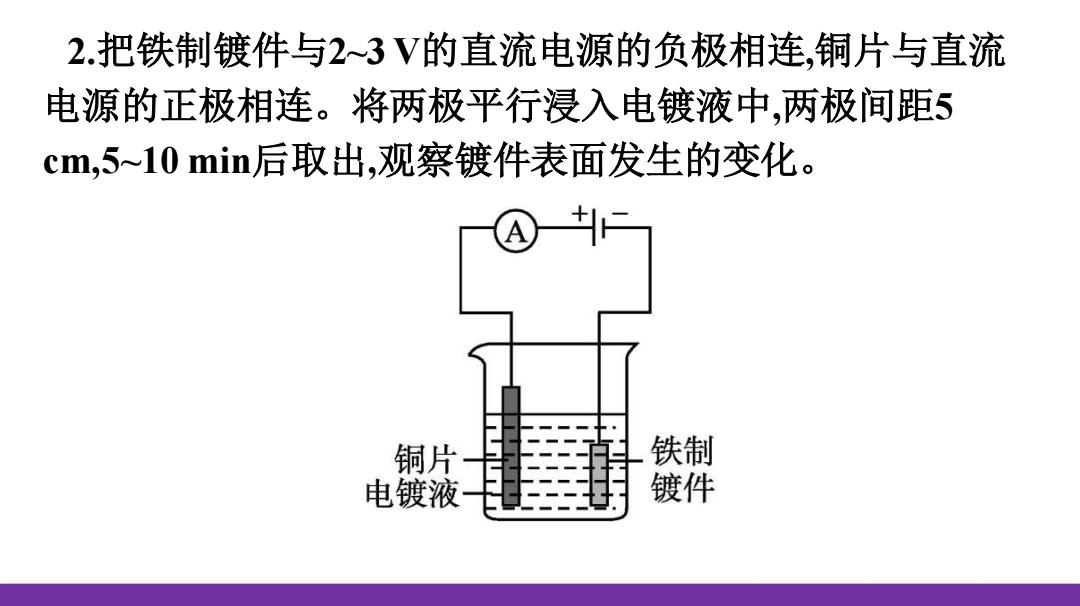
2.把铁制镀件与2~3V的直流电源的负极相连,铜片与直流 电源的正极相连。将两极平行浸入电镀液中,两极间距5 cm,5~10min后取出,观察镀件表面发生的变化。 铜片 铁制 电镀液 镀件
2.把铁制镀件与2~3 V的直流电源的负极相连,铜片与直流 电源的正极相连。将两极平行浸入电镀液中,两极间距5 cm,5~10 min后取出,观察镀件表面发生的变化

(二)实验现象 铜片变小,铁制镀件表面有红色物质覆盖。 三)注意事项 1.电镀实验开始之前铁制镀件表面的油污及锈迹要清除干 净。 2.铜片、镀件与电源正、负极连接正确
(二)实验现象 铜片变小,铁制镀件表面有红色物质覆盖。 (三)注意事项 1.电镀实验开始之前铁制镀件表面的油污及锈迹要清除干 净。 2.铜片、镀件与电源正、负极连接正确

三、思考与交流 1.电镀前,如果将铜片与直流电源的负极相连,铁制镀件与直 流电源正极相连,通电后观察到的现象是什么?阴极和阳极发 生的反应分别是什么? 提示:现象为铁制镀件不断溶解,质量减小,铜片质量增大;阴 极反应为Cu2++2e一Cu,阳极反应为Fe-2e一Fe2+
三、思考与交流 1.电镀前,如果将铜片与直流电源的负极相连,铁制镀件与直 流电源正极相连,通电后观察到的现象是什么?阴极和阳极发 生的反应分别是什么? 提示:现象为铁制镀件不断溶解,质量减小,铜片质量增大;阴 极反应为Cu2++2e-══Cu,阳极反应为Fe-2e-══Fe2+

2.查阅资料,了解工业生产中提高电镀质量的方法。 提示:①电镀液的浓度和pH控制在适当范围内;②添加适量 氨水可以使镀层更光亮;③选用适当的电源电压以获得适当 的电流;④通电之前不要把铁制镀件放入电镀液中,否则铁制 镀件表面会直接置换出铜,影响电镀质量;⑤铁制镀件和镀层 金属铜所连的电极不能接反了;等等
2.查阅资料,了解工业生产中提高电镀质量的方法。 提示:①电镀液的浓度和pH控制在适当范围内;②添加适量 氨水可以使镀层更光亮;③选用适当的电源电压以获得适当 的电流;④通电之前不要把铁制镀件放入电镀液中,否则铁制 镀件表面会直接置换出铜,影响电镀质量;⑤铁制镀件和镀层 金属铜所连的电极不能接反了;等等

以梦为马 不负韶华!
以梦为马, 不负韶华!