
全程设计 章末核心素养整合
章末核心素养整合

知识体系构建 专题归纳突破
知识体系构建 专题归纳突破
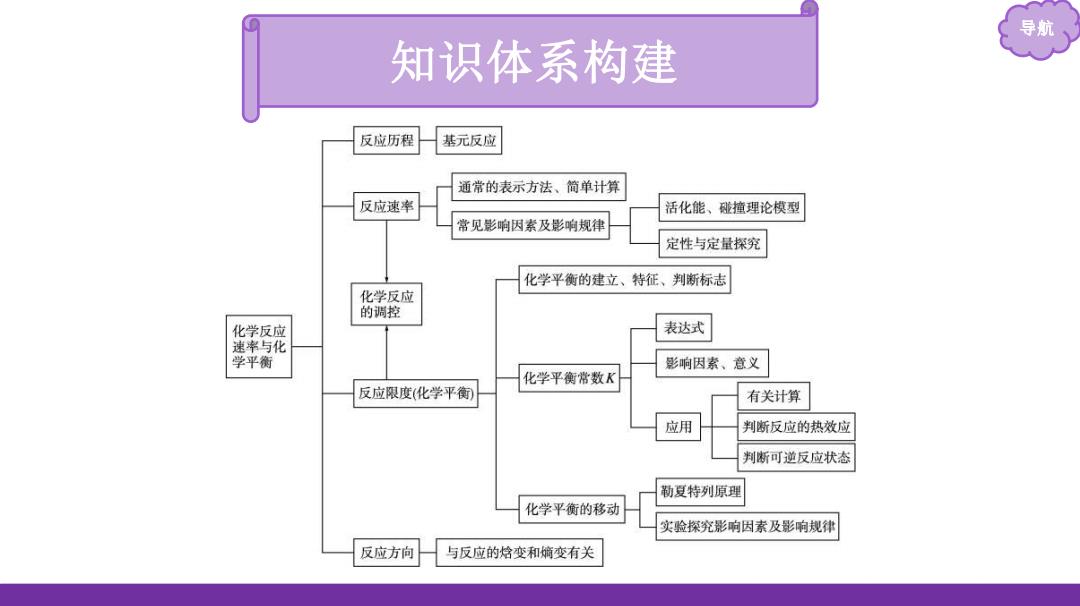
导航 知识体系构建 反应历程 基元反应 通常的表示方法、简单计算 反应速率 活化能、碰撞理论模型 常见影响因素及影响规律 定性与定量探究 化学平衡的建立、特征、判断标志 化学反应 的调控 化学反应 表达式 速率与化 学平衡 影响因索、意义 化学平衡常数K 反应限度(化学平衡 有关计算 应用 判断反应的热效应 判断可逆反应状态 勒夏特列原理 化学平衡的移动 实验探究影响因素及影响规律 反应方向 与反应的焓变和嫡变有关
导航 知识体系构建

导航 专题归纳突破 专题一化学反应速率与平衡常数的计算模板 1.基本模式。 mA(g)+nB(g)pC(g) 起始浓度 L b C (molL-1) 变化浓度 X (molL-1) 器 px m 平衡浓度 nx a-X b c+ (molL-1) m m
导航 专题一 化学反应速率与平衡常数的计算模板 1.基本模式。 mA(g)+nB(g) pC(g) 起始浓度 (𝐦𝐨𝐥·𝐋 -𝟏) a b c 变化浓度 (𝐦𝐨𝐥·𝐋 -𝟏) x 𝒏𝒙 𝒎 𝒑𝒙 𝒎 平衡浓度 (𝐦𝐨𝐥·𝐋 -𝟏) a-x b- 𝒏𝒙 𝒎 c+𝒑𝒙 𝒎 专题归纳突破

导航 2.几个公式。 c (1)化学反应速率:= △n △t V△t (2)反应物转化率 c(Ax100%。 c(A)原 nC平x100%。 3)平衡时的体积分数p(C总学 (4)平衡常数K= cP(C) cm(A)-cn(B)
导航 2.几个公式 。 (1)化学反应速率:v= 𝚫 𝒄 𝚫𝒕 = 𝚫 𝒏 𝑽·𝚫𝒕。 (2)反应物转化率:𝚫 𝒄(𝐀) 𝒄(𝐀)原 ×100%。 (3)平衡时的体积分数 φ(C)= 𝒏(𝐂)平 𝒏(总)平 ×100%。 (4)平衡常数 K= 𝒄 𝒑(𝐂) 𝒄𝒎(𝐀)·𝒄𝒏(𝐁)
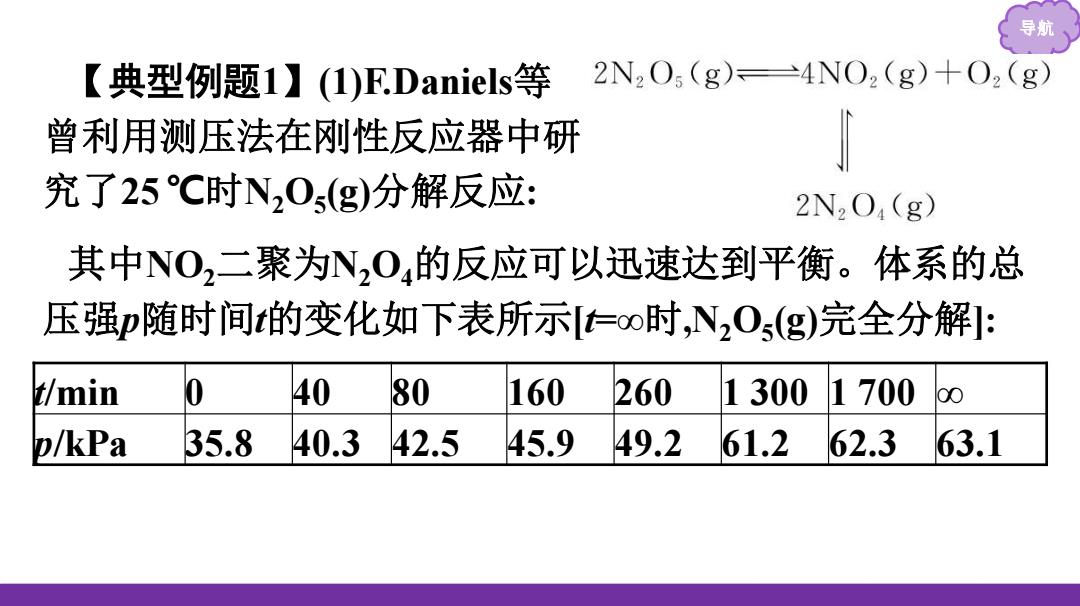
导月 【典型例题1】(1)F.Daniels等 2N2O5(g)=4NO2(g)+O2(g) 曾利用测压法在刚性反应器中研 究了25C时N20s(g)分解反应: 2N2O4(g) 其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总 压强p随时间t的变化如下表所示仁oo时,N0s(g)完全分解: t/min 40 80 160 260 1300 1700 00 p/kPa 35.8 40.3 42.5 45.9 49.2 61.2 62.3 63.1
导航 【典型例题1】(1)F.Daniels等 曾利用测压法在刚性反应器中研 究了25 ℃时N2O5 (g)分解反应: 其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总 压强p随时间t的变化如下表所示[t=∞时,N2O5 (g)完全分解]: t/min 0 40 80 160 260 1 300 1 700 ∞ p/kPa 35.8 40.3 42.5 45.9 49.2 61.2 62.3 63.1

导期 ①已知:2N20s(g)2N204(g)+02(g)△H1=-4.4kJmo1 2N02(g)=N204(g)H2=-55.3kJmo1 则反应N20s(g)→2NO2(g)+202(g)的H=_一 kJ.mol-1。 ②研究表明,N20s(g)分解的反应速率=2×103×pN20(kPa minl),=62min时,测得体系中po2=2.9kPa,则此时的pN20s= kPa,= _kPa'min-l
导航 ①已知:2N2O5(g) 2N2O4(g)+O2(g) ΔH1=-4.4 kJ·mol-1 2NO2(g) N2O4(g) ΔH2=-55.3 kJ·mol-1 则反应 N2O5(g) 2NO2(g)+𝟏 𝟐 O2(g)的 ΔH= kJ·mol-1 。 ②研究表明,N2O5(g)分解的反应速率 v=2×10-3 ×𝒑𝐍𝟐 𝐎𝟓 (kPa· min-1 ),t=62 min 时,测得体系中𝒑𝐎𝟐 =2.9 kPa,则此时的𝒑𝐍𝟐 𝐎𝟓 = kPa,v= kPa·min-1

导 ③若提高反应温度至35℃,则N,0sg)完全分解后体系压强 p(35C) (填“大于”“等于”或“小于)63.1kPa,原因 是 ④25C时N204(g)一2NO2(g)反应的平衡常数K。一(K, 为以分压表示的平衡常数,计算结果保留1位小数)
导航 ③若提高反应温度至35 ℃,则N2O5 (g)完全分解后体系压强 p∞ (35 ℃) (填“大于”“等于”或“小于”)63.1 kPa,原因 是 。 ④25 ℃时N2O4 (g) 2NO2 (g)反应的平衡常数Kp = (Kp 为以分压表示的平衡常数,计算结果保留1位小数)

导航 (2)对于反应2N20s(g)→4NO2(g)+O2(g),有人提出如下反应 历程: 第一步:N205=NO2+NO3快速平衡 第二步:NO2+NO3→NO+NO2+O2慢反应 第三步:NO+NO32NO2快反应
导航 (2)对于反应2N2O5 (g)→4NO2 (g)+O2 (g),有人提出如下反应 历程: 第一步:N2O5 NO2+NO3 快速平衡 第二步:NO2+NO3 NO+NO2+O2 慢反应 第三步:NO+NO3 2NO2 快反应

其中可近似地认为第二步反应不影响第一步的平衡。下列 表述正确的是 填字母)。 A.(第一步的逆反应)>y(第二步反应) B.反应的中间产物只有NO3 C第二步中NO2与NO3的碰撞仅部分有效 D第三步反应活化能较高
导航 其中可近似地认为第二步反应不影响第一步的平衡。下列 表述正确的是 (填字母)。 A.v(第一步的逆反应)>v(第二步反应) B.反应的中间产物只有NO3 C.第二步中NO2与NO3的碰撞仅部分有效 D.第三步反应活化能较高