
全程设计 第三章 烃的衍生物 实验活动1 乙酸乙酯的制备与性质
第三章 烃的衍生物 实验活动1 乙酸乙酯的制备与性质

实验准备 (一)实验目的 1.学习制备乙酸乙酯的方法。 2.加深对酯化反应和酯的水解的认识。 (二)实验原理 1.乙酸和乙醇在浓硫酸催化条件下,能够发生化学反应,化学 方程式为CH,COOH+HOCH,CH,题酸CH,COOC2H+H,0
一、实验准备 (一)实验目的 1.学习制备乙酸乙酯的方法。 2.加深对酯化反应和酯的水解的认识。 (二)实验原理 1.乙酸和乙醇在浓硫酸催化条件下,能够发生化学反应,化学 方程式为CH3COOH+HOCH2CH3 CH3COOC2H5+H2O

2.乙酸乙酯在酸性或者碱性条件下都能发生水解反应。乙 酸乙酯在酸性条件下的水解反应为可逆过程,化学方程式为 浓硫酸 CHCOOCH2CH;+H2O 一△ CH3COOH+CH3CHOH。乙 酸乙酯在碱性条件下水解完全,反应过程可表示如下: △CHsCOOH+-CH,CH,OH CH3COOCH2CH3+H2O- CH3COOH+NaOH A.CH3COONa+H20 也可以写总反应的化学方程式: CH;COOCH2CH3+NaOHA.CH3COONa+CH3CH2OH
2.乙酸乙酯在酸性或者碱性条件下都能发生水解反应。乙 酸乙酯在酸性条件下的水解反应为可逆过程,化学方程式为 CH3COOCH2CH3+H2O CH3COOH+CH3CH2OH。乙 酸乙酯在碱性条件下水解完全,反应过程可表示如下: 也可以写总反应的化学方程式: CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH CH3COOCH2CH3+H2O CH3COOH+CH3CH2OH CH3COOH+NaOH CH3COONa+H2O

(三)实验用品 试管、试管夹、烧杯、量筒、胶头滴管、玻璃导管、乳胶 管、橡胶塞、铁架台、酒精灯、火柴、秒表、碎瓷片。 乙醇、乙酸、浓硫酸、饱和Na2CO3溶液、乙酸乙酯、蒸 馏水、3molL1HSO4溶液、6moL1NaOH溶液
(三)实验用品 试管、试管夹、烧杯、量筒、胶头滴管、玻璃导管、乳胶 管、橡胶塞、铁架台、酒精灯、火柴、秒表、碎瓷片。 乙醇、乙酸、浓硫酸、饱和Na2CO3溶液、乙酸乙酯、蒸 馏水、3 mol·L-1 H2SO4溶液、6 mol·L-1 NaOH溶液
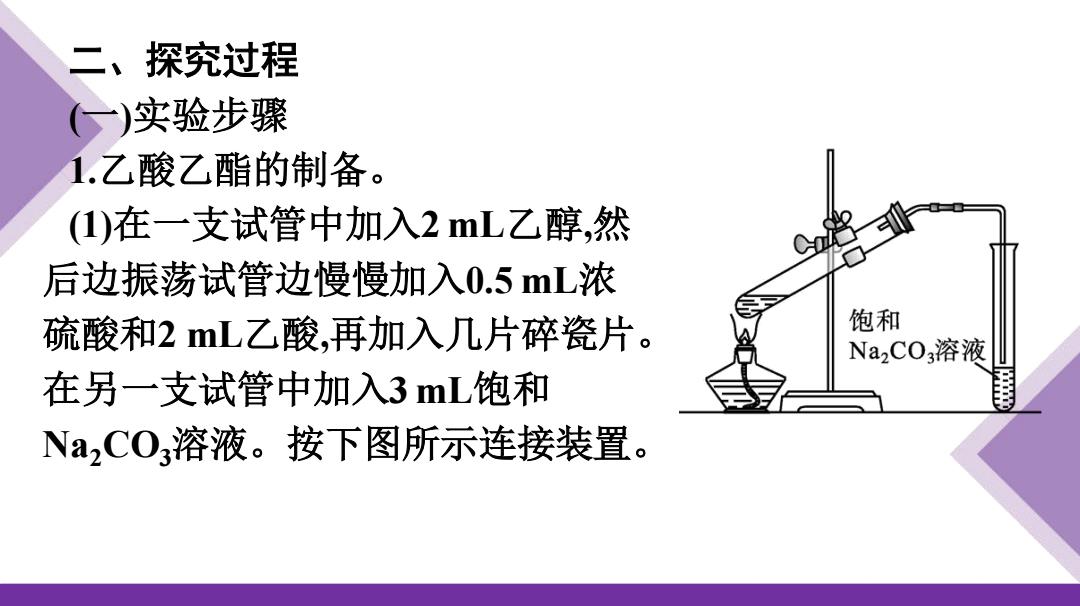
二、探究过程 (一)实验步骤 1.乙酸乙酯的制备。 (1)在一支试管中加入2mL乙醇,然 后边振荡试管边慢慢加入0.5mL浓 硫酸和2mL乙酸,再加入几片碎瓷片。 饱和 Na2C03溶液 在另一支试管中加入3mL饱和 Na2CO3溶液。按下图所示连接装置
二、探究过程 (一)实验步骤 1.乙酸乙酯的制备。 (1)在一支试管中加入2 mL乙醇,然 后边振荡试管边慢慢加入0.5 mL浓 硫酸和2 mL乙酸,再加入几片碎瓷片。 在另一支试管中加入3 mL饱和 Na2CO3溶液。按下图所示连接装置

(2)用小火加热试管里的混合物,将产生的蒸气经导管通到 饱和Na2C03溶液的上方约0.5cm处,可观察到试管内饱和 Na2CO3溶液液面上出现 。反应一段时间后,取 下盛有Na,CO3溶液的试管,并停止加热。 (3)振荡盛有Na2C03溶液的试管,静置。待溶液分层后,观察 上层的油状液体,并注意闻气味。可闻到有香味
(2)用小火加热试管里的混合物,将产生的蒸气经导管通到 饱和Na2CO3溶液的上方约0.5 cm处,可观察到试管内饱和 Na2CO3溶液液面上出现 油状物质 。反应一段时间后,取 下盛有Na2CO3溶液的试管,并停止加热。 (3)振荡盛有Na2CO3溶液的试管,静置。待溶液分层后,观察 上层的油状液体,并注意闻气味。可闻到有香味

2.乙酸乙酯的水解。 在A、B、C三支试管里各加入6滴乙酸乙酯。再向A试管里 加入5.5mL蒸馏水;向B试管里加入0.5mL3moL1HS04 溶液和5.0mL蒸馏水;向C试管里加入0.5mL6moL1 NaOH溶液和5.0mL蒸馏水。振荡均匀后,把三支试管都放入 70~80℃的水浴里加热。比较试管里乙酸乙酯气味消失的快 慢。 经实验现象可知,三支试管中乙酸乙酯气味消失最快的是 试管,消失最慢的是 试管
2.乙酸乙酯的水解。 在A、B、C三支试管里各加入6滴乙酸乙酯。再向A试管里 加入5.5 mL蒸馏水;向B试管里加入0.5 mL 3 mol·L-1 H2SO4 溶液和5.0 mL蒸馏水;向C试管里加入0.5 mL 6 mol·L-1 NaOH溶液和5.0 mL蒸馏水。振荡均匀后,把三支试管都放入 70~80 ℃的水浴里加热。比较试管里乙酸乙酯气味消失的快 慢。 经实验现象可知,三支试管中乙酸乙酯气味消失最快的是 C 试管,消失最慢的是 A 试管

(二)实验注意事项 1.乙酸乙酯的制备中操作时应注意试剂加入的顺序,先加乙 醇,然后慢慢加入浓硫酸和乙酸。 2.乙酸乙酯的制备中乙醇要过量,反应过程中不断蒸出产物, 以促进平衡向生成酯的方向移动。 3.乙酸乙酯的制备实验中,要注意控制酯化反应的温度。反 应温度过低,酯化反应不完全;温度过高,则易发生醇的脱水和 氧化等副反应
(二)实验注意事项 1.乙酸乙酯的制备中操作时应注意试剂加入的顺序,先加乙 醇,然后慢慢加入浓硫酸和乙酸。 2.乙酸乙酯的制备中乙醇要过量,反应过程中不断蒸出产物, 以促进平衡向生成酯的方向移动。 3.乙酸乙酯的制备实验中,要注意控制酯化反应的温度。反 应温度过低,酯化反应不完全;温度过高,则易发生醇的脱水和 氧化等副反应

4.实验时导管末端不要插入碳酸钠溶液,以防止倒吸;长导管 兼有导气和冷凝的作用。 5.乙酸乙酯的水解中,要注意控制变量,如碱的浓度、总体积 和水浴温度
4.实验时导管末端不要插入碳酸钠溶液,以防止倒吸;长导管 兼有导气和冷凝的作用。 5.乙酸乙酯的水解中,要注意控制变量,如碱的浓度、总体积 和水浴温度

三、思考交流 1.乙酸乙酯的水解实验,除了通过乙酸乙酯气味消失的快慢 来比较酯的水解速率外,还有什么方法可用来比较乙酸乙酯 在不同条件下水解速率的差异? 提示:还可以通过酯层消失的快慢比较。也可以在水层中滴 入石蕊溶液以指示水层,便于观察酯与水之间的界面,并且可 以根据水层由紫色变为红色来判断水解产物乙酸的生成
三、思考交流 1.乙酸乙酯的水解实验,除了通过乙酸乙酯气味消失的快慢 来比较酯的水解速率外,还有什么方法可用来比较乙酸乙酯 在不同条件下水解速率的差异? 提示:还可以通过酯层消失的快慢比较。也可以在水层中滴 入石蕊溶液以指示水层,便于观察酯与水之间的界面,并且可 以根据水层由紫色变为红色来判断水解产物乙酸的生成