
全程设计 章末核心素养整合
章末核心素养整合

知识体系构建 专题归纳突破
知识体系构建 专题归纳突破
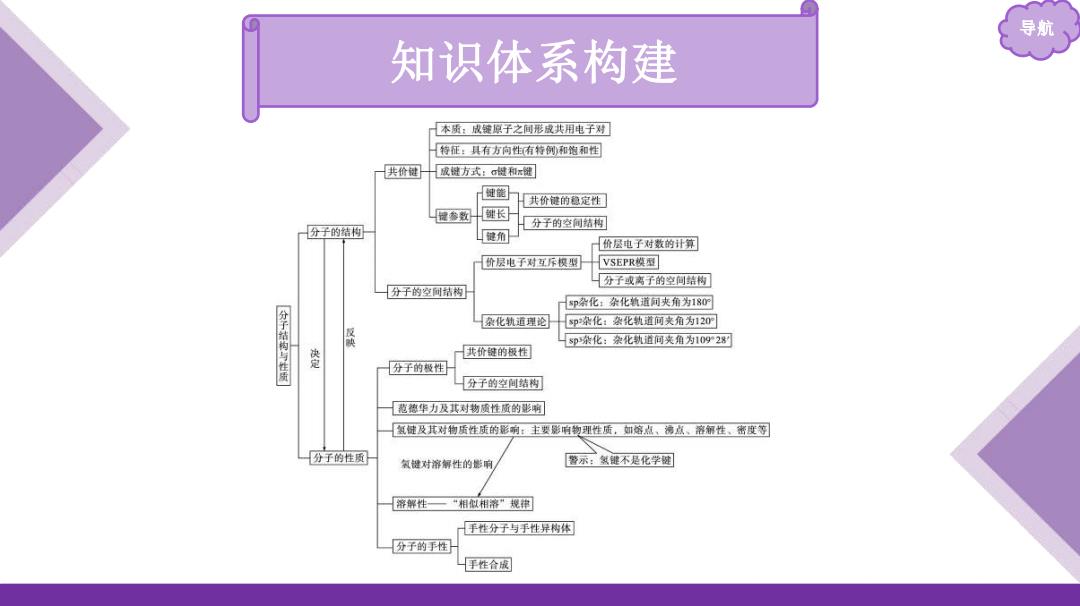
导航 知识体系构建 本质:成键原子之间形成共用电子对 特征:具有方向性有特例和饱和性 共价键 成键方式:做和键 健篚 共价健的稳定性 健参数 键长 分子的结构 分子的空侧结构 健角 价层电子对数的计算 价层电子对互斥模型 VSEPR模型 分子或离子的空间结构 分子的空创结构 P杂化:杂化轨道间夹角为180 分子结构与性质 杂化轨通理论 5p染化:杂化执道间夹角为120 sp杂化:杂化轨道间夹角为1092 邊 共价键的极性 分子的极性 分子的空间结构 苞德华力及其对物质性质的影啊 氢健及其对物质性质的形响:主要影响物理性质,如熔点,滑点、溶钢性、密度等 分子的性质 氧提对溶解性的影响 警示:敏键不是化学腿 溶解性一“相似相溶”规掉 手性分子与手性异构体 分子的手性 手性合成
导航 知识体系构建

导航 专题归纳突破 专题一分子(离子空间结构与杂化轨道类型的判断 1利用价层电子对互斥模型判断共价分子的空间结构。 由价层电子对互斥模型(VSEPR模型)判断分子的空间结构需 要注意:当中心原子无孤电子对时,分子的空间结构与价层电 子对互斥模型一致;当中心原子有孤电子对时,分子的空间结 构与价层电子对互斥模型不一致
导航 专题归纳突破 专题一分子(离子)空间结构与杂化轨道类型的判断 1.利用价层电子对互斥模型判断共价分子的空间结构。 由价层电子对互斥模型(VSEPR模型)判断分子的空间结构需 要注意:当中心原子无孤电子对时,分子的空间结构与价层电 子对互斥模型一致;当中心原子有孤电子对时,分子的空间结 构与价层电子对互斥模型不一致
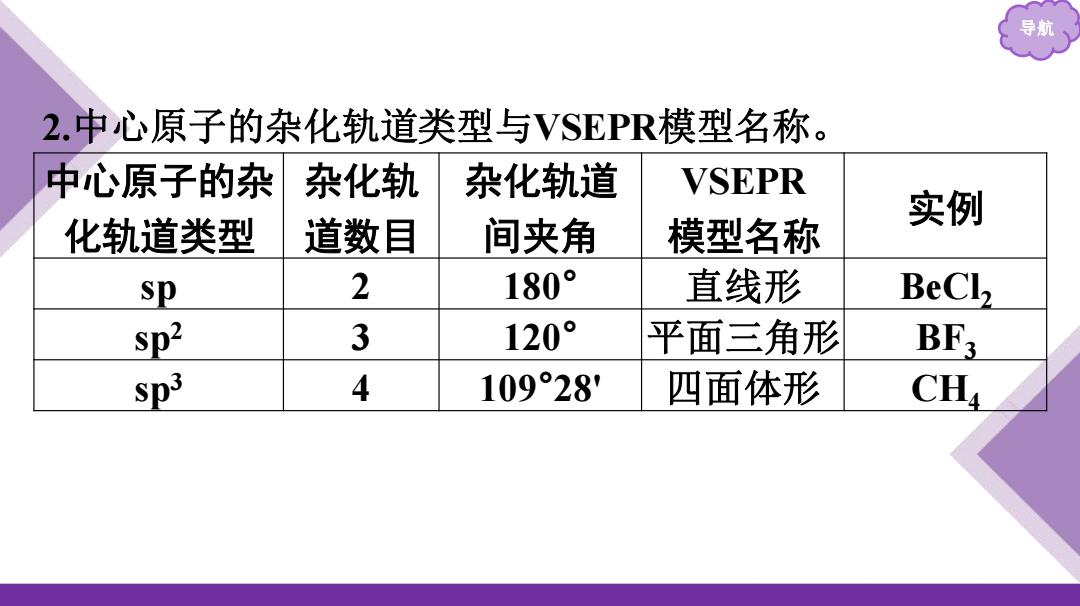
导 2.中心原子的杂化轨道类型与VSEPR模型名称。 中心原子的杂 杂化轨 杂化轨道 VSEPR 实例 化轨道类型 道数目 间夹角 模型名称 sp 2 180° 直线形 BeCl2 sp2 3 120° 平面三角形 BF3 sp3 4 109°28 四面体形 CH
导航 2.中心原子的杂化轨道类型与VSEPR模型名称。 中心原子的杂 化轨道类型 杂化轨 道数目 杂化轨道 间夹角 VSEPR 模型名称 实例 sp 2 180° 直线形 BeCl2 sp2 3 120° 平面三角形 BF3 sp3 4 109°28' 四面体形 CH4
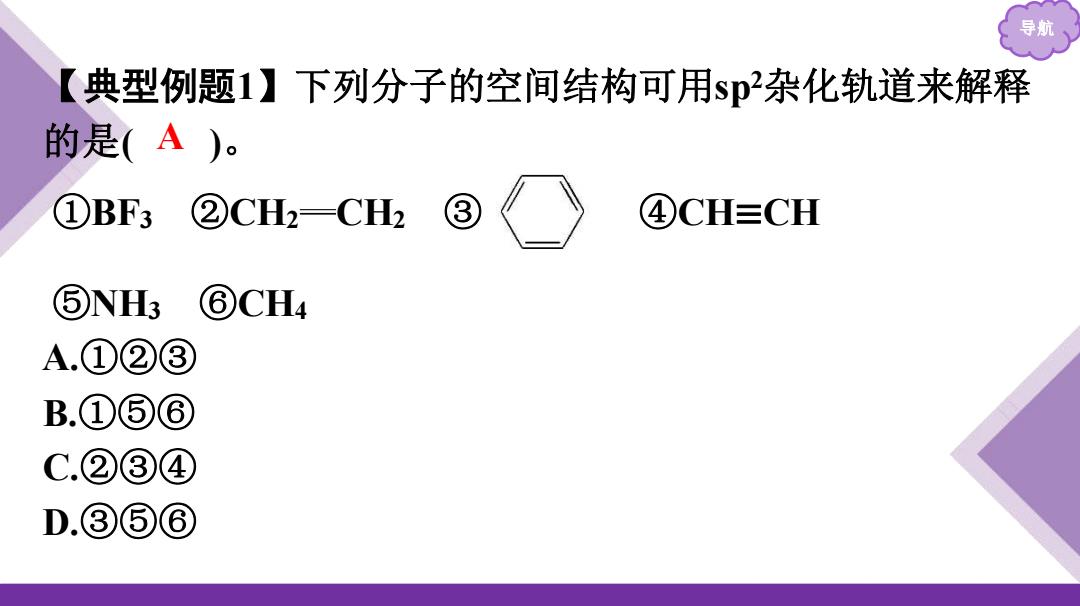
导航 典型例题1】下列分子的空间结构可用sp杂化轨道来解释 的是(A)。 ①BF3②CH2CH2③ ④CH≡CH ⑤NH3 ⑥CH4 A.①②③ B.①⑤⑥ C.②③④ D.③⑤⑥
导航 【典型例题1】下列分子的空间结构可用sp2杂化轨道来解释 的是( )。 ①BF3 ②CH2 CH2 ③ ④CH≡CH ⑤NH3 ⑥CH4 A.①②③ B.①⑤⑥ C.②③④ D.③⑤⑥ A

导航 解析:sp杂化轨道间夹角为120°,BF3为平面三角形且F—B一 F的夹角为120°;②C2H4中碳原子以sp杂化,未杂化的2p轨道 重叠形成π键;③与②相似;④乙炔中的碳原子为sp杂化,未杂 化的2p轨道重叠形成π键;⑤NH中的氮原子为sp3杂化;⑥ CH4中的碳原子为sp杂化
导航 解析:sp2杂化轨道间夹角为120°,BF3为平面三角形且F—B— F的夹角为120° ;②C2H4中碳原子以sp2杂化,未杂化的2p轨道 重叠形成π键;③与②相似;④乙炔中的碳原子为sp杂化,未杂 化的2p轨道重叠形成π键;⑤NH3中的氮原子为sp3杂化;⑥ CH4中的碳原子为sp3杂化

导航 专题二分子极性的判断方法 1.根据正、负电中心是否重合判断。 当分子中正、负电中心重合时,为非极性分子;当分子中正、 负电中心不重合时,为极性分子。 如$03为平面正三角形结构,硫原子位于正三角形的中心,三 个氧原子位于正三角形的三个顶点上,结构对称,正、负电中 心重合,因此S03为非极性分子
导航 专题二分子极性的判断方法 1.根据正、负电中心是否重合判断。 当分子中正、负电中心重合时,为非极性分子;当分子中正、 负电中心不重合时,为极性分子。 如SO3为平面正三角形结构,硫原子位于正三角形的中心,三 个氧原子位于正三角形的三个顶点上,结构对称,正、负电中 心重合,因此SO3为非极性分子

2.利用分子的对称性判断。 当一个分子的对称元素(对称面、对称轴等)相交于一点时,该 分子为非极性分子;当一个分子的对称元素相交于一条线时, 该分子为极性分子。如甲烷分子的对称轴相交于中心碳原子 上,所以甲烷分子为非极性分子。水分子、氨分子的对称元 素相交于一条线,所以这些分子为极性分子。当中心原子指 向不明时,需先预测它的结构,再判断其结构的空间对称性。 如CH2分子,若它的结构简式为C(CH3)4,把一CH3看成CH4 分子中的一H,显然其为非极性分子
导航 2.利用分子的对称性判断。 当一个分子的对称元素(对称面、对称轴等)相交于一点时,该 分子为非极性分子;当一个分子的对称元素相交于一条线时, 该分子为极性分子。如甲烷分子的对称轴相交于中心碳原子 上,所以甲烷分子为非极性分子。水分子、氨分子的对称元 素相交于一条线,所以这些分子为极性分子。当中心原子指 向不明时,需先预测它的结构,再判断其结构的空间对称性。 如C5H12分子,若它的结构简式为C(CH3 )4 ,把—CH3看成CH4 分子中的—H,显然其为非极性分子

导加 3从分子的空间结构判断。 当多原子分子的结构呈直线形、平面正三角形、正四面体形 时,该分子为非极性分子;否则,为极性分子。如BeCl2、C02、 CS,分子呈直线形,SO3、BF3分子呈平面正三角形,CH4 CCL4、SiCL等分子呈正四面体形,PCls分子呈三角双锥形,它 们都为非极性分子。H,O、SO2分子呈V形,NH3分子呈三角 锥形,它们都为极性分子
导航 3.从分子的空间结构判断。 当多原子分子的结构呈直线形、平面正三角形、正四面体形 时,该分子为非极性分子;否则,为极性分子。如BeCl2、CO2、 CS2分子呈直线形,SO3、BF3分子呈平面正三角形,CH4、 CCl4、SiCl4等分子呈正四面体形,PCl5分子呈三角双锥形,它 们都为非极性分子。H2O、SO2分子呈V形,NH3分子呈三角 锥形,它们都为极性分子