
全程设计 实验活动 简单配合物的形成
实验活动 简单配合物的形成

导航 一、实验准备 (一)实验目的 1.加深对配合物的认识。 2.了解配合物的形成。 3.探究简单离子与配离子的区别
导航 一、实验准备 (一)实验目的 1.加深对配合物的认识。 2.了解配合物的形成。 3.探究简单离子与配离子的区别

二)实验原理 配合物是由中心原子或离子与一定数目的中性分子或阴离子 以配位键结合而形成的一类化合物。中心离子形成配合物后 性质不同于原来的金属离子,具有新的化学特性。 (三)实验用品 1.仪器:试管、胶头滴管。 2.药品:硫酸铜溶液、氨水、硝酸银溶液、氯化钠溶液、氯 化铁溶液、硫氰化钾溶液、K3F(CN)6溶液、蒸馏水、乙 醇
导航 (二)实验原理 配合物是由中心原子或离子与一定数目的中性分子或阴离子 以配位键结合而形成的一类化合物。中心离子形成配合物后 性质不同于原来的金属离子,具有新的化学特性。 (三)实验用品 1.仪器:试管、胶头滴管。 2.药品:硫酸铜溶液、氨水、硝酸银溶液、氯化钠溶液、氯 化铁溶液、硫氰化钾溶液、K3 [Fe(CN)6 ]溶液、蒸馏水、乙 醇

导航 探究过程 (一)实验步骤及分析解释 1.简单配合物的形成。 序号 实验步骤 实验现象 解释 向盛有硫酸铜 溶液的试管里 Cu2++2NH3H2O-- (1) 出现蓝色沉淀 加入氨水 Cu(OH)24+2NH4
导航 二、探究过程 (一)实验步骤及分析解释 1.简单配合物的形成。 序号 实验步骤 实验现象 解释 (1) 向盛有硫酸铜 溶液的试管里 加入氨水 出现蓝色沉淀 Cu2++2NH3·H2O== Cu(OH)2↓+2 N𝐇𝟒 +
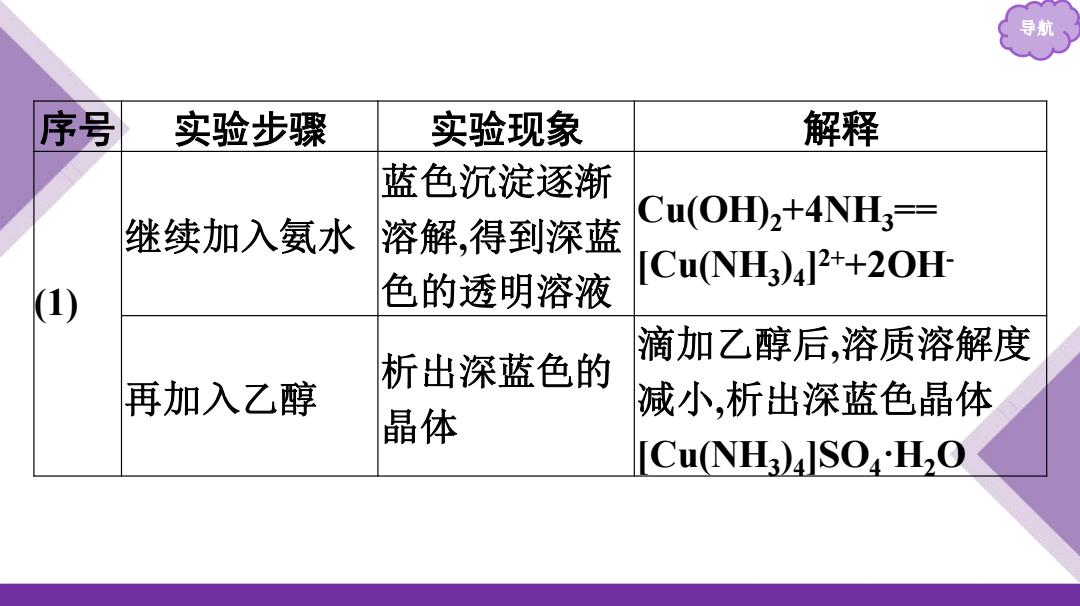
导航 序号 实验步骤 实验现象 解释 蓝色沉淀逐渐 Cu(H),+4NH== 继续加入氨水 溶解,得到深蓝 色的透明溶液 [CuNH3)4]2+20H (1) 滴加乙醇后,溶质溶解度 析出深蓝色的 再加入乙醇 减小,析出深蓝色晶体 晶体 CuNH3)JSOH2O
导航 序号 实验步骤 实验现象 解释 (1) 继续加入氨水 蓝色沉淀逐渐 溶解,得到深蓝 色的透明溶液 Cu(OH)2+4NH3 == [Cu(NH3 )4 ] 2++2OH- 再加入乙醇 析出深蓝色的 晶体 滴加乙醇后,溶质溶解度 减小,析出深蓝色晶体 [Cu(NH3 )4 ]SO4·H2O

导航 序号 实验步骤 实验现象 解释 向盛有氯化钠溶液的试 出现白色沉淀 Ag+CI 管里滴几滴硝酸银溶液 ==AgCIL (2) 白色沉淀消失, AgCl+2NH,== 再滴加氨水 得到澄清的无 色溶液 [AgNH3)2]CI
导航 序号 实验步骤 实验现象 解释 (2) 向盛有氯化钠溶液的试 管里滴几滴硝酸银溶液 出现白色沉淀 Ag++Cl- ==AgCl↓ 再滴加氨水 白色沉淀消失, 得到澄清的无 色溶液 AgCl+2NH3 == [Ag(NH3 )2 ]Cl

导航 思考:根据上述实验现象分析配合物的形成对物质的溶解性 有什么影响? 提示:一些难溶于水的金属氢氧化物、氯化物、溴化物等,可 以溶解于氨水中,形成可溶性的配合物
导航 思考:根据上述实验现象分析配合物的形成对物质的溶解性 有什么影响? 提示:一些难溶于水的金属氢氧化物、氯化物、溴化物等,可 以溶解于氨水中,形成可溶性的配合物
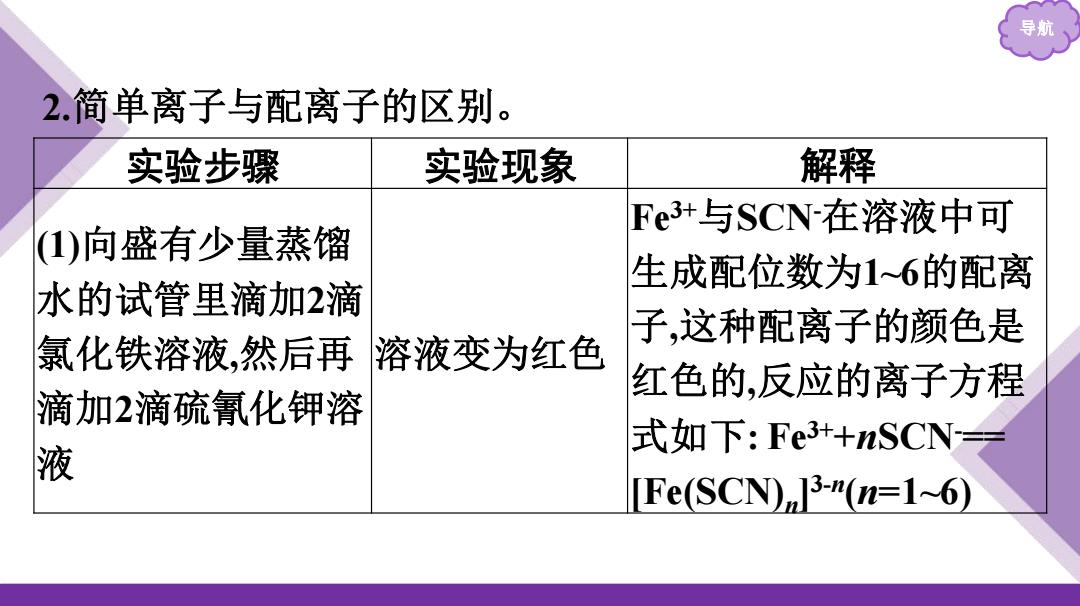
导期 2.简单离子与配离子的区别。 实验步骤 实验现象 解释 Fe3+与SCN-在溶液中可 ()向盛有少量蒸馏 生成配位数为16的配离 水的试管里滴加2滴 子,这种配离子的颜色是 氯化铁溶液,然后再溶液变为红色 红色的,反应的离子方程 滴加2滴硫氰化钾溶 式如下:Fe3++nSCN== 液 [Fe(SCN)]3-(n=1~6)
导航 2.简单离子与配离子的区别。 实验步骤 实验现象 解释 (1)向盛有少量蒸馏 水的试管里滴加2滴 氯化铁溶液,然后再 滴加2滴硫氰化钾溶 液 溶液变为红色 Fe3+与SCN-在溶液中可 生成配位数为1~6的配离 子,这种配离子的颜色是 红色的,反应的离子方程 式如下: Fe3++nSCN-== [Fe(SCN)n ] 3-n (n=1~6)

导航 实验步骤 实验现象 解释 (2)向盛有少量蒸馏 Fe(CN)s3是稳定的配离 水的试管里滴加2滴 子,溶液中游离的Fe3+浓 K3Fe(CN)6J溶液,然没有明显现象 度非常低,不足以与 后再滴加2滴疏氰化 KSCN生成红色物质 钾溶液
导航 实验步骤 实验现象 解释 (2)向盛有少量蒸馏 水的试管里滴加2滴 K3 [Fe(CN)6 ]溶液,然 后再滴加2滴硫氰化 钾溶液 没有明显现象 [Fe(CN)6 ] 3-是稳定的配离 子,溶液中游离的Fe3+浓 度非常低,不足以与 KSCN生成红色物质

导奥 思考:分析上述实验中哪些现象能够说明原来的金属离子形 成了配离子?怎样说明配离子具有不同于原来的金属离子的 化学特性? 提示:根据颜色的变化可以判断有配离子生成。含Fε(CN)63 的溶液中滴加KSCN溶液后溶液不变色,含F+的溶液中滴加 KSCN溶液后溶液呈红色
导航 思考:分析上述实验中哪些现象能够说明原来的金属离子形 成了配离子?怎样说明配离子具有不同于原来的金属离子的 化学特性? 提示:根据颜色的变化可以判断有配离子生成。含[Fe(CN)6 ] 3- 的溶液中滴加KSCN溶液后溶液不变色,含Fe3+的溶液中滴加 KSCN溶液后溶液呈红色