
全程设计 第2课时 分子间的作用力 分子的手性
第2课时 分子间的作用力 分子的手性

课前·基础认知 课堂·重难突破 随堂训练
课前·基础认知 课堂·重难突破 随堂训练

导航 课前·基础认知 自主预习 一、分子间作用力 1.范德华力及其对物质性质的影响。 (1)范德华力是物质的分子之间普遍存在的一种 ,它使得许多物质能以一定的凝聚状态(固态或液态)存 在。 (2)影响因素:一般来说,相对分子质量 ,范德华力 ;分子的极性 ,范德华力
导航 课前·基础认知 自主预习 一、分子间作用力 1.范德华力及其对物质性质的影响。 (1)范德华力是物质的分子之间普遍存在的一种 相互作用 力 ,它使得许多物质能以一定的凝聚状态(固态或液态)存 在。 (2)影响因素:一般来说,相对分子质量 越大 ,范德华力 越大 ;分子的极性 越大 ,范德华力 越大

导航 3)范德华力对物质性质的影响。 ①范德华力广泛存在于分子之间,只有分子间充分接近时才 有分子间的相互作用力,如固态和液态物质中。 ②范德华力主要影响物质的熔点、沸点、溶解度等物理性质。 ③范德华力无方向性和饱和性。只要分子周围空间允许,分 子总是尽可能多地吸引其他分子
导航 (3)范德华力对物质性质的影响。 ①范德华力广泛存在于分子之间,只有分子间充分接近时才 有分子间的相互作用力,如固态和液态物质中。 ②范德华力主要影响物质的熔点、沸点、溶解度等物理性质。 ③范德华力无方向性和饱和性。只要分子周围空间允许,分 子总是尽可能多地吸引其他分子

导航 2.氢键及其对物质性质的影响。 ()氢键的定义及表示方法。 ①氢键是由已经与电负性很大的原子形成共价键的 与另一个电负性很大的原子之间形成的作用力。 ②表示方法:氢键的通式可用X一H…Y一表示。式中X和Y表 示 ,“一”表示 ,“…”表示
导航 2.氢键及其对物质性质的影响。 (1)氢键的定义及表示方法。 ①氢键是由已经与电负性很大的原子形成共价键的 氢原子 与另一个电负性很大的原子之间形成的作用力。 ②表示方法:氢键的通式可用X—H…Y—表示。式中X和Y表 示 N、O、F ,“—”表示 共价键 ,“…”表示 氢键

导航 微思考1哪些物质中容易形成氢键? 提示:氢键普遍存在于已经与N、O、F等电负性很大的原子 形成共价键的氢原子与另外的N、O、F等电负性很大的原 子之间。所以氢键一般存在于含N一H、H一O、H一F的分 子间,或有机化合物中的醇类和羧酸类等物质的分子间
导航 微思考1哪些物质中容易形成氢键? 提示:氢键普遍存在于已经与N、O、F等电负性很大的原子 形成共价键的氢原子与另外的N、O、F等电负性很大的原 子之间。所以氢键一般存在于含N—H、H—O、H—F的分 子间,或有机化合物中的醇类和羧酸类等物质的分子间
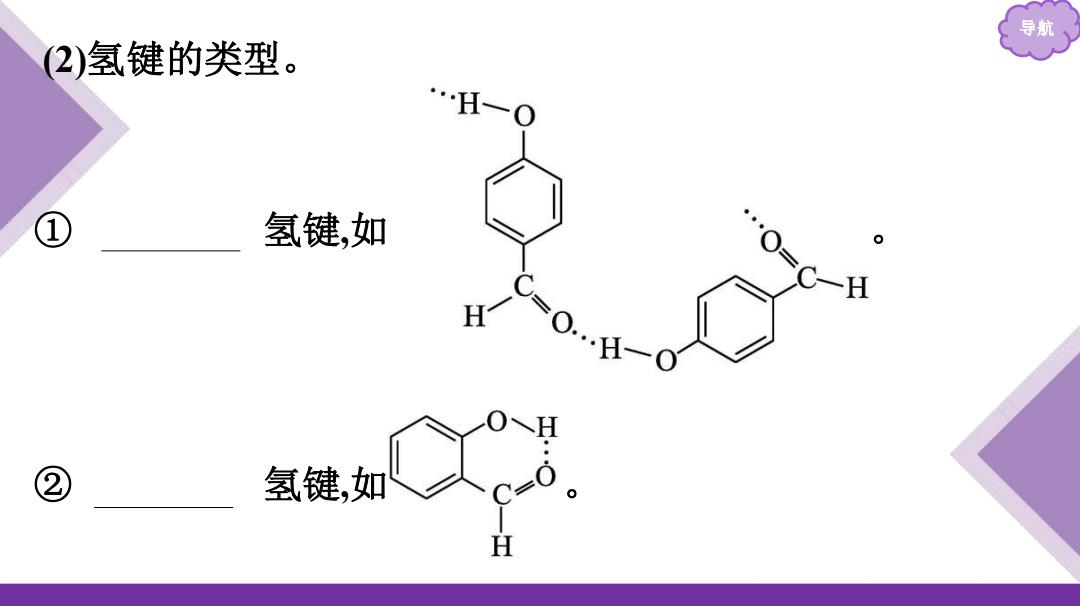
导航 2)氢键的类型。 …H一 ① 氢键,如 ”··○=C- H =○··.于—● ② 氢键,如 H
导航 (2)氢键的类型 。 ① 分子间 氢键,如 。 ② 分子内 氢键,如

导期 3)氢键对物质性质的影响。 ①当形成 氢键时,物质的熔、沸点较高。 ②当形成 氢键时,物质的熔、沸点较低。 ③氢键也影响物质的电离、溶解等过程。 微思考2范德华力、氢键、共价键的强弱都能影响分子的稳 定性吗? 提示:范德华力、氢键不影响分子的稳定性。共价键的强弱 影响分子的稳定性
导航 (3)氢键对物质性质的影响。 ①当形成 分子间 氢键时,物质的熔、沸点较高。 ②当形成 分子内 氢键时,物质的熔、沸点较低。 ③氢键也影响物质的电离、溶解等过程。 微思考2范德华力、氢键、共价键的强弱都能影响分子的稳 定性吗? 提示:范德华力、氢键不影响分子的稳定性。共价键的强弱 影响分子的稳定性
导航 3.溶解性。 1)“相似相溶”规律。 非极性溶质一般能溶于 溶剂,极性溶质一般能溶 于 溶剂。如蔗糖和氨 溶于水, 溶于四 氯化碳;萘和碘 溶于四氯化碳, 溶于水
导航 3.溶解性。 (1)“相似相溶”规律。 非极性溶质一般能溶于 非极性 溶剂,极性溶质一般能溶 于 极性 溶剂。如蔗糖和氨 易 溶于水, 难 溶于四 氯化碳;萘和碘 易 溶于四氯化碳, 难 溶于水

导月 (2)影响物质溶解性的因素。 ①外界因素:主要有 等。 ②氢键:溶剂和溶质之间的氢键相互作用力越大,溶解性越 (填“好”或“差”)。 ③分子结构的相似性:溶质和溶剂的分子结构相似程度越大, 其溶解性越 如乙醇与水 ,而戊醇在水中的 溶解度明显较小。 ④溶质是否与水反应:溶质与水发生反应,溶质的溶解度会 。如S02与水反应生成的H,S03可溶于水,故S02的溶 解度
导航 (2)影响物质溶解性的因素。 ①外界因素:主要有 温度 、 压强 等。 ②氢键:溶剂和溶质之间的氢键相互作用力越大,溶解性越 好 (填“好”或“差”)。 ③分子结构的相似性:溶质和溶剂的分子结构相似程度越大, 其溶解性越 好 。如乙醇与水 互溶 ,而戊醇在水中的 溶解度明显较小。 ④溶质是否与水反应:溶质与水发生反应,溶质的溶解度会 增大 。如SO2与水反应生成的H2SO3可溶于水,故SO2的溶 解度 增大