
全程设计 第四节 配合物与超分子
第四节 配合物与超分子
素养·目标定位 课前·基础认知 课堂·重难突破 随堂训练
素养·目标定位 课前·基础认知 课堂·重难突破 随堂训练

素养·目标定位 目标素养 1.知道配位键的特点,认识简单的配合物的成键特征,了解配 位化合物的存在与应用。培养宏观辨识与微观探析的化学学 科核心素养。 2.了解人类探索物质结构的过程,认同“物质结构的探索是无 止境的”观点,了解从原子、分子、超分子等不同尺度认识物 质结构的意义。培养科学探究与创新意识的化学学科核心素 养
导航 素养·目标定位 目 标 素 养 1.知道配位键的特点,认识简单的配合物的成键特征,了解配 位化合物的存在与应用。培养宏观辨识与微观探析的化学学 科核心素养。 2.了解人类探索物质结构的过程,认同“物质结构的探索是无 止境的”观点,了解从原子、分子、超分子等不同尺度认识物 质结构的意义。培养科学探究与创新意识的化学学科核心素 养
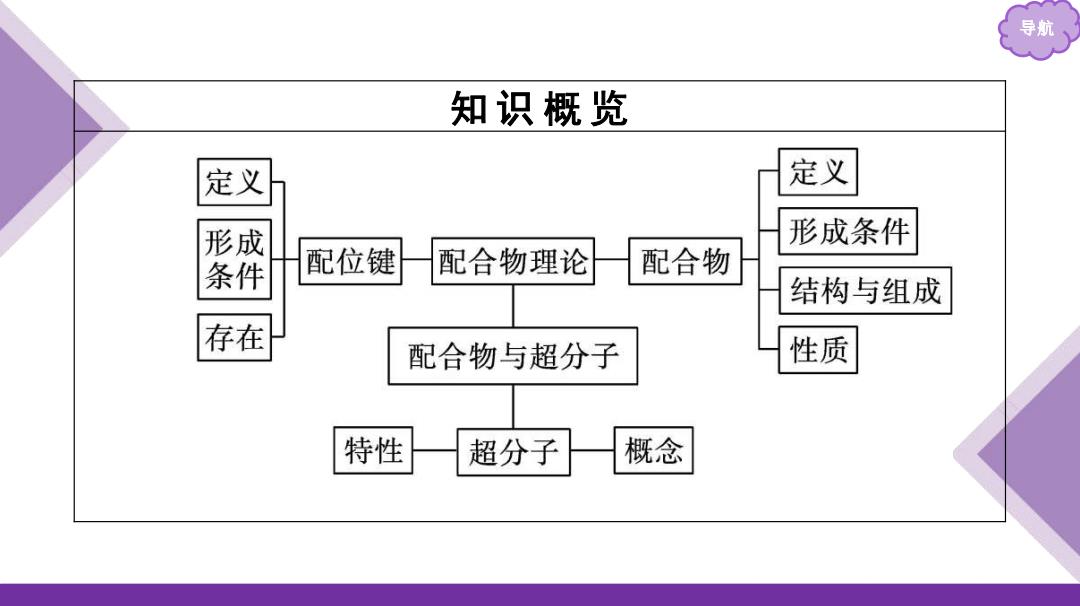
导航 知识概览 定义 定义 形成 形成条件 条件 配位键 配合物理论 配合物 结构与组成 存在 配合物与超分子 性质 特性 超分子 概念
导航 知 识 概 览

导航 课前·基础认知 自主预习 一、配合物 1.配位键。 由一个原子单方面提供 ,而另一个原子提供 而形成的共价键,即“电子对给予一接受”键被称为 配位键
导航 课前·基础认知 自主预习 一、配合物 1.配位键。 由一个原子单方面提供 孤电子对 ,而另一个原子提供 空轨道 而形成的共价键,即“电子对给予—接受”键被称为 配位键

导航 2.配位化合物。 (1)定义: 与某些 分子或离子(称为 )以 结合形成 的化合物称为配位化合物,简称配合物
导航 2.配位化合物。 (1)定义: 金属离子或原子(称为中心离子或原子) 与某些 分子或离子(称为 配体或配位体 )以 配位键 结合形成 的化合物称为配位化合物,简称配合物
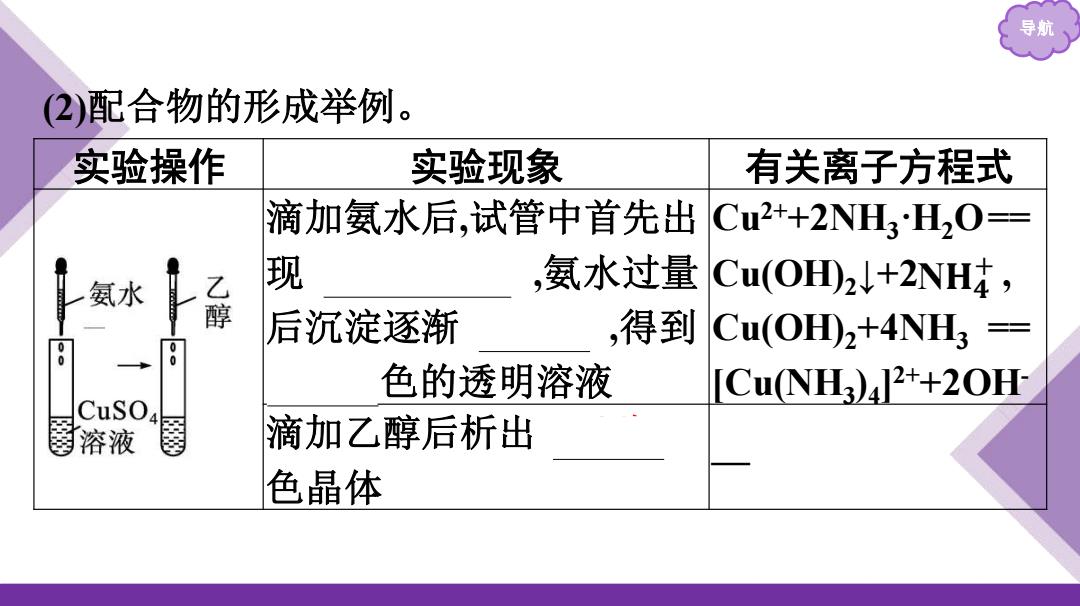
导航 2)配合物的形成举例。 实验操作 实验现象 有关离子方程式 滴加氨水后,试管中首先出 Cu2++2NH3H2O== 氨水 乙 现 ,氨水过量 Cu(OH)24+2NH 后沉淀逐渐 ,得到 Cu(OH)2+4NH3 0 0 0 0 色的透明溶液 CuNH3)2++20H Cuso 溶液 滴加乙醇后析出 色晶体
导航 (2)配合物的形成举例。 实验操作 实验现象 有关离子方程式 滴加氨水后,试管中首先出 现 蓝色沉淀 ,氨水过量 后沉淀逐渐 溶解 ,得到 深蓝 色的透明溶液 Cu2++2NH3·H2O== Cu(OH)2↓+2 , Cu(OH)2+4NH3 == [Cu(NH3 )4 ] 2++2OH- 滴加乙醇后析出 深蓝 色晶体 — N𝐇𝟒 +
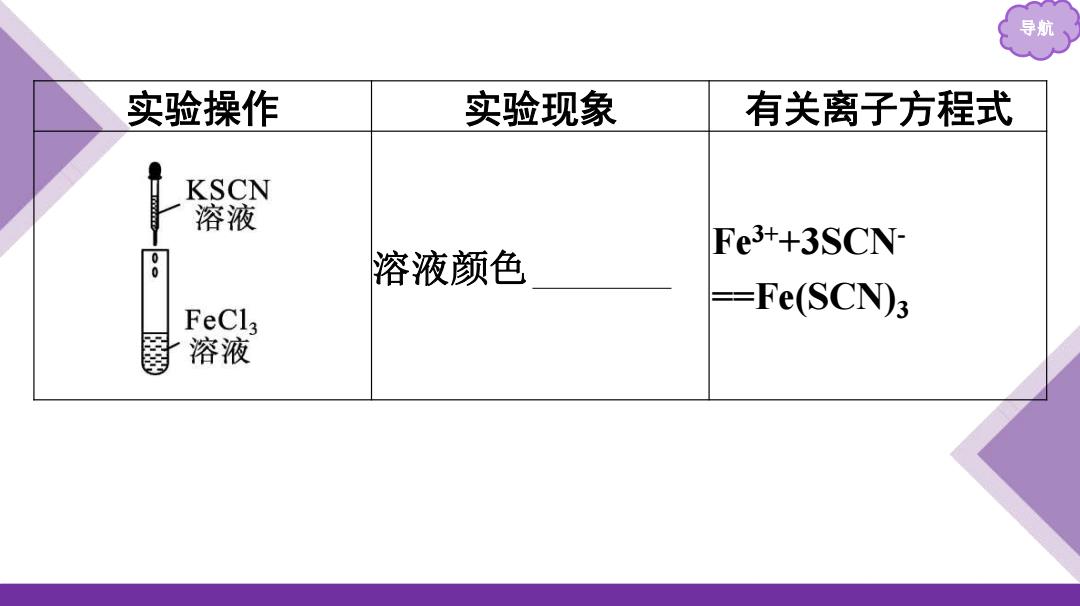
导航 实验操作 实验现象 有关离子方程式 KSCN 溶液 Fe3++3SCN 0 溶液颜色 FeCl3 --Fe(SCN)3 溶液
导航 实验操作 实验现象 有关离子方程式 溶液颜色 变红 Fe3++3SCN- ==Fe(SCN)3
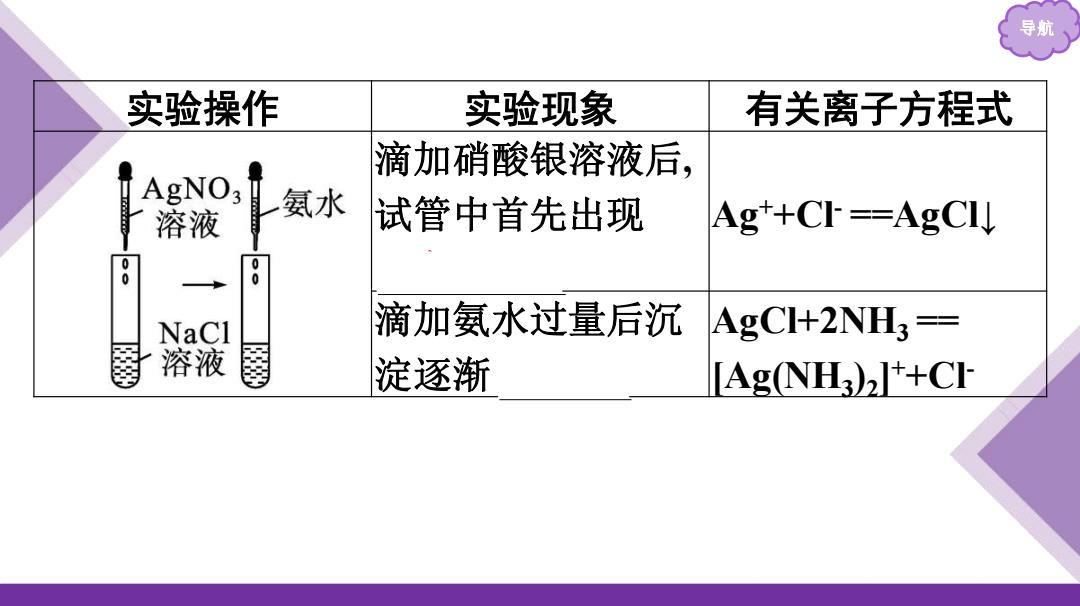
导航 实验操作 实验现象 有关离子方程式 滴加硝酸银溶液后, 3 AgNO3 溶液 氨水 试管中首先出现 Ag+C==AgCI↓ 0 0 NaCl 滴加氨水过量后沉AgC+2NH3= 溶液 淀逐渐 AgNH+CI
导航 实验操作 实验现象 有关离子方程式 滴加硝酸银溶液后, 试管中首先出现 白色沉淀 Ag++Cl- ==AgCl↓ 滴加氨水过量后沉 淀逐渐 溶解 AgCl+2NH3 == [Ag(NH3 )2 ] ++Cl-

导期 上述实验现象产生的原因主要是配离子的形成。以配离子 [CuNH3)42+为例,NH分子中氮原子提供的 进 入Cu2+的 ,Cu+与NH,分子中的氮原子通过 形成配位键。配离子[CuNH3)42+ NH3 H3N一Cu一NH3 可表示为 NH
导航 上述实验现象产生的原因主要是配离子的形成。以配离子 [Cu(NH3 )4 ] 2+为例,NH3分子中氮原子提供的 孤电子对 进 入Cu2+的 空轨道 ,Cu2+与NH3分子中的氮原子通过 共用 氮原子提供的孤电子对 形成配位键。配离子[Cu(NH3 )4 ] 2+ 可表示为